钩毛茜草蒽醌类化学成分的研究
2022-06-18李银黄鸿运黄勇何燕玲汪洋李勇军
李银 黄鸿运 黄勇 何燕玲 汪洋 李勇军
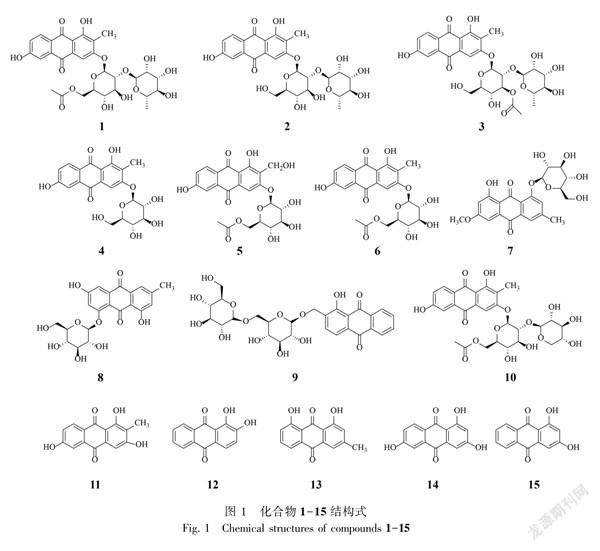
摘要:為研究我国特有植物钩毛茜草(Rubia oncotricha)的化学成分,该文将钩毛茜草70%乙醇提取物采用硅胶、凝胶柱色谱等进行分离纯化,并对所得化合物进行结构鉴定。结果表明:从钩毛茜草中共分离了15个蒽醌类化合物,分别是2methyl1,3,6trihydroxy9,10anthraquinone3O(6′Oacetyl)αrhamnosyl(1→2)βglucoside(1)、2methyl1,3,6trihydroxy9,10anthraquinone3Oαrhamnosyl(1→2)βglucoside(2)、2methyl1,3,6trihydroxy9,10anthraquinone3O(3′Oacetyl)αrhamnosyl(1→2)βglucoside(3)、2methyl1,3,6trihydroxy9,10anthraquinone3Oβglucoside(4)、1,3,6trihydroxy2hydroxymethyl9,10anthraquinone3O(6′Oacetyl)βDglucopyranoside(5)、2methyl1,3,6trihydroxy9,10anthraquinone3O(6′Oacetyl)βDglucopyranoside(6)、大黄素甲醚8OβD葡萄糖苷(7)、大黄素8OβD葡萄糖苷(8)、digiferruginol11Oβgentiobioside(9)、2methyl1,3,6trihydroxy9,10anthraquinone3O(6′Oacetyl)βDxylopyranosyl(1→2)βDglucopyranoside(10)、6hydroxyrubiadin(11)、1,2二羟基蒽醌(12)、大黄酚(13)、6hydroxyxanthopurpurin(14)、1,3二羟基蒽醌(15)。化合物7、8、14为首次从茜草属植物中分离得到,化合物1-6、9、10、12、13为首次从该药材中分离得到。
关键词: 钩毛茜草, 化学成分, 蒽醌, 分离纯化, 结构鉴定
中图分类号:Q946; R284.1
文献标识码:A
文章编号:10003142(2022)05086608
Chemical constituents of anthraquinone
from Rubia oncotricha
Abstract:To study the chemical constituents of China endemic plant Rubia oncotricha, the compounds were isolated with 70% ethyl alcohol and purified by silica gel, gel column chromatography, and their structures were elucidated by modern spectroscopic techniques. The results showed that fifteen anthraquinone compounds were isolated and identified from R. oncotricha, they were 2methyl1,3,6trihydroxy9,10anthraquinone3O(6′Oacetyl)αrhamnosyl(1→2)βglucoside (1), 2methyl1,3,6trihydroxy9,10anthraquinone3Oαrhamnosyl(1→2)βglucoside (2), 2methyl1,3,6trihydroxy9,10anthraquinone3O(3′Oacetyl)αrhamnosyl(1→2)βglucoside (3), 2methyl1,3,6trihydroxy9,10anthraquinone3Oβglucoside (4), 1,3,6trihydroxy2hydroxymethyl9,10anthraquinone3O(6′Oacetyl)βDglucopyranoside (5), 2methyl1,3,6trihydroxy9,10anthraquinone3O(6′Oacetyl)βDglucopyranoside (6), physcion8OβDglucopyranoside (7), emodin8OβDglucopyranoside (8), digiferruginol11Oβgentiobioside (9), 2methyl1,3,6trihydroxy9,10anthraquinone3O(6′Oacetyl)βDxylopyranosyl(1→2)βDglucopyranoside (10), 6hydroxyrubiadin (11), 1,2dihydroxyanthraquinone (12), chrysophanol (13), 6hydroxyxanthopurpurin (14), 1,3dihydroxyanthraquinone (15). Compounds 7, 8 and 14 are isolated from the genus of Rubia for the first time, compound 1-6, 9, 10, 12, 13 are isolated from R. oncotricha for the first time.
Key words: Rubia oncotricha, chemical constituents, anthraquinone, isolation and purification, structure identification918E1883-B60E-43F4-8D83-EE260E7F3EC7
茜草科(Rubiaceae) 茜草属(Rubia L.) 植物在全世界有70余种,在我国有36种2变种,全国各地均有分布,本属植物多以根入药。目前,已从茜草属不同植物中发现醌类、萜类、环己肽类等多种化学成分,其中绝大部分为蒽醌衍生物(刘路等,2015;陈毅等,2017)。茜草属植物药理活性主要表现在抗菌消炎、抗癌、抗氧化、免疫调节、保肝、镇痛等方面(王晓建和黄胜阳,2012)。钩毛茜草(Rubia oncotricha)为茜草属植物之一,主要分布在广西、四川、贵州、云南等地,用于吐血、衄血、崩漏、支气管炎、跌扑损伤等症的治疗,收载于2003年版《贵州省中药材、民族药材质量标准》(贵州省药品监督管理局,2003;何燕玲等,2019),是贵州省常用中药材之一。此外,《中国植物志》中记载“本种的根在云南文山地区作茜草入药,称小茜草;广西凌云民间作病后补药”(罗献瑞,1999),可见钩毛茜草在民间具有较好的药用价值。
目前,从钩毛茜草中分离得到的蒽醌类化合物主要为蒽醌苷元(汪哲等,2018)。蒽醌是一种分子内含有醌式结构的多环化合物,其种类繁多并广泛存在于多种植物中,此类成分表现出抗菌、抗病毒、抗氧化、抗肿瘤等较好的生物活性(王明明等,2019)。基于钩毛茜草在贵州省少数民族地区的广泛应用和蒽醌类化合物良好的生物活性,为进一步了解钩毛茜草的蒽醌类成分,为该植物后续研究开发提供实验基础,本课题组重点对钩毛茜草中蒽醌类化合物进行研究,采用硅胶、葡聚糖凝胶Sephadex LH20等现代分离纯化技术从中分离鉴定了15个蒽醌类化合物,其中化合物7、8、14为首次从茜草属植物中分离得到,化合物1-6、9、10、12、13为首次从该药材中分离得到。
1材料与仪器
钩毛茜草药材购于贵阳市南明区万东大桥中药材市场,由贵州医科大学龙庆德副教授鉴定为茜草科植物钩毛茜草(Rubia oncotricha)的干燥根及根茎,样品存放在贵州省药物制剂重点实验室。
ACQUITYUPLCTQD超高液相色谱三重四级杆串联质谱仪(美国Waters公司);AgilentQTOF质谱仪(美国Agilent公司);JEOL ECS 400型核磁共振波谱仪(日本电子株式会社);BUCHI R200旋转蒸发仪(瑞士BUCHI公司);ZF7三用紫外分析仪(巩义市予华仪器有限责任公司);KZ20L超纯水机(上海科治环保设备有限公司);200~300目硅胶(青岛海洋化工有限公司);薄层层析硅胶板(青岛海洋化工有限公司);MCI CHP20/P120凝胶(日本三菱公司);Sephadex LH20(瑞士Pharmacia Biotech公司);Toyopearl HW40C、Toyopearl HW40F(日本东曹株式会社);试剂均为分析纯。
2提取与分离
取干燥的钩毛茜草根及根茎5 kg,切碎成1~2 cm小段,加入70%乙醇,回流提取,共提取3次,合并滤液,减压浓缩,得到浸膏。浸膏加水溶解,用有机溶剂萃取,分别得到石油醚部位(55 g)、乙酸乙酯部位(65 g)、正丁醇部位(215 g)和水部位(257 g)。
将正丁醇部位(215 g)过正相硅胶柱,以二氯甲烷-甲醇(50∶1~1∶1)梯度洗脱,得到7个组分:Fr.1~Fr.7。Fr.2经硅胶柱层析(乙酸乙酯-甲醇)、Toyopearl HW40F柱色谱(甲醇)分离得化合物1(1.0 g)、2(1.4 g)、9(11.7 mg)。Fr.3经硅胶柱层析(乙酸乙酯-甲醇、二氯甲烷-甲醇)、Sephadex LH20柱色谱(氯仿-甲醇)、Toyopearl HW40F柱色谱(甲醇)、Toyopearl HW40C柱色谱(氯仿-甲醇)、MCI柱色谱(甲醇-水)分离得化合物3(27.0 mg)、10(7.3 mg)。Fr.4经Sephadex LH20柱色谱(甲醇)、Toyopearl HW40F柱色谱(甲醇)、MCI柱色谱(甲醇-水)分离、正相硅胶柱(二氯甲烷-甲醇)纯化、反相ODS柱色谱(甲醇-水)分离得化合物4(5.5 mg)、5(16.0 mg)、8(7.7 mg)。Fr.6经正相硅胶柱色谱(乙酸乙酯-甲醇)、Sephadex LH20柱色谱(氯仿-甲醇)分离得化合物6(8.7 mg)、7(85.0 mg)。
乙酸乙酯部位(65g)用硅胶柱进行分离,以二氯甲烷-甲醇(50∶1~0∶1)梯度洗脱,得到4个组分:Fr.1~ Fr.4。Fr.1经多次硅胶柱层析(石油醚-乙酸乙酯、乙酸乙酯-甲醇、二氯甲烷-丙酮)、Sephadex LH20柱色谱(氯仿-甲醇)、Toyopearl HW40C柱色谱(甲醇)分离得化合物14(13.8 mg)。Fr.2经多次硅胶柱层析(氯仿-乙酸乙酯、石油醚-乙酸乙酯、二氯甲烷-丙酮)、Sephadex LH20柱色谱(氯仿-甲醇)分离得化合物13(5.2 mg)。 Fr.3经硅胶柱层析(二氯甲烷-丙酮、石油醚-乙酸乙酯)、Sephadex LH20柱色谱(氯仿-甲醇)分离得化合物15(8.3 mg)。Fr.3.6经正相硅胶柱(二氯甲烷-丙酮)、Sephadex LH20柱色谱(氯仿-甲醇)、Toyopearl HW40F柱色谱(甲醇)分离、结晶、重结晶得化合物11(24.3 mg)、12(14.0 mg)。
3結构鉴定
化合物1黄色粉末。ESIMS m/z: 619[M-H]-, 分子式C29H32O15。1HNMR(400 MHz, DMSOd6) δ: 8.10(1H, d, J = 8.6 Hz, H8), 7.47(1H, d, J=2.5 Hz, H5), 7.40(1H, s, H4), 7.23(1H, dd, J=8.6, 2.6 Hz, H7), 5.51(1H, d, J=5.5 Hz, H1′), 5.28(1H, d, J = 1.7 Hz, H1″), 2.15(3H, s, 2CH3), 1.93(3H, s, H2), 1.09(3H, d, J=6.1 Hz, 6″CH3);918E1883-B60E-43F4-8D83-EE260E7F3EC7
13CNMR(100 MHz, DMSOd6) δ: 163.7(C1), 120.6(C2), 160.0(C3), 105.3(C4), 135.4(C4a), 112.7(C5), 161.3(C6), 121.6(C7), 129.8(C8), 124.5(C8a), 186.4(C9), 110.7(C9a), 181.7(C10), 132.0(C10a), 97.3(C1′), 76.3(C2′), 77.1(C3′), 70.0(C4′), 74.0(C5′), 63.4(C6′), 100.2(C1″), 70.3(C2″), 70.5(C3″), 72.0(C4″), 68.6(C5″), 18.2(C6″), 170.4(C1), 20.4(C2), 8.8(2CH3)。以上数据与文献 (Bajpai et al., 2018)基本一致,故鉴定为2methyl1,3,6trihydroxy9,10anthraquinone3O(6′Oacetyl)αrhamnosyl(1→2)βglucoside。
化合物2黄色粉末。ESIMS m/z: 577[M-H]-, 分子式C27H30O14。1HNMR(400 MHz, DMSOd6) δ: 8.09(1H, d, J = 8.6 Hz, H8), 7.47(1H, d, J=2.5 Hz, H5), 7.40(1H, s, H4), 7.23(1H, dd, J=8.6, 2.6 Hz, H7), 5.45(1H, d, J=7.0 Hz, H1′), 5.38(1H, d, J = 1.7 Hz, H1″), 2.15(3H, s, 2CH3), 1.08(3H, d, J=6.2 Hz, 6″CH3);13CNMR(100 MHz, DMSOd6) δ: 163.5(C1), 120.6(C2), 160.2(C3), 105.0(C4), 135.3(C4a), 112.7(C5), 161.4(C6), 121.5(C7), 129.7(C8), 124.6(C8a), 186.4(C9), 110.5(C9a), 181.7(C10), 132.0(C10a), 97.4(C1′), 77.1(C2′), 77.4(C3′), 69.5(C4′), 76.2(C5′), 60.3(C6′), 100.2(C1″), 70.3(C2″), 70.5(C3″), 72.0(C4″), 68.5(C5″), 18.1(C2), 8.8(2CH3)。以上數据与文献 (Itokawa et al., 1989)基本一致,故鉴定为2methyl1,3,6trihydroxy9,10anthraquinone3Oαrhamnosyl(1→2)β glucoside。
化合物3黄色粉末。ESIMS m/z: 619[M-H]-, 分子式C29H32O15。1HNMR(400 MHz, DMSOd6) δ: 8.11(1H, d, J = 8.6 Hz, H8), 7.49(1H, d, J=2.5 Hz, H5), 7.46(1H, s, H4), 7.24(1H, dd, J=8.6, 2.5 Hz, H7), 5.69(1H, d, J=7.6 Hz, H1′), 4.79(1H, d, J = 1.7 Hz, H1″), 2.16(3H, s, 2CH3), 2.10(3H, s,
H2), 0.98(3H, d, J=6.4 Hz, 6″CH3);13CNMR(100 MHz, DMSOd6) δ: 163.7(C1), 120.8(C2), 160.0(C3), 105.2(C4), 135.4(C4a), 112.7(C5), 161.4(C6), 121.5(C7), 129.7(C8), 124.5(C8a), 186.4(C9), 110.7(C9a), 181.7(C10), 132.0(C10a), 97.3(C1′), 76.5(C2′), 77.1(C3′), 69.1(C4′), 76.5(C5′), 59.9(C6′), 101.2(C1″), 70.1(C2″), 70.5(C3″), 71.7(C4″), 67.1(C5″), 17.9(C6″), 169.8(C1), 21.1(C2), 8.7(2CH3)。以上数据与文献(Itokawa et al., 1989)基本一致,故鉴定为2methyl1,3,6trihydroxy9,10anthraquinone3O(3′Oacetyl)αrhamnosyl(1→2)βglucoside。
化合物4黄色粉末。ESIMS m/z: 431[M-H]-, 分子式C21H20O10。1HNMR(400 MHz, DMSOd6) δ: 8.07(1H, d, J = 8.6 Hz, H8), 7.42(1H, d, J=2.4 Hz, H5), 7.41(1H, s, H4), 7.17(1H, dd, J=8.6, 2.6 Hz, H7), 5.10(1H, d, J=7.3 Hz, H1′), 2.16(3H, s, 2CH3);13CNMR(100 MHz, DMSOd6) δ: 164.7(C1), 120.7(C2), 160.6(C3), 105.5(C4), 135.4(C4a), 113.1(C5), 161.3(C6), 121.8(C7), 129.7(C8), 123.8(C8a), 186.2(C9), 110.7(C9a), 181.9(C10), 132.1(C10a), 100.3(C1′), 73.2(C2′), 76.3(C3′), 69.3(C4′), 77.3(C5′), 60.4(C6′), 8.5(2CH3)。以上数据与文献(Itokawa et al., 1989)基本一致,故鉴定为2methyl 1,3,6trihydroxy9,10anthraquinone3Oβglucoside。918E1883-B60E-43F4-8D83-EE260E7F3EC7
化合物5黄色粉末。ESIMS m/z: 489[M-H]-, 分子式C23H22O12。1HNMR(400 MHz, DMSOd6) δ: 8.10(1H, d, J = 8.8 Hz, H8), 7.47(1H, d, J=2.4 Hz, H5), 7.43(1H, s, H4), 7.23(1H, dd, J=8.8, 2.4 Hz, H7), 5.09(1H, d, J=7.6 Hz, H1′), 4.63(1H, m, 2CH2OH), 4.54(1H, m, 2CH2OH);13CNMR(100 MHz, DMSOd6) δ: 161.7(C1), 123.7(C2), 161.5(C3), 106.1(C4), 133.8(C4a), 112.6(C5), 163.6(C6), 121.6(C7), 129.8(C8), 124.5(C8a), 186.4(C9), 111.2(C9a), 181.6(C10), 135.3(C10a), 100.6(C1′), 73.2(C2′), 75.8(C3′), 70.0(C4′), 74.2(C5′), 63.5(C6′), 170.5(C1″), 20.5(C2″) , 50.9(2CH2OH)。以上数据与文献(Fan et al., 2011)基本一致,故鉴定为1,3,6trihydroxy2hydroxymethyl9,10anthraquinone3O(6′Oacetyl)βDglucopyranoside。
化合物6黄色粉末。ESIMS m/z: 475[M+H]+, 分子式C23H22O11。1HNMR(400 MHz, DMSOd6) δ: 8.10(1H, d, J = 8.6 Hz, H8), 7.47(1H, d, J=2.6 Hz, H5), 7.43(1H, s, H4), 7.23(1H, dd, J=8.6, 2.6 Hz, H7), 5.11(1H, d, J=7.6 Hz, H1′), 2.17(3H, s, 2CH3), 2.04(3H, s, H2″);13CNMR(100 MHz, DMSOd6) δ: 163.7(C1), 120.9(C2), 160.6(C3), 105.8(C4), 135.4(C4a), 112.6(C5), 161.3(C6), 121.5(C7), 129.7(C8), 124.5(C8a), 186.5(C9), 110.7(C9a), 181.7(C10), 132.0(C10a), 100.2(C1′), 73.2(C2′), 76.0(C3′), 69.9(C4′), 74.2(C5′), 63.5(C6′), 170.5(C1"), 20.5(C2″), 8.5(2CH3)。以上數据与文献(乔亚芳等,1990)基本一致,故鉴定为2methyl1,3,6trihydroxy9,10anthraquinone3O(6′Oacetyl) βDglucopyranoside。
化合物7黄色粉末。ESIMS m/z: 445[M-H]-, 分子式C22H22O10。1HNMR(400 MHz, DMSOd6) δ: 7.48(1H, d, J = 1.7 Hz, H4), 7.35(1H, d, J=2.5 Hz, H5), 7.17(2H, d, J = 2.5 Hz, H2, 7), 5.17(1H, d, J=6.4 Hz, H1′), 3.94(3H, s, 3OCH3), 2.41(3H, s, 6CH3);13CNMR(100 MHz, DMSOd6) δ: 161.7(C1), 124.3(C2), 147.2(C3), 119.4(C4), 136.4(C4a), 107.3(C5), 164.7(C6), 106.5(C7), 160.7(C8), 114.5(C8a), 186.5(C9), 114.4(C9a), 181.9(C10), 132.1(C10a), 100.6(C1′), 73.2(C2′), 76.6(C3′), 69.8(C4′), 77.5(C5′), 60.8(C6′), 56.1(3OCH3), 21.4(6CH3)。以上数据与文献 (高淑红等,2013) 基本一致,故鉴定为大黄素甲醚8OβD葡萄糖苷。
化合物8黄色粉末。ESIMS m/z: 431[M-H]-, 分子式C21H20O10。1HNMR(400 MHz, DMSOd6 ) δ: 7.45(1H, s, H4), 7.27(1H, d, J=2.0 Hz, H5), 7.15(1H, s, H2), 6.98(1H, d, J=2.4 Hz, H7), 5.12(1H, d, J=5.0 Hz, H1′), 2.39(3H, s, 3CH3);13CNMR(100 MHz, DMSOd6) δ: 161.1(C1), 124.2(C2), 146.9(C3), 119.3(C4), 132.1(C4a), 108.3(C5), 164.2(C6), 108.3(C7), 161.7(C8), 114.5(C8a), 186.4(C9), 113.3(C9a), 182.1(C10), 136.5(C10a), 100.7(C1′), 73.3(C2′), 77.3(C3′), 69.4(C4′), 76.4(C5′), 60.6(C6′), 21.4(3CH3)。以上数据与文献 (高亮亮等,2011)基本一致,故鉴定为大黄素8OβD葡萄糖苷。
化合物9黄色粉末。ESIMS m/z: 577[M-H]-, 分子式C27H30O14。1HNMR(400 MHz, DMSOd6) δ: 8.25(1H, m, H8), 8.20(1H, m, H5), 8.04(1H, d, J=8.0 Hz, H3), 7.95(2H, m, H6, 7), 7.74(1H, d, J=8.0 Hz, H4), 4.94(1H, d, J = 14.8 Hz, H11a), 4.77(1H, d, J = 18.0 Hz, H11b), 4.35(1H, d, J = 7.6 Hz, H1″), 4.29(1H, d, J = 8.0 Hz, H1′);13CNMR(100 MHz, DMSOd6) δ: 158.8(C1), 134.0(C2), 133.2(C3), 118.7(C4), 134.7(C4a), 126.9(C5), 135.2(C6),135.3(C7), 126.7(C8), 131.9(C8a), 188.6(C9), 115.3(C9a), 181.9(C10), 132.8(C10a), 64.2(C11), 102.6(C1′), 73.5(C2′), 76.8(C3′), 70.0(C4′), 76.1(C5′), 68.3(C6′), 103.3(C1″), 73.6(C2″), 76.9(C3″), 70.1(C4″), 76.6(C5″), 61.1(C6″)。以上数据与文献 (Yang et al.,2014)基本一致,故鉴定为digiferruginol11Oβgentiobioside。918E1883-B60E-43F4-8D83-EE260E7F3EC7
化合物10黄色粉末。分子式C28H30O15。1HNMR(400 MHz, DMSOd6) δ: 8.09(1H, d, J = 8.4 Hz, H8), 7.47(1H, d, J=2.0 Hz, H5), 7.40(1H, s, H4), 7.23(1H, dd, J=8.0, 2.0 Hz, H7), 5.33(1H, d, J=7.2 Hz, H1″), 4.49(1H, d, J = 7.2 Hz, H1′), 2.15(3H, s, -OAc), 2.03(3H, s, 2CH3);13CNMR(100 MHz, DMSOd6) δ: 163.5(C1), 120.7(C2), 160.3(C3), 105.6(C4), 135.4(C4a), 112.6(C5), 161.3(C6), 121.6(C7), 129.7(C8), 124.1(C8a), 186.3(C9), 110.7(C9a), 181.7(C10), 132.0(C10a), 97.8(C1′), 82.1(C2′), 75.5(C3′), 69.6(C4′), 74.6(C5′), 63.4(C6′), 105.4(C1″), 74.0(C2″), 76.2(C3″), 69.5(C4″), 66.0(C5″), 170.5(C1), 20.4(C2), 8.0(2CH3)。以上數据与文献(王素贤等,1991)基本一致,故鉴定为2methyl1,3,6trihydroxy9,10anthraquinone3O(6′Oacetyl)βDxylopyranosyl(1→2)βDglucopyranoside。
化合物11黄色晶体。ESIMS m/s: 271[M+H]+, 分子式C15H10O5。1HNMR(400 MHz, DMSOd6) δ: 7.95(1H, d, J=8.4 Hz, H8), 7.35(1H, dd, J=8.8, 2.4 Hz, H7), 7.13(1H, d, J=2.8 Hz, H5), 7.11(1H, s, H4), 2.49(3H, s, 2CH3);13CNMR(100 MHz, DMSOd6) δ: 162.2(C1), 117.4(C2), 163.2(C3), 107.2(C4), 135.1(C4a), 112.5(C5), 162.3(C6), 121.2(C7), 129.3(C8), 124.6(C8a), 185.6(C9), 108.4(C9a), 181.9(C10), 131.7(C10a), 8.1(2CH3)。以上数据与文献 (康文艺等,2006)基本一致,故鉴定为6hydroxyrubiadin。
化合物12黄色粉末。ESIMS m/z: 241[M+H]+, 239[M-H]-, 分子式C14H8O4。1HNMR(400 MHz, DMSOd6) δ: 8.31(1H, m, H8), 8.25(1H, m, H7), 7.85(2H, m, H6,7), 7.75(1H, d, J=8.0 Hz, H4), 7.18(1H, d, J=8.0 Hz, H3);13CNMR(100 MHz, DMSOd6) δ: 150.7(C1), 152.7(C2), 120.8(C3), 121.2(C4), 123.8(C4a), 126.7(C5), 135.2(C6), 134.1(C7), 126.8(C8), 132.9(C8a), 188.8(C9), 116.3(C9a), 180.6(C10), 133.6(C10a)。以上数据与文献 (Itokawa et al., 1983)基本一致,故鉴定为1,2二羟基蒽醌。
化合物13黄色粉末。分子式C15H10O4。1HNMR(400 MHz, CDCl3) δ: 12.1(1H, s, -OH), 12.0(1H, s, OH), 7.81(1H, dd, J=8.0, 0.8 Hz, H5), 7.66(1H, d, J=8.0 Hz, H6), 7.63(1H, d, J=2.4 Hz, H4), 7.27(1H, dd, J=8.0, 0.8 Hz, H7), 7.08(1H, d, J=0.8 Hz, H2), 2.45(3H, s, CH3);13CNMR(100 MHz, CDCl3) δ: 162.4(C1), 124.6(C2), 149.4(C3), 121.3(C4), 133.2(C4a), 119.9(C5), 136.9(C6), 124.3(C7), 162.7(C8), 115.8(C8a), 192.5(C9), 113.7(C9a), 182.1(C10), 133.6(C10a), 22.3(3CH3)。以上数据与文献(李会等,2019)基本一致,故鉴定为大黄酚。
化合物14淡黄色无定形粉末。ESIMS m/z: 257[M+H]+, 分子式C14H8O5。1HNMR(400 MHz, CD3OD) δ: 8.12(1H, d, J=8.8 Hz, H8), 7.50(1H, d, J=2.8 Hz, H5), 7.16(1H, dd, J=8.8, 2.4 Hz, H7), 7.15(1H, overlap d, J=2.4 Hz, H4), 6.53( 1H, d, J=2.0 Hz, H2);13CNMR(100 MHz, CD3OD) δ: 166.5(C1), 109.3(C2), 166.4(C3), 108.9(C4), 137.0(C4a), 113.8(C5), 164.7(C6), 122.2(C7), 136.8 130.5(C8), 126.8(C8a), 187.2(C9), 110.7(C9a), 183.9(C10),(C10a)。以上数据与文献(ElGamal et al., 1995)分析比较,故鉴定为6hydroxyxanthopurpurin。918E1883-B60E-43F4-8D83-EE260E7F3EC7
化合物15黄色粉末。ESIMS m/z: 239[M-H]-, 分子式C14H8O4。1HNMR(400 MHz, DMSOd6) δ: 8.15(2H, dd, J = 6.8, 2.8 Hz, H5, H8), 7.88(2H, m, H6, 7), 7.10(1H, d, J =2.4, H4), 6.57(1H, d, J=2.4 Hz, H2);13CNMR(100 MHz, DMSOd6) δ: 164.8(C1), 107.7(C2), 165.5(C3), 108.4(C4), 135.0(C4a), 126.9(C5), 134.7(C6), 134.5(C7), 126.4(C8), 132.9(C8a), 185.9(C9), 109.4(C9a), 181.9(C10), 132.8(C10a)。以上數据与文献(桂利利等,2017)基本一致,故鉴定为1,3二羟基蒽醌。
4讨论与结论
钩毛茜草以根及根茎入药,具有凉血止血、止咳祛痰之功效,但目前对钩毛茜草物质基础的研究报道较少。茜草属植物中富含蒽醌类化合物,其中多羟基蒽醌类成分的抗氧化作用对治疗癌症及其他病症有较好疗效,具有一定的临床应用价值(刘路等,2015),根据亲缘同属关系,推测钩毛茜草也可能含有大量蒽醌类成分。汪哲等(2018)对钩毛茜草的甲醇提取物进行化学成分研究,分离出的蒽醌类成分主要来源于较小极性组分,且均为蒽醌苷元。因此,为了从钩毛茜草中发现更多的蒽醌类化合物,以期寻找活性成分,扩大钩毛茜草的药用价值,本研究通过多种分离纯化技术研究钩毛茜草的化学成分,分离得到15个蒽醌类化合物,包括蒽醌苷和蒽醌苷元,其中3个化合物首次从茜草属植物中分离得到,10个化合物首次从该植物分离得到。对所得化合物进行文献调研发现,部分化合物具有抗肿瘤、调节血脂及抗炎等作用。化合物8能显著降低3羟基3甲基戊二酰辅酶A还原酶活性起降血脂作用,并具有抗肿瘤作用(李登科等,2015);化合物11可抑制脂多糖引起的炎症,提示该化合物可能是治疗炎症的一种潜在候选药物(Wu et al., 2017);化合物13具有抗癌、神经保护及调节血脂等药理作用(Xie et al., 2019)。本研究分离得到的化合物1、2、7的量较大,可能是影响不同产地及批次药材质量的标志性成分;且课题组前期通过对钩毛茜草进行指纹图谱研究,并指认出2methyl1,3,6trihydroxy9,10anthraquinone3O(6′Oacetyl)αrhamnosyl(1→2)βglucoside(1)、2methyl1,3,6trihydroxy9,10anthraquinone3Oαrhamnosyl(1→2)βglucoside(2)两个成分,后期考虑对其进行含量测定研究,从多角度较为全面地评价了钩毛茜草质量。
综上,本研究结果与茜草属植物富含蒽醌类化合物的报道相吻合,丰富了钩毛茜草的蒽醌类成分,可为钩毛茜草今后的开发利用提供一定的科学依据。
参考文献:
BAJPAI VK, ALAM MB, QUAN KT, et al., 2018. Cytotoxic properties of the anthraquinone derivatives isolated from the roots of Rubia philippinensis[J] . BMC Compl Alterna Med, 18(1): 1-6.
CHEN Y, WANG HL, XUE L, et al., 2017. Research progress on Rubiae Radix et Rhizoma[J]. Chin Trad Herb Drugs, 48(13): 2771-2779.[陈毅,王海丽,薛露,等,2017. 茜草的研究进展[J] . 中草药,48(13): 2771-2779.]
ELGAMALAA, TAKEYA K, ITOKAWA H, et al., 1995. Anthraquinones from Gallium sinaicum[J] . Phytochemistry, 40(1): 245-251.
FAN JT, KUANG B, ZENG GZ, et al., 2011. Biologically active arborinanetype triterpenoids and anthraquinones from Rubia yunnanensis[J] . Nat Prod, 74(10): 2069-2080.
Guizhou Drug Administration,2003. Quality standards of traditional Chinese medicine and ethnic medicine in Guizhou Province[S]. Guiyang: Guizhou Science and Technology Press: 56.[贵州省药品监督管理局,2003. 贵州省中药材、 民族药材质量标准[S] . 贵阳: 贵州科技出版社: 56.]
GAO SH, SU ZZ, WU SJ, et al., 2013. Study on chemical constituents of Redix Polygonimultiflori Preparata [J]. Lishizhen Med Mat Med Res, 24(3): 543-545.[高淑红,苏珍枝,吴士杰,等,2013. 制首乌化学成分的研究[J] . 时珍国医国药,24(3): 543-545.]
GAO LL, XU XD, NAN HJ, et al., 2011. Chemical constituents in Rheum tanguticum[J]. Chin Trad Herb Drugs, 42(3): 443-446.[高亮亮,许旭东,南海江,等,2011. 唐古特大黄化学成分研究[J] . 中草药,42(3): 443-446.]918E1883-B60E-43F4-8D83-EE260E7F3EC7
GUI LL, CHEN L, DONG JX, et al., 2017. Chemical constituents from the heartwood of Trachycarpus fortunei ( Hook.) H.Wendl.[J]. Mil Med, 41(1): 62-64. [桂利利,陈立,董俊兴,2017. 棕树心化学成分研究[J] . 军事医学,41(1): 62-64.]
HE YL, WANG Y, MA X, et al., 2019. Study on the establishment of HPLC fingerprints and chemical pattern recognition of Rubia oncotricha from Guizhou[J]. Chin Med Mat, 42(11): 2593-2597.[何燕玲,汪洋,马雪,等,2019. 黔产钩毛茜草HPLC指纹图谱建立及化学模式识别研究[J] .中药材,42(11): 2593-2597.
ITOKAWA H, MIHARA K, TAKEYA K, 1983. Studies on a novel anthraquinone and its glycosides isolated from Rubia cordifolia and R. akane[J] . Chem Pharm Bull, 31(7): 2353-2358.
ITOKAWA H, QIAO YF, TAKEYA K, 1989. Anthraquinones and naphthohydroquinones from Rubia cordifolia[J] . Phytochemistry, 28(12): 3465-3468.
KANG WY, ZANG XY, LI L, et al., 2006. Antioxidants from Rubia cordifolia[J]. J Henan Univ, 25(3): 6-8.[康文艺,臧鑫炎,李黎,等,2006. 茜草抗氧化成分研究[J] . 河南大学学报,25(3): 6-8.]
LUO XR, 1999. Flora Republicae Popularis Sinicae [M]. Beijing: Science Press, 71(2): 309.[罗献瑞,1999. 中国植物志[M] . 北京: 科技出版社,71(2): 309.]
LIU L, WANG JJ, CUI XJ, et al., 2015. Advance on chemical components of Rubia genus[J]. Chin J Exper Trad Med Form, 21(17): 225-229. [劉路,王佳佳,崔雪靖,等,2015. 茜草属植物化学成分研究进展[J]. 中国实验方剂学杂志,21(17): 225-229.]
LI H, WANG Q, YI CD, et al., 2019. Study on chemical composition of Hodgsonia macrocarpa[J]. J Yunnan Univ Natl, 28(3): 219-221.[李会,王蔷,易春蝶,等,2019. 油瓜的化学成分[J] . 云南民族大学学报,28(3): 219-221.]
LI DK, MA QW, SUN ZX, 2015. Advances in studies on pharmacological effects of emodin8OβDglucopyranoside[J]. Chin J Pharm Tox, 29(3): 493-497.[李登科,马清温,孙震晓,2015. 大黄素8OβD葡萄糖苷药理作用研究进展[J]. 中国药理学与毒理学杂志,29(3): 493-497.]
QIAO YF, WANG SX, WU LJ, et al., 1990. Study on antibacterial active components in Rubia cordifolia[J]. Acta Pharm Sin, (11): 834-839.[乔亚芳,王素贤,吴立军,等,1990. 茜草中抗菌活性成分的研究[J] . 药学学报, (11): 834-839.]
WANG Z, ZHAO SM, ZENG GZ, et al., 2018. Chemical constituents from roots and rhizomes of Rubia oncotricha and their cytotoxic activities[J]. Chin J Chin Mat Med, 43(22): 4462-4468.[汪哲,赵思蒙,曾广智,等,2018. 钩毛茜草的化学成分及其细胞毒活性研究[J] . 中国中药杂志,43(22): 4462-4468.]
WANG MM, GU PZ, WANG XM, et al., 2019. Advances in research on anthraquinone natural compounds and tumor therapy[J]. Anhui Chem Ind, 45(2): 4-9.[王明明,顾浦中,王晓曼,等,2019. 蒽醌类天然化合物及肿瘤治疗研究进展[J] . 安徽化工,45(2): 4-9.]
WANG SX, HUA HM, WU LJ, et al., 1991. Structural identification of new anthraquinone glycosides in Rubia cordifolia[J]. J Shenyang Coll Pharm,(3): 211.[王素贤,华会明,吴立军,等, 1991. 茜草中新蒽醌甙的结构鉴定[J] . 沈阳药学院学报, (3): 211.]918E1883-B60E-43F4-8D83-EE260E7F3EC7
WANG XJ, HUANG SY, 2012. Advances in studies on chemical constituents and pharmacological effects of Rubia genus[J]. Chin J Inform TCM, 19(2): 109-112.[王晓建,黄胜阳,2012. 茜草属植物化学成分及其药理作用研究进展[J]. 中国中医药信息杂志,19(2): 109-112.]
WU YT, JIN FJ, WANG YL, et al., 2017. In vitro and in vivo inhibitory effects of 6hydroxyrubiadin on lipopolysaccharideinduced inflammation[J]. J Immunopharmacol, 39(3): 107-116.
XIE L, TANG HL, SONG JW, et al., 2019. Chrysophanol: A review of its pharmacology, toxicity and pharmacokinetics[J]. J Pharm Pharmacol, 7110(10): 1-13.
YANG XL, ZHANG P, WU JZ, 2014. Chemical constituents from the root of Damnacanthus officinarum Huang[J]. Biochem Syst Ecol, 52: 49-52.
(責任编辑李莉)
收稿日期:2021-01-11
基金项目:国家自然科学基金(U1812403);贵州省大学生创新训练项目(2018520363);中央引导地方科技专项项目(黔科中引地 [2018]4006);贵州省科学技术厅人才团队项目(黔科合平台人才 [2016]5677)
第一作者: 李银(1997-),硕士研究生,主要从事药效物质基础与质量控制技术研究,
(Email)2681282643@qq.com。
通信作者:李勇军,教授,主要从事中药制剂工艺、质量标准及药效物质基础研究,(Email)liyongjun026@126.com。918E1883-B60E-43F4-8D83-EE260E7F3EC7
