过表达大豆类受体蛋白激酶基因RLPK2促进转基因拟南芥叶片的衰老
2022-06-18张强黄卓然胡康龙许超杨青青薛涛
张强 黄卓然 胡康龙 许超 杨青青 薛涛

摘要:大豆RLPK2基因(GenBank登錄号:AY687391)是一个编码N末端富含亮氨酸重复序列的类受体蛋白激酶基因。为分析大豆RLPK2基因的功能,该研究以野生型拟南芥和大豆RLPK2基因过表达拟南芥植株为材料,通过农杆菌介导法转化野生型拟南芥,构建了大豆RLPK2基因过表达载体,分析了叶片衰老过程中叶绿素荧光参数、抗氧化酶活性及衰老相关基因表达量的变化。结果表明:(1)无论是野生型还是转基因拟南芥,随着叶片衰老进程的进行,光系统Ⅱ(PSⅡ)的最大光化学效率(Fv/Fm)、PSⅡ实际光化学效率(ΦPSⅡ)、光化学淬灭系数(qP)和光合电子传递速率(ETR)均呈下降趋势,但后者下降趋势更明显;(2)激发压(1qP)在叶片衰老前期的变化较为平稳,后期则急剧增加,且转基因型比野生型拟南芥增加更明显;(3)在叶片衰老的各个时期,转基因拟南芥叶片丙二醛(MDA)含量均显著高于野生型,而超氧化物岐化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性均显著低于野生型;(4)实时荧光定量PCR检测结果表明,RLPK2转基因拟南芥中衰老标志基因ATSAG12,衰老关键转录因子ATNAP、ATWRKY6和叶绿素降解关键酶编码基因ATACD1表达量显著上调。综上认为,大豆类受体蛋白激酶基因RLPK2参与调控植物叶片衰老进程,其表达对叶片衰老具有促进作用。
关键词:大豆RLPK2基因,叶片衰老,激发压,抗氧化酶,丙二醛
中图分类号:Q943;S565.1
文献标识码:A
文章编号:10003142(2022)05072909
Overexpressionnofsoybeanreceptorlikeproteinkinase
RLPK2genefromGlycinemaxpromotestransgenic
Arabidopsisthalianaleafsenescence
ZHANGQiang,HUANGZhuoran,HUKanglong,XUChao,YANGQingqing,XUETao*
Abstract:SoybeanRLPK2gene(GenBankaccessionNo.AY687391)isareceptorlikeproteinkinasegenethatencodesaleucinerichrepeat(LRR)receptorkinasetypeproteinencodedwithaNterminal.InordertofurtheranalyzethefunctionofthesoybeanRLPK2gene,theoverexpressionvectoroftheRLPK2genewasconstructedviaagrobacteriummediatedtransformationofArabidopsisthaliana.Inthisstudy,wildtype(WT)andtransgenicA.thalianaplantswereusedasmaterials,andthevariationsinchlorophyllfluorescenceparametersandtheactivitiesofantioxidantenzymesaswellastheexpressionlevelsofsenescenceassociatedgenesintheagingprocessofleaveswereinvestigated.Theresultswereasfollows:(1)BothWTandtransgenicplantstendedtodecreasetheefficiencyofprimaryconversionoflightenergyofphotosystemⅡ(PSⅡ)(Fv/Fm),actualphotochemicalefficiencyofPSⅡ(ΦPSⅡ),photochemicalquenchingcoefficient(qP)andelectrontransportrate(ETR)whilethelattershowedamoreobviousdecreasingpatternasagingprogressed.(2)ThePSⅡexcitationpressure(estimatedas1qP)wasrelativelystableintheearlystageofleafsenescence,andincreasedsharplyinthelaterstageofleafsenescence,whilethetransgenicplantsshowedamoreobviousincreasingtrend.(3)Atdifferentleafsenescencestages,themalondialdehyde(MDA)contentwassignificantlyhigherintransgenicplantsthanthatinWT,whiletheactivitiesofsuperoxidedismutase(SOD),peroxidase(POD)andcatalase(CAT)weresignificantlylowerintransgenicplantsthanthoseinWT.(4)Additionally,therealtimequantitativeRTPCRshowedthattheexpressionlevelsofagingmarkergeneATSAG12,criticalsenescenceassociatedtranscriptionfactorsATNAP,ATWRKY6andchlorophylldegradationkeyenzymeencodinggeneATACD1increasedintransgenicplants.Insummary,transgenicA.thalianaexhibitedfasterleafsenescencecomparedwithWT,andtheexpressionofthesoybeanreceptorlikeproteinkinaseRLPK2geneplayedanimportantroleinpromotingleafsenescence.032BA245-D028-4DA2-A536-F4FF14202739
Keywords:soybeanRLPK2gene,leafsenescence,excitationpressure,antioxidantenzyme,malondialdehyde(MDA)
作为进行光合作用的主要器官,叶片的生长发育优劣直接影响作物的生长、产量及品质。叶片衰老是叶片生长发育进程中的最终阶段,它不是叶片细胞的简单死亡过程,而是一种主动的、受细胞内部遗传程序控制的、器官水平上动态的细胞程序性死亡过程,并且受到外部多种环境因素(光照、水分、温度、矿质元素和微生物)及内部发育信号(激素、遗传和基因调控)的协调控制(初梦圆和于延冲,2019)。此外,叶片衰老还与Ca2+、糖、活性氧(relativeoxygenspecies,ROS)水平和内源激素的变化等因素密切相关(张艺函等,2019)。叶片衰老主要表现为光合同化能力下降,细胞结构的退化,光合色素包括叶绿素和类胡萝卜素的降解,蛋白质和核酸降解,ROS与丙二醛(malondialdehyde,MDA)含量增加,水解酶及生长抑制因子持续增长等,这些特征在多种植物中已有描述(Wooetal.,2013;Wangetal.,2016)。葉片衰老能够增强植物对生存环境的适应性,从而有利于其生存和延续。但对农作物的生长而言,植物过早衰老引起的叶片同化功能的减退也极大地影响和限制了农作物产量潜力的发挥,导致作物品质及产量的损失。因此,对叶片衰老机理的研究不仅在揭示植物的生态适应等方面具有一定意义,还在粮食生产上抑制早衰具有重要意义。大豆在我国播种面积仅次于玉米、水稻、小麦和马铃薯,是第五大粮食作物,其含有丰富的植物蛋白质,同时又可用来榨油,因此是我国重要的油料作物。相关研究表明,叶片早衰严重影响着大豆正常的生长发育,并会引起产量及品质的下降(吕林涛,2018)。鉴定大豆叶片衰老相关基因及其功能对于提高大豆的优质高产和育种改良具有重要的科学意义和深远的应用价值。
植物类受体蛋白激酶(receptorlikeproteinkinase,RLKs)具有特殊的蛋白质结构,在植物中普遍存在,占植物蛋白激酶总量的60%,是植物中较大的基因家族之一,参与细胞信号转导途径过程,并在植物的生长发育和环境的适应过程中具有重要作用(Shiu&Bleecker,2001)。其中,富含亮氨酸重复序列(leucinerichrepeat,LRRs)型类受体蛋白激酶是RLKs中最大的一个亚家族(Coletteetal.,2011)。迄今为止,LRRsRLKs蛋白的结构特点和表达模式在拟南芥(阿依江·哈拜克等,2014)、烟草(曾建斌,2011)、花生(庄瑞蓉等,2018)、马铃薯(谢洁等,2019)等植物中均有研究。相关研究表明,LRRRLKs在植物整个生长发育过程中具有重要作用(Diévart&Clark,2004)。谢洁等(2019)发现马铃薯LRR类受体蛋白激酶SCLRRK1在低温条件下表达受到抑制,证实其参与低温胁迫响应过程。Zhou等(2016)发现LRRRLKs型基因调节拟南芥花药的发育过程。作为LRRRLKs家族中被研究较为广泛的一员,BAK1在油菜素内酯(BR)信号转导途径(Heetal.,2007)、植物先天免疫反应(韦莉等,2019)、细胞死亡调控(Zhouetal.,2019)等方面发挥作用。大豆RLPK2基因(GenBank登录号:AY687391)是植物分子遗传学研究组李小平副教授前期以大豆科丰34为材料筛选到的一个编码N末端富含亮氨酸重复序列的类受体蛋白激酶基因,前期研究结果发现人工诱导衰老处理显著提高了该基因在大豆初生叶片中的转录水平,初步分析显示该基因可能参与大豆叶片衰老的调控过程。本研究在此基础上构建了大豆RLPK2基因过表达载体并转化野生型拟南芥,对转基因拟南芥叶片衰老进程进行分析,进一步揭示该基因在植物叶片衰老中的功能,以期为延缓叶片衰老从而提高大豆作物产量和改善作物品质提供理论依据。
1材料与方法
1.1材料及培养方法
本试验所使用的拟南芥(Arabidopsisthaliana)为哥伦比亚野生型(WT)拟南芥(Columbia0)。培养环境条件如下:温度为20~25℃,光暗周期为16h光照/8h黑暗,光照强度为100SymbolmA@
mol·m2·s1,相对湿度为80%。
1.2总RNA的提取和反转录
采用QIAGEN的植物RNA提取试剂盒RNeasyPlantMiniKit按照操作说明提取大豆品种科丰34叶片总RNA,经微量紫外分光光度计(Merinton,美国)检测其纯度和浓度,琼脂糖凝胶电泳检测其完整性后,利用Thermo公司提供的cDNA试剂盒按照反转录说明书合成cDNA第一条链。
1.3RLPK2全长cDNA引物设计及RTPCR基因扩增
利用PrimerPremier5.0软件设计RLPK2基因的特异性引物,根据Gateway技术构建表达载体的要求,在引物5′端加上AAAAAGCAGGCTCG,引物序列如下:
RLPK2OXF:5′AAAAAGCAGGCTCGATGAGA
TCAGTAAGTTCCCCTG3′;
RLPK2OXR:5′AGAAAGCTGGGTTTTAATCT
CTCTTCTCCAAGTAAGAAG3′。
采用高保真PhusionDNA聚合酶进行PCR扩增。反应程序:94℃预变性30s,35个循环(94℃30s,62℃30s,72℃30s),循环结束后72℃10min延伸反应,4℃保温。1%的琼脂糖凝胶电泳检测PCR产物,回收特异性目标条带,送样测序,选取测序正确的克隆进行后期载体的构建。
1.4RLPK2过表达载体构建、拟南芥遗传转化及纯合体筛选032BA245-D028-4DA2-A536-F4FF14202739
通过农杆菌介导法将重组植物过表达载体pB2GW7转入野生型拟南芥,并将收取的种子种在含有20mg·L1的Basta的1/2MS培养基上筛选阳性植株,提取T3代转基因植株总RNA,反转录成cDNA,利用特异性引物对转基因植株进行RTqPCR鉴定,选取其进行后续表型实验。
1.5叶绿素荧光参数测定
使用便携式叶绿素荧光测定仪(PAM2500,德国)测定100SymbolmA@
mol·m2·s1光强下植株叶片的稳态荧光Fs、最大荧光Fm′和最小荧光Fo′后,将叶片暗适应30min后,测定初始荧光Fo和暗下最大荧光Fm。根据测定的荧光参数计算得出光系统Ⅱ(PSⅡ)最大光化学效率Fv/Fm=(Fm-Fo)/Fm,实际光化学量子效率ΦPSⅡ=(Fm′-Fs)/Fm′,光化学淬灭系数qP=(Fm′-Fs)/(Fm′-Fo′),光合电子传递速率ETR=ΦPSⅡ×PPFD×A×0.5,式中:PPFD是光辐射通量;A是叶片吸收光能系数。
1.6MDA含量和抗氧化酶活性测定
取样叶0.1g在液氮中充分研磨后立即转入含有1mL50mmol·L1磷酸缓冲溶液(pH7.8,含1mmol·L1EDTA和1%PVP)的离心管中,在4℃下15000g离心15min,取上清液弃沉淀,再15000g离心5min,回收上清液用于MDA含量和抗氧化酶活性的测定。抗氧化酶活性的测定参照文献(陈斌等,2015)。超氧化物歧化酶(SOD)活性检测采用氮蓝四唑(NBT)光化还原法;过氧化物酶(POD)活性检测采用愈创木酚法;过氧化氢酶(CAT)活性检测活性采用H2O2分解法测定。MDA含量的测定参考中国科学院上海植物生理研究所(1999)的方法。
1.7转RLPK2基因拟南芥中衰老相关基因表达
RNA提取步骤同上,其反转录及定量PCR体系的配制均依据QuantRTPCRkit(SYBRGreen)的说明书操作,具体数据分析参照Xue等(2017)步骤进行。
1.8数据分析
所得试验数据采用MicrosoftExcel2019软件和IBMSPSS22.0软件进行处理,采用studentt检验方法检验不同处理之间的差异显著性(P<0.05,差异显著)。采用SigmaPlot14.5软件完成作图。
2结果与分析
2.1超表达RLPK2基因促进转基因拟南芥衰老
选取筛选得到的2个T3代纯系进行表型分析,首先通过RTPCR比较分析野生型及两个转基因系OX1和OX2中的RLPK2的基因表达量。结果显示野生型中未检测到该基因,而两个转基因株系中均有显著的扩增条带,表明两个转基因纯系确为RLPK2的超表达株系(图1)。比较生长4周时的野生型及转基因株系的拟南芥表型,可见两转基因株系拟南芥的抽苔和开花时间较野生型明显提前(图1),表明RLPK2促进拟南芥衰老进程。
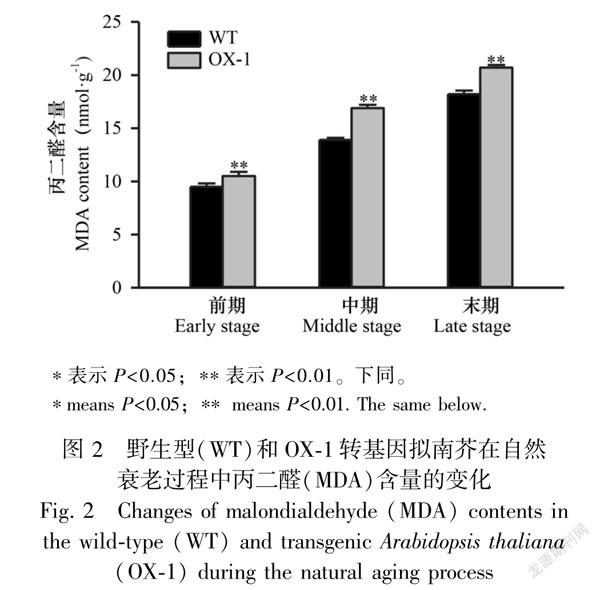
2.2MDA含量
在三个不同发育时期,转RLPK2基因拟南芥植株叶片的MDA含量显著高于WT拟南芥(图2)。MDA是自由基作用于细胞膜脂发生过氧化反应的最终产物之一,能在一定程度上反映氧化胁迫是否发生以及发生的程度。结果表明,超表达RLPK2基因可以引起拟南芥发生氧化胁迫。
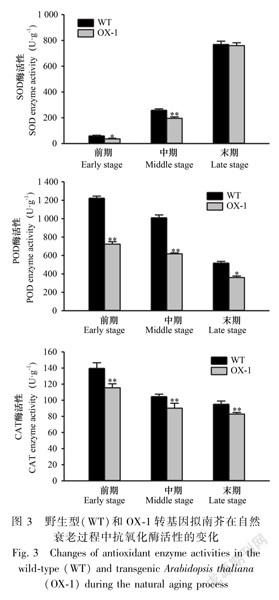
2.3抗氧化酶系
为深入分析RLPK2基因过表达对植株细胞抗氧化性状的影响,分别检测了三个不同发育时期WT和RLPK2转基因拟南芥植株叶片的SOD、POD和CAT酶活性,结果如图3所示。由图3可知,在同一生长发育时期转基因拟南芥植株叶片的SOD、POD和CAT酶活性显著低于WT。试验结果表明,超表达RLPK2基因使胞内ROS清除系统的功能降低,从而导致膜系统受到伤害,并进一步造成膜结构和功能的破坏。
2.4叶绿素荧光
如图4所示,无论是WT还是RLPK2转基因拟南芥植株在衰老的前期和中期叶片Fv/Fm几乎未变,然而在衰老末期,衰老导致了拟南芥叶片Fv/Fm明显降低,且转基因拟南芥下降的更加明显。在拟南芥叶片衰老過程中还有一个明显的PSⅡ激发压上升阶段,且转基因拟南芥比WT拟南芥上升更明显,表明前者比后者电子流受阻严重。此外,PSⅡ光合电子传递量子效率ΦPSⅡ、光化学淬灭系数qP和光合电子传递速率ETR在拟南芥叶片衰老过程中均呈降低趋势,且转基因拟南芥下降更明显,表明在生育后期衰老过程中,转基因型比野生型叶片的PSⅡ功能下降更快,并且具有较低的光能利用效率。
2.5超表达RLPK2基因对拟南芥衰老相关基因表达的影响
为进一步研究RLPK2基因异源过表达对转基因拟南芥中各衰老相关基因和衰老转录因子表达量的影响,本研究利用RTPCR检测衰老标志基因ATSAG12,衰老关键转录因子ATNAP、ATWRKY6和叶绿素降解关键基因ATACD1的表达变化情况。与WT拟南芥相比,RLPK2基因异源过表达显著促进了上述衰老相关基因的表达(图5)。
3讨论
除了作为信号分子介导植物对各种外界刺激的响应之外,ROS还在植物的正常生长发育与分化以及细胞程序性死亡(programmedcelldeath,PCD)等方面具有重要作用(Mittleretal.,2011;Perez&Brown.,2014;Wangetal.,2020)。O2-和H2O2是植物体内主要的活性氧自由基,作为强氧化剂攻击细胞膜中的不饱和脂肪酸或生物大分子物质导致其透性增加,而MDA是细胞膜脂过氧化的最终产物,其积累会对细胞造成一定的伤害,其含量的变化是细胞质膜损伤程度的重要标志之一,同时也是衡量植物器官衰老时或在逆境条件下细胞膜结构完整性的较好指标(Slamaetal.,2015;夏冬冬等,2018)。本研究发现,随着叶片衰老进程的进行,野生型和转基因拟南芥叶片MDA含量呈增加的趋势,表明两者细胞膜脂过氧化程度逐渐增加,细胞由完整变得破裂,造成细胞衰老和死亡。MDA含量增加可能与活性氧清除系统能力下降有关。在本研究中,尽管SOD酶活性在拟南芥叶片衰老过程中有所提高,但是由于POD酶和CAT酶活性降低,导致了其体内活性氧清除系统能力下降,从而引起ROS大量累积,导致MDA含量增加;在拟南芥衰老的各个时期,在转基因株系叶片中SOD、POD和CAT酶活性均显著低于野生型,因而导致转基因株系叶片MDA含量均相应地显著高于野生型。在植物叶片衰老过程中伴随着与光合作用光反应有关组分的降解(如叶绿素、类胡萝卜、叶黄素及Cytf等)(Hikosakaetal.,1996;Murchieetal.,1999),同时也伴随着与光合作用暗反应有关过程的衰退(如Rubisco活性下降、Rubisco降解及气孔导度下降等)(Onoetal.,2013;Majeranetal.,2019)以及光合速率的下降。相关研究发现,衰老引起叶绿体的结构、大小以及类囊体膜的完整性发生变化(Hashimotoetal.,1989),正是这种变化最终导致叶片衰老过程中PSI和PSⅡ的活性都下降。然而相对而言,PSⅡ对衰老更为敏感(Grover&Mohanty,1993)。PSⅡ的叶绿素荧光动力学参数可直观反映植物叶片光合作用过程中光系统对光能的吸收、转化、耗散及分配等。作为其中一个比较重要的叶绿素荧光参数,Fv/Fm是暗适应下PSⅡ反应中心完全开放时032BA245-D028-4DA2-A536-F4FF14202739
的最大光化学效率,代表了植物潜在的最大光合能力,正常生理状态下其数值通常介于0.80~0.85之间,并且基本上不受物种的影响。在植物体遭受到光抑制、逆境胁迫或者发生某些与光合相关的基因突变时,Fv/Fm会发生显著性变化(肖华贵等,2013)。前人在研究不同种类作物衰老进程时均发现,尽管作物叶片衰老过程中光合作用能力下降,但是衰老并未引起PSⅡFv/Fm明显下降(高海涛等,2010;武永胜等,2010)。因此,有学者根据这一数据认为植物叶片衰老过程中PSⅡ活性并未发生相应变化。本研究结果表明,在衰老的前期和中期,衰老确实未导致拟南芥叶片Fv/Fm明显下降;然而在衰老的末期,衰老导致了拟南芥叶片Fv/Fm明显降低,且转基因拟南芥下降得更加明显。PSⅡ激发压(1qP)是对PSⅡ的电子接受体QA的氧化还原状态的估计值,其反映了PSⅡ的氧化还原状况以及能量供应和利用之间的平衡,能量平衡是通过光合电子传递链组分的氧化还原状态所介导的(Huneretal.,1998)。前人研究发现PSⅡ激发压(1qP)可能分别介导了自然衰老和缺氮引起的早衰(Tangetal.,2015;Wangetal.,2015)。Misra等(2011)认为PSⅡ激发压可以用作监测衰老开始的传感器。Ou等(2003)研究发现超高产水稻剑叶衰老的过程中有一个明显的PSⅡ激发压上升的阶段,显示光合电子流传递受阻。本研究同样也发现在拟南芥叶片衰老过程中有一个明显的PSⅡ激发压上升的阶段,且转基因型比野生型拟南芥上升更加明显,表明转基因型比野生型拟南芥电子流受阻程度更严重。此外,本研究还发现在拟南芥叶片衰老过程中,PSⅡ光合电子传递量子效率ΦPSⅡ、光化学淬灭系数qP和光合电子传递速率ETR均降低,且转基因拟南芥下降更加明显,这一结果表明在生育后期衰老的过程中,转基因株系较野生型叶片的PSⅡ功能下降更快,并且具有较低的光能利用效率。
本研究通过实时定量RTPCR检测,结果发现RLPK2基因超表达导致叶绿素降解关键酶编码基因ACD1表达量增加,这暗示了超表达RLPK2基因导致转基因拟南芥叶绿素降解速率加快,光合作用能力下降。现有研究表明,拟南芥中衰老标志基因ATSAG12编码半胱氨酸蛋白酶仅在只依赖于叶龄发育信号而导致的衰老过程中表达,且表达量不受其他胁迫信号的影响(张艺函等,2019)。本研究结果发现,在衰老中期才能在野生型和转基因拟南芥株系中检测到该基因的表达,且超表达RLPK2基因显著促进其表达量,揭示RLPK2基因在叶片衰老过程中响应叶龄发育信号。在叶片衰老过程中,WRKY和NAC等转录因子家族成员中大部分成员表达量上调,参与调控叶片衰老过程,在叶片衰老过程中具有关键作用(Shahetal.,2014)。在本研究中,超表达RLPK2基因显著促进ATWRKY6和ATNAP表达量的提升,表明RLPK2基因可能通过调节这些叶片衰老的关键转录因子而参与到叶片衰老的调控。
4结论
大豆RLPK2受体蛋白激酶基因可参与植物叶片衰老调控过程,其过表达株系可通过调控衰老进程中抗氧化酶活性的变化,增加过氧化物的积累,导致PSⅡ功能衰退较快,以及调控衰老相关基因如衰老标志基因ATSAG12、衰老关键转录因子ATNAP、ATWRKY6和叶绿素降解关键酶编码基因ATACD1的表达,从而促进受体植株的早衰,但其调控衰老的机制尚有待于进一步研究。
參考文献:
ABROLYP,MOHANTYP,GOVINDJEEA,1993.Photosynthesis:photoreactionstoplantproductivity[M]//GROVERA,MOHANYP.Leafsenescenceinducedalterationsinstructureandfunctionofhigherplantchloroplasts.Dordrecht:KluwerAcademicPublishers:225-255.
AYIJIANGH,YANGM,HANYZ,2014.SubcellularlocalizationofRLK6,aproteinofLRRRLKsubfamilyandtissueexpressionpatternoftheRLK6inArabidopsis[J].ActaBotBorealOccidentSin,34(1):1-6.[阿依江·哈拜克,杨敏,韩玉珍,2014.拟南芥LRRRLKs亚家族蛋白RLK6的亚细胞定位及RLK6的组织表达[J].西北植物学报,34(1):1-6.]
CHENB,WANGYN,MADW,etal.,2015.TheantioxidantenzymeactivitiesandtheirgeneexpressioninmaizeradicleundertheallelochemicalstressfromChenopodiumambrosioidesL.[J].EcolEnvironSci,24(10):1640-1646.[陈斌,王亚男,马丹炜,等,2015.土荆芥化感胁迫对玉米幼根抗氧化酶活性和基因表达的影响[J].生态环境学报,24(10):1640-1646.]
ChineseAcademyofSciences,ShanghaiInstituteofPlantPhysiology,1999.Modernplantphysiologyexperimentinstruction[M].Beijing:SciencePress.[中国科学院上海植物生理研究所,1999.现代植物生理学实验指导[M].北京:科学出版社.]
CHUMY,YUYC,2019.Theresearchprogressoffactorsaffectingplantleafsenescence[J].ChinBullLifeSci,31(2):178-184.[初梦圆,于延冲,2019.影响植物叶片衰老因素的研究进展[J].生命科学,31(2):178-184.]032BA245-D028-4DA2-A536-F4FF14202739
COLETTEA,BOCHDANOVITSZ,JANSWEIJERVMA,etal.,2011.ProbingtherolesofLRRRLKgenesinArabidopsisthalianarootsusingacustomTDNAinsertionset[J].PlantMolBiol,76(1):69-83.
DIVARTA,CLARKSE,2004.LRRcontainingreceptorsregulatingplantdevelopmentanddefense[J].Development,131(2):251-261.
GAOHT,WANGYH,MENGZY,etal.,2010.Studyongrainyieldandphysiologicalcharacteristicsofflagleavesinsuperhighyieldwinterwheat[J].JTriticeaeCrops,30(6):1080-1084.[高海涛,王育红,孟战赢,等,2010.超高产小麦产量及旗叶生理特性的研究[J].麦类作物学报,30(6):1080-1084.]
HASHIMOTOH,KURAHOTTAM,KATOHS,1989.Changesinproteincontentandinthestructureandnumberofchloroplastsduringleafsenescenceinriceseeding[J].PlantCellPhysiol,30(5):707-715.
HEK,GOUXP,YUANT,etal.,2007.BAK1andBKK1regulatebrassinosteroiddependentgrowthandbrassinosteroidindependentcelldeathpathways[J].CurrBiol,17(13):1109-1115.
HUNERNPA,AQUISTG,SARHANF,1998.Energybalanceandacclimationtolightandcold[J].TrendsPlantSci,3(6):224-230.
HUNERNPA,MAXWELLDP,GRAYGR,etal.,1996.Sensingenvironmentaltemperaturechangethroughimbalancesbetweenenergysupplyandenergyconsumption:RedoxstateofphotosystemⅡ[J].PhysiolPlant,98(2):358-364.
LLT,2018.Causesandmeasuresofsummersoybeanprematuresenescence[J].ModAgricSciTechnol,(4):60.[呂林涛,2018.夏大豆早衰的原因及防治对策[J].现代农业科技,(4):60.]
MAJERANW,WOSTRIKOFFK,WOLLMANFA,etal.,2019.RoleofClpPinthebiogenesisanddegradationofrubiscoandATPsynthaseinChlamydomonasreinhardtii[J].Plants(Basel),8(7):191.
MISRAAN,LATOWSKID,STRZALKAK,2011.Photosyntheticexcitationpressurecausesviolaxanthindeepoxidationinagingcabbage(BrassicaoleraceaL.)leaves[J].JLifeSci,5:182-191.
MITTLERR,VANDERAUWERAS,SUZUKIN,etal.,2011.ROSsignaling:thenewwave?[J]TrendsPlantSci,16(6):300-309.
MURCHIEEH,CHENYZ,HUBBARTS,etal.,1999.Interactionsbetweensenescenceandleaforientationdetermineinsitupatternsofphotosynthesisandphotoinhibitioninfieldgrownrice[J].PlantPhysiol,119(2):553-564.
ONOY,WADAS,IZUMIM,etal.,2013.EvidenceforcontributionofautophagytorubiscodegradationduringleafsenescenceinArabidopsisthaliana[J].PlantCellEnviron,36(6):1147-59.
OUZY,PENGCL,LINGZ,etal.,2003.RelationshipbetweenPSⅡexcitationpressureandcontentofrubiscolargesubunitorsmallsubunitinflagleafofsuperhighyieldinghybridrice[J].ActaBotSin,45(8):929-935.
PEREZIB,BROWNPJ,2014.TheroleofROSsignalingincrosstolerance:frommodeltocrop[J].FrontPlantSci,5:754.
SHAHST,PANGC,HUSSAINA,etal.,2014.MolecularcloningandfunctionalanalysisofNACfamilygenesassociatedwithleafsenescenceandstressesinGossypiumhirsutumL.[J].PlantCellTissOrg,117(2):167-186.032BA245-D028-4DA2-A536-F4FF14202739
SHIUSH,BLEECKERAB,2003.Expansionofthereceptorlikekinase/PellegenefamilyandreceptorlikeproteinsinArabidopsis[J].PlantPhysiol,132(2):530-543.
SLAMAI,ABDELLYC,BOUCHEREAUA,etal.,2015.Diversity,distributionandrolesofosmoprotectivecompoundsaccumulatedinhalophytesunderabioticstress[J].AnnBot,115(3):433-447.
TANGG,LIX,LINL,etal.,2015.CombinedeffectsofgirdlingandleafremovalonfluorescencecharacteristicofAlhagisparsifolialeafsenescence[J].PlantBiol,17(5):980-989.
WANGFB,LIUJC,CHENMX,etal.,2016.InvolvementofabscisicacidinPSⅡphotodamageandD1proteinturnoverforlightinducedprematuresenescenceofriceflagleaves[J].PLoSONE,11(8):e0161203
WANGJ,LEISTERD,BOLLEC,2015.PhotosyntheticlesionscantriggeracceleratedsenescenceinArabidopsisthaliana[J].JExpBot,66(21):6891-6903.
WANGYQ,CUIX,YANGB,etal.,2020.WRKY55transcriptionfactorpositivelyregulatesleafsenescenceandthedefenseresponsebymodulatingthetranscriptionofgenesimplicatedinthebiosynthesisofreactiveoxygenspeciesandsalicylicacidinArabidopsis[J].Development,147(16):dev189647.
WEIL,LIX,HUANGST,etal.,2019.CloningandprokaryoticexpressionofreceptorlikeproteinkinasegeneAhBAK1inArachishypogaea[J].Guihaia,41(4):573-588.[韦莉,李霞,黄舒婷,等,2019.花生类受体蛋白激酶AhBAK1的克隆及原核表达[J].广西植物,41(4):573-588.]
WOOHR,KIMHJ,NAMHG,etal.,2013.Plantleafsenescenceanddeathregulationbymultiplelayersofcontrolandimplicationsforagingingeneral[J].JCellSci,126(21):4823-4833.
WUYS,XUEH,LIUY,etal.,2010.Thestudyofsenescenceandfluorescencecharacteristicinleavesofstaygreenwheat[J].AgricResAridAreas,28(4):117-122.[武永胜,薛晖,刘洋,等,2010.持绿型小麦叶片衰老和叶绿素荧光特征的研究[J].干旱地区农业研究,28(4):117-122.]
XIADD,BAIZY,LIUB,etal.,2018.ChangesofprotectiveenzymeactivitiesinleavessenescenceofsoybeancultivarsbredatdifferentagesinJilinProvince[J].MolPlantBreed,16(1):228-233.[夏冬冬,白子裕,刘冰,等,2018.吉林省不同时期育成大豆品种叶片衰老中保护酶活性的变化[J].分子植物育种,16(1):228-233.]
XIAOHG,YANGHW,RAOY,etal.,2013.PhotosyntheticcharacteristicsandchlorophyllfluorescencekineticparametersanalysesofchlorophyllreducedmutantinBrassicanapusL.[J].ActaAgronSin,39(3):520-529.[肖華贵,杨焕文,饶勇,等,2013.甘蓝型油菜黄化突变体的光合特性及叶绿素荧光参数分析[J].作物学报,39(3):520-529.]
XIEJ,WANGM,DINGHY,etal.,2019.ExpressionandstructuralanalysisofScmiR3905panditstargetgenesinpotatoresponsetolowtemperature[J].SciAgricSin,52(13):2295-2308.[谢洁,王明,丁红映,等,2019.马铃薯低温响应的ScmiR3905p及其靶基因表达与结构分析[J].中国农业科学,52(13):2295-2308.]
XUET,LIUZH,DAIXH,etal.,2017.PrimaryrootgrowthinArabidopsisthalianaisinhibitedbythemiR159mediatedrepressionofMYB33,MYB65andMYB101[J].PlantSci,262:182-189.032BA245-D028-4DA2-A536-F4FF14202739
ZENGJB,2011.ConstructionoffulllengthcDNAlibraryofNicotianatabacumandcloningandcharacterizationofLRRreceptorlikeproteinkinasegene[D].Fuzhou:FujianAgricultureandForestryUniversity.[曾建斌,2011.烟草全长cDNA文库的构建和LRR类受体蛋白激酶基因的克隆及表达分析[D].福州:福建农林大学.]
ZHANGYH,XUF,JIANGTY,etal.,2019.OverexpressionofriceOsSAPP2genepromotesleafsenescenceinthetransgenicArabidopsis[J].JShenyangAgricUniv,50(2):129-137.[张艺函,徐凡,蒋太英,等,2019.过表达水稻OsSAPP2基因促进转基因拟南芥叶片衰老[J].沈阳农业大学学报,50(2):129-137.]
ZHOUF,GUOY,QIULJ,2016.Genomewideidentificationandevolutionaryanalysisofleucinerichrepeatreceptorlikeproteinkinasegenesinsoybean[J].BMCPlantBiol,16(1):58.
ZHOUJ,WANGP,CLAUSLAN,etal.,2019.ProteolyticprocessingofSERK3/BAK1regulatesplantimmunity,development,andcelldeath[J].PlantPhysiol,180(1):543-558.
ZHUANGRR,CHUWT,ZHAOSS,etal.,2018.CloningandbioinformaticsanalysisofAhLRPK1geneinpeanut[J].MolPlantBreed,16(11):3458-3467.[庄瑞蓉,储文婷,赵闪闪,等,2018.花生AhLRPK1基因的克隆及生物信息學分析[J].分子植物育种,16(11):3458-3467.]
(责任编辑李莉)
收稿日期:2020-10-11
基金项目:安徽省自然科学基金(1608085MC49);安徽省高校自然科学基金(KJ2018A0403);资源植物生物学安徽省重点实验室项目。
第一作者:张强(1976-),博士,副教授,研究方向为逆境植物生理生态学,(Email)zhangq@foxmail.com。
通信作者:薛涛,博士,副教授,主要从事生物化学与分子生物学研究,(Email)xuetao_26@163.com。032BA245-D028-4DA2-A536-F4FF14202739
