初始血钾水平与急诊ICU脓毒症患者预后的关系
2022-06-17牛亚芳
种 萌, 牛亚芳, 马 鑫, 马 莉
近年来相关研究[1]表明, 急危重症患者在重症监护病房(ICU)住院期间极易出现多种电解质紊乱(如血钾、磷、钙、镁等离子紊乱),易导致患者呼吸、心脏骤停,从而增加病死率。因此,ICU患者会常规监测血清离子,以及时纠正电解质紊乱。电解质紊乱多数是开始进行肠内营养支持治疗后发生的再喂养综合征引起的。随着电解质紊乱的纠正,减少热量的摄入可能改善患者症状及预后[2]。目前,脓毒症等急危重症患者临床上常见并发症(如血钾代谢紊乱)发生机制及相关治疗的研究较少。既往研究[3-4]表明,脓毒症及脓毒性休克患者发生难治性低血压和血管对儿茶酚胺反应性低的主要原因是由于钾离子(K+)通道被过度激活,因此抑制K+通道,降低血钾浓度可减少心血管应激反应,从而改善脓毒症患者的预后。已有相关研究[5-6]阐明了血钾紊乱与急危重症患者预后具有密切关系。脓毒症是由感染引起的宿主反应失调导致的致命性器官衰竭[7],而多器官功能障碍(如肾衰竭、心力衰竭患者)及使用肾素血管紧张素醛固酮抑制剂等某些药物的患者血钾紊乱的发生率更高。流行病学数据[8]显示,高钾血症患者的发病率与病死率之间存在密切联系,对于危重症患者而言,血钾升高将进一步导致不良预后。现国外对急危重症患者电解质紊乱的相关研究较多,而国内很少有研究关注血钾与脓毒症患者临床结局之间的关系。因此,本研究通过对兰州大学第二医院急诊ICU 212例脓毒症患者入院初始不同血钾水平及实验室检测指标与临床特征进行分析,探讨血钾对脓毒症患者疾病发展及预后的关系。
1 资料与方法
1.1研究对象 回顾性收集2019年1月至2021年10月兰州大学第二医院急诊ICU收治的212例脓毒症患者。纳入标准:①符合脓毒症的诊断标准(Sepsis 3.0)[9];②年龄≥18周岁;③住院时间≥24 h。排除标准:①妊娠期或哺乳期妇女;②临床资料不完整或随访中失访或放弃治疗的患者;③伴有甲状旁腺功能异常,或收集数据前出现肾功能异常、进行血液净化或服用影响血钾水平药物等治疗的患者;④有慢性器官衰竭及恶性肿瘤终末期的患者。本试验为回顾性研究,经过兰州大学第二医院伦理委员会批准(伦理批号:2021A-593)。
1.2研究方法
1.2.1 资料收集 收集患者一般临床数据,包括性别、年龄、生命体征、慢性基础疾病、感染部位、合并症、治疗方式、住院时间及国家早期预警评分系统(NEWS)分值[10]。
1.2.2 实验室指标 包括血气指标、炎症指标、血液系统指标、肝肾功能、电解质水平等,所有生化指标均取患者入院24 h内最差值进行分析。
1.2.3 随访及分组 对所有患者从出院后开始随访(共随访28 d)。根据患者28 d预后情况将其分为死亡组和存活组。根据患者入住急诊ICU 24 h内首次血钾水平分为三个亚组。正常血钾组为血钾3.5~5.5 mmol/L,低钾血症组为血钾<3.5 mmol/L,高钾血症组为血钾>5.5 mmol/L[11]。
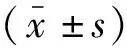
2 结果
2.1基本情况 本研究共入组212例脓毒症患者,其中男性142例(67.0%),女性70例(33.0%),年龄(59.97±16.65)岁;其中死亡103例,存活109例,病死率为48.6%。合并症包括呼吸衰竭、循环衰竭、肾衰竭、弥散性血管内凝血(DIC)、多器官功能障碍综合征(MODS)、消化道出血、肝功能障碍;基础疾病包括高血压、糖尿病等;感染部位包括呼吸系统、消化系统、泌尿系统、颌面、浅表组织及颅内。存活组与死亡组年龄、性别、基础疾病和入院时生命体征等比较差异无统计学意义(P>0.05);而两组NEWS分值、血钾水平、降钙素原(PCT)、C-反应蛋白(CRP)、肾功能指标、住院时间及合并症等比较差异有统计学意义(P<0.05),且不同血钾水平患者死亡组与存活组比较差异均有统计学意义(P<0.05)。见表1、2。
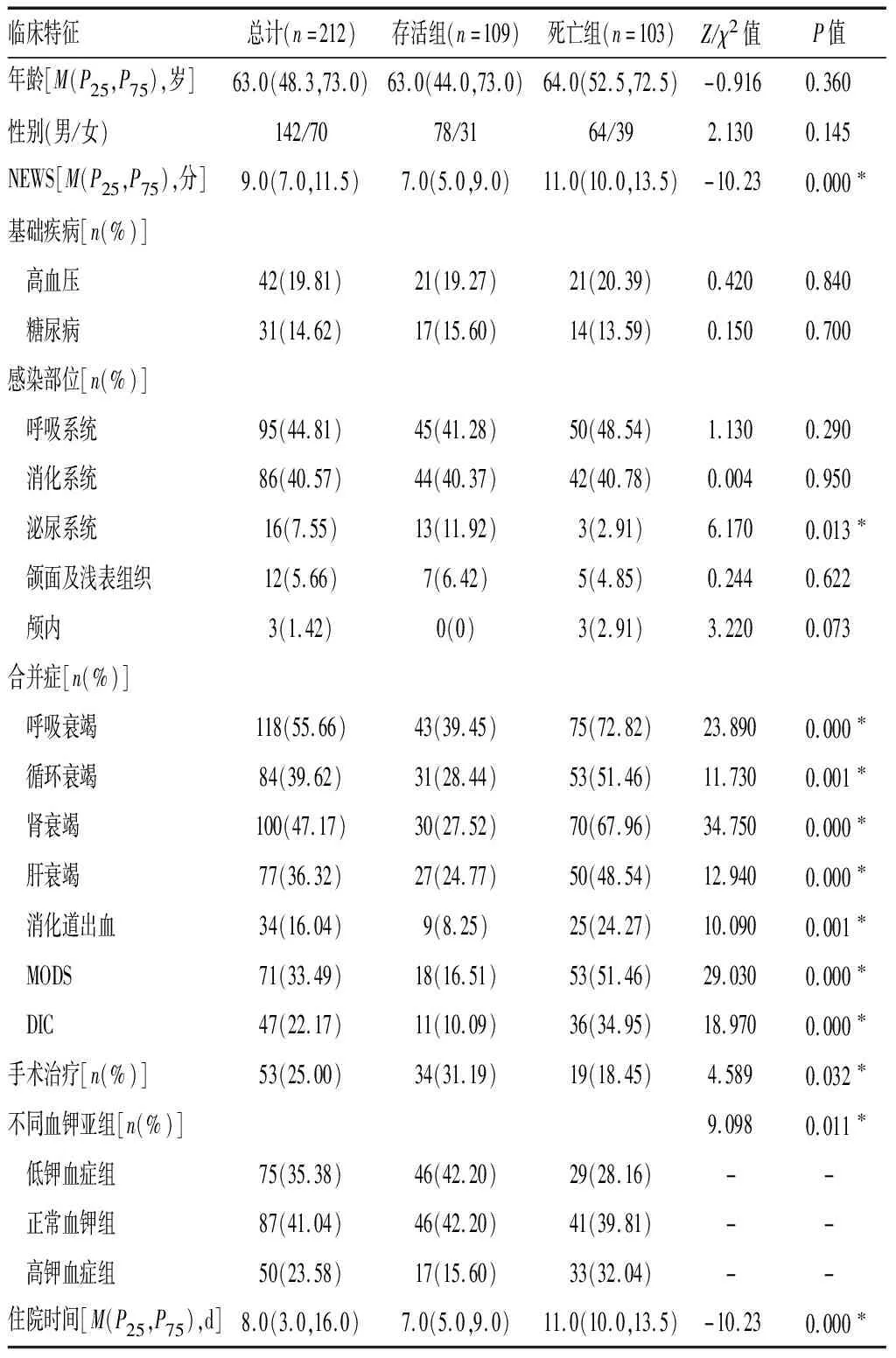
表1 脓毒症患者死亡组与存活组的基本临床特征
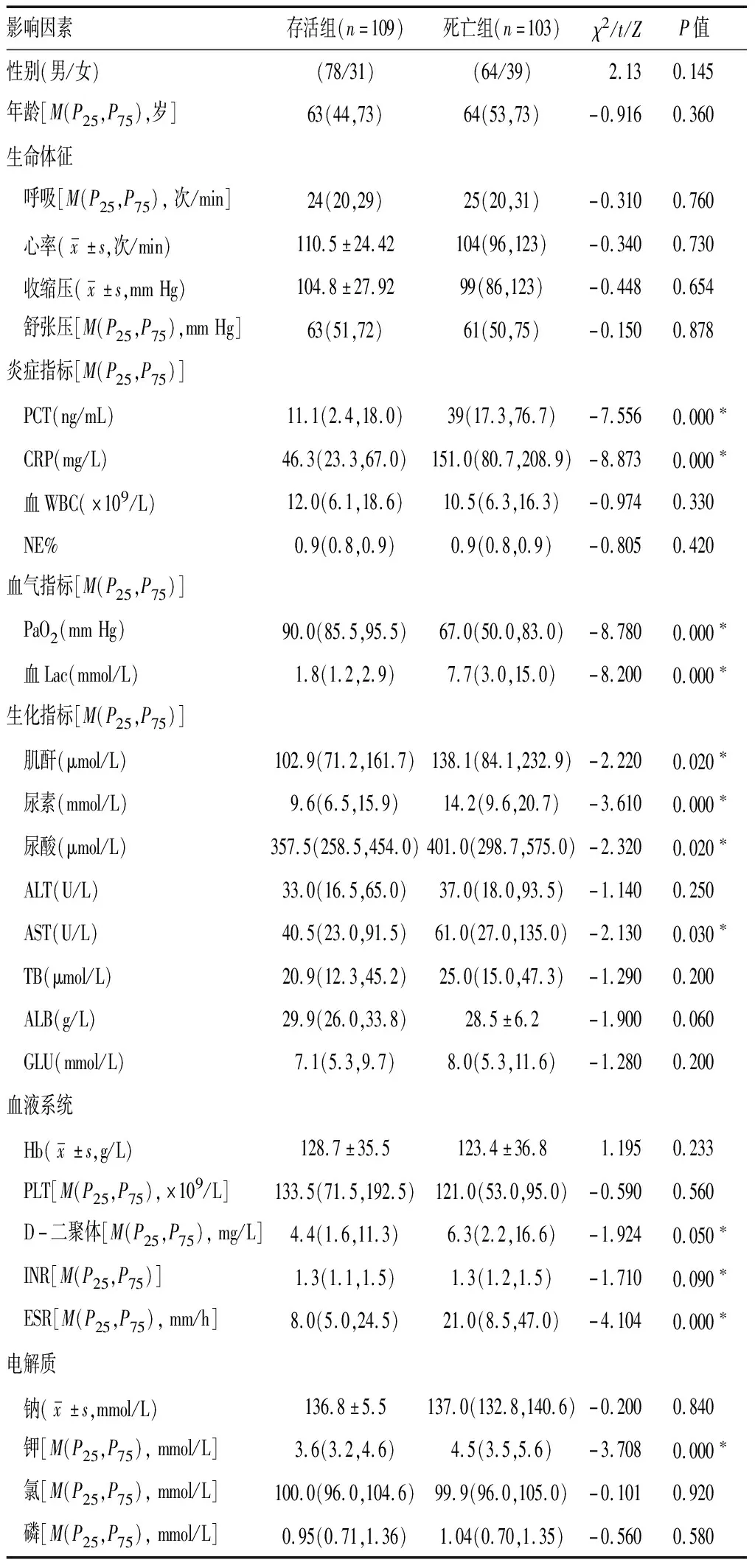
表2 脓毒症患者死亡组与存活组的生理生化指标分析
2.2多因素Logistic回归分析 将单因素分析得到的影响因素PCT、CRP、红细胞沉降率(ESR)、PaO2、血Lac、血钾、肝肾功能生化指标、住院时间、NEWS评分及合并症作为自变量进行多因素Logistic回归分析,以28 d全因病死率作为因变量(28 d内死亡:Y=1,存活:Y=0),在控制其他因素情况下得到是否合并DIC、NEWS评分、尿酸(UA)、血乳酸(Lac)、动脉血二氧化碳分压(PaO2)、CRP为影响脓毒症患者28 d病死率的独立危险因素(P<0.05)。见图1。
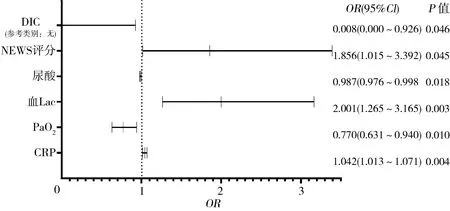
注:DCI为弥散性血管内凝血;NEWS为国家早期预警评分系统;Lac为乳酸;PaO2为动脉血氧分压;CRP为C-反应蛋白
2.3不同亚组间患者基线特征 纳入的212例脓毒症患者中,75例(35.38%)为低钾血症组,87例(41.04%)为正常血钾组,50例(23.58%)为高钾血症组。高钾血症组NEWS评分(10.1±3.7)分、CRP 93.1(56.3,173.4)mg/L、UA 430.5(305.0,705.0)μmol/L,明显高于正常血钾组及低钾血症组(P<0.05);呼吸系统感染、肾衰竭、呼吸衰竭及DIC等并发症在高钾血症组更为常见(P<0.05);而三组患者间年龄、性别、基础疾病、是否手术及住院时间比较差异无统计学意义(P>0.05)。三个亚组转归情况差异有统计学意义(P<0.05)。多元回归分析显示,低钾血症组与正常血钾组比较患者病死率(OR=0.642,95%CI0.331~1.244)和住院时间(OR=0.983, 95%CI0.949~1.019)差异无统计学意义(P>0.05);高钾血症组与正常血钾组比较住院时间(OR=1.022, 95%CI0.973~1.033)差异无统计学意义(P>0.05),而脓毒症患者28 d病死率(OR=2.206,95%CI1.053~4.621)较正常血钾组升高,差异有统计学意义(P<0.05)。见表3~5。
2.4不同指标对脓毒症患者预后的预测价值 将二元Logistic回归分析筛选出的影响脓毒症患者转归的独立危险因素纳入亚组中进行分析,得出NEWS评分、CRP、UA对脓毒症患者的预后有一定的预测价值,以及是否存在呼吸系统感染、肾衰竭、呼吸衰竭及DIC等合并症对不同血钾水平亚组脓毒症患者的预后也有影响(P<0.05)。将NEWS评分、CRP、UA及血钾分别绘制ROC曲线,计算AUC,AUC分别为0.905、0.853、0.592及0.647。计算NEWS评分、CRP、UA及血钾的约登指数,其对应的截断值分别为9.5分、97.12 mg/L、344.5 μmol/L及4.245 mmol/L,当各指标取值为截断值时,预测效能最大[12]。见表3、6和图2。
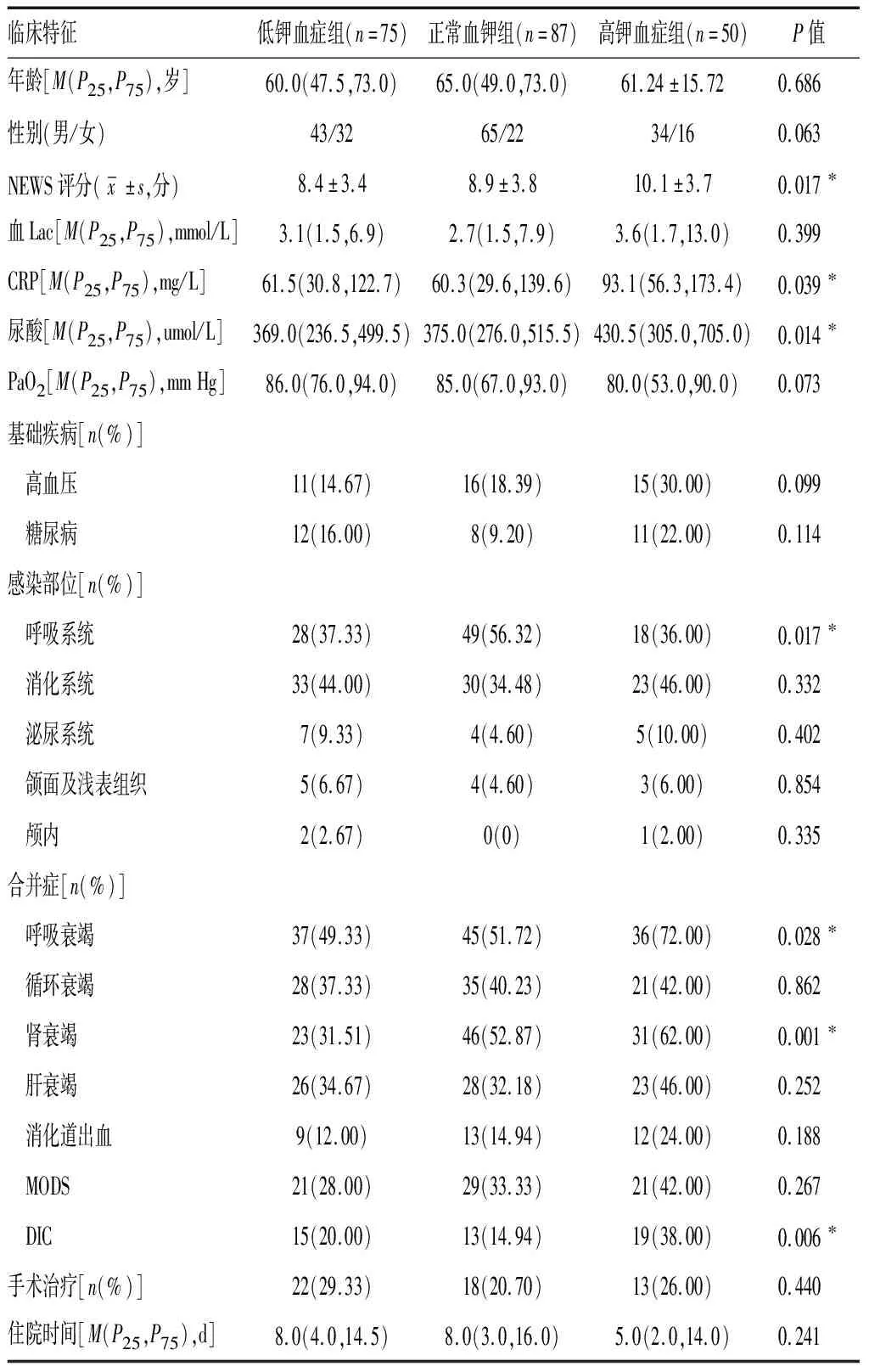
表3 不同血钾水平脓毒症患者的基线指标
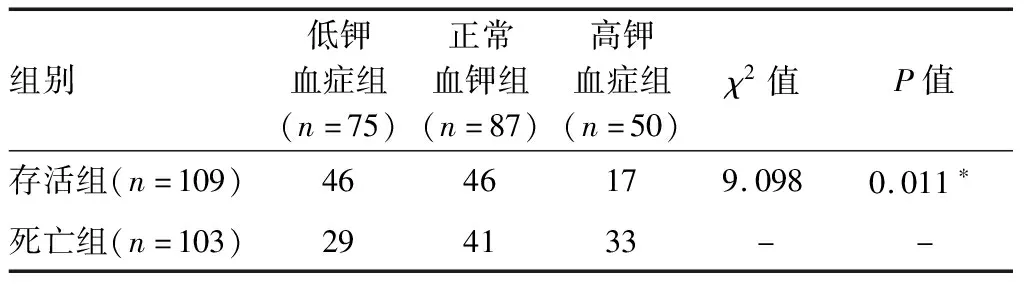
表4 不同血钾水平脓毒症患者转归情况(n)
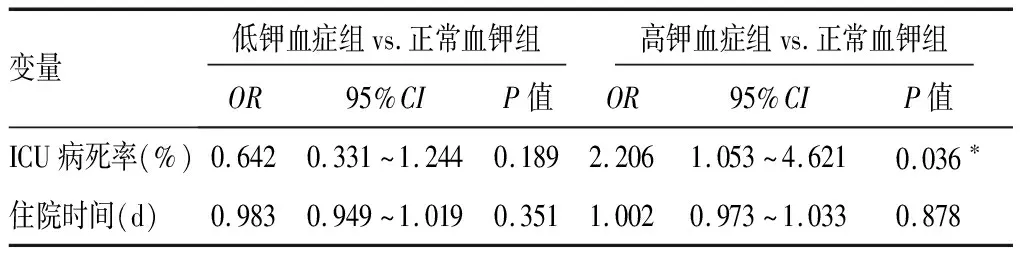
表5 不同血钾水平与脓毒症患者28 d病死率关系的多变量Logistic模型分析
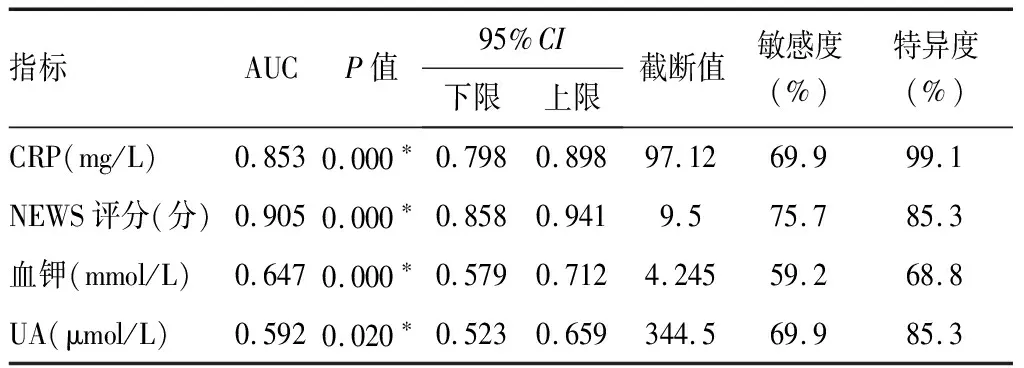
表6 不同指标预测脓毒症患者预后的AUC值及截断值
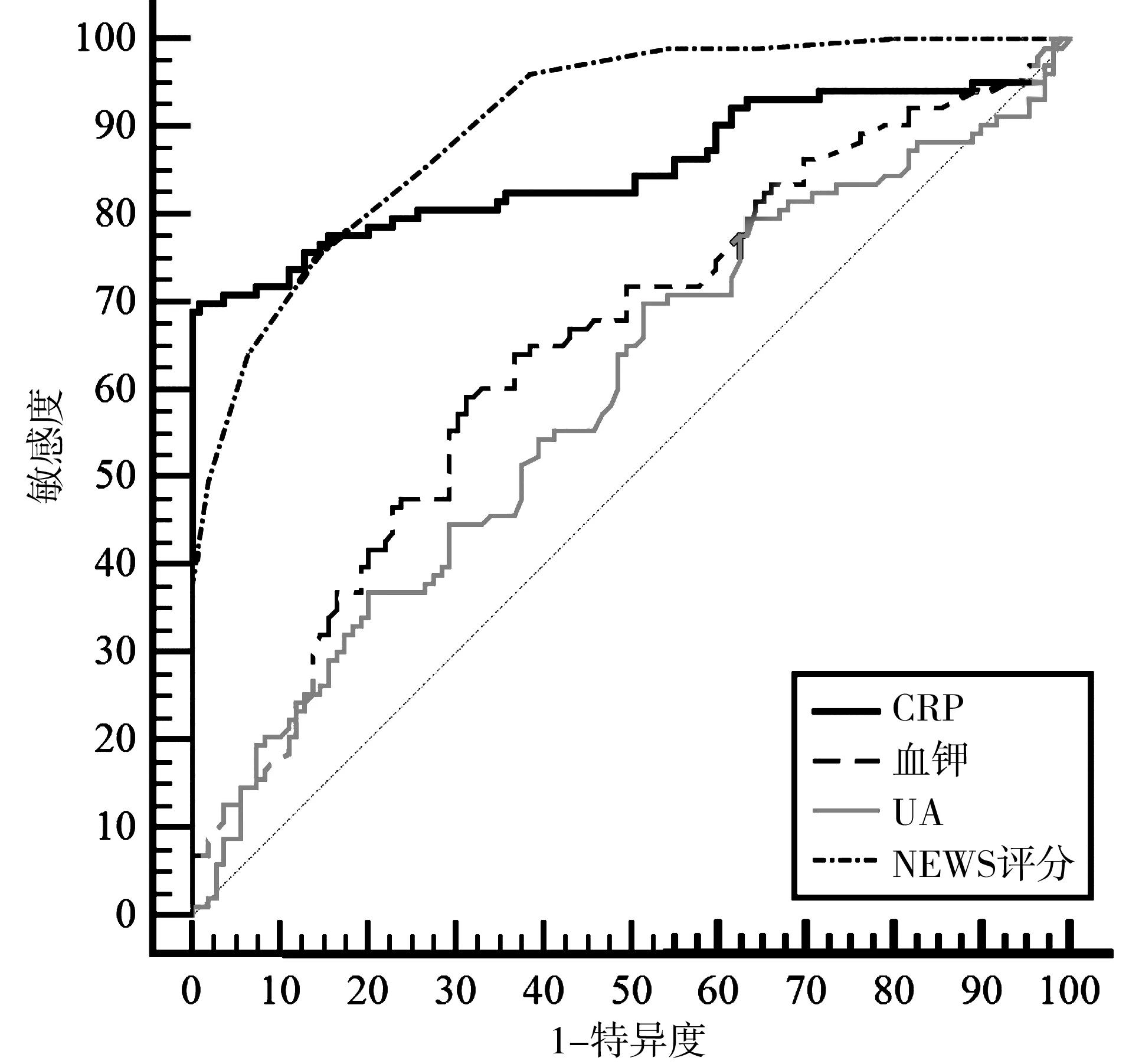
注:CRP为C-反应蛋白;NEWS为国家早期预警评分系统;UA为尿酸
3 讨论
目前在全世界范围内由脓毒症导致的病死率仍居高不下。本研究表明,在急诊ICU入院24 h内高钾血症与脓毒症患者病死率增加有关。血K+是维持机体内环境重要的电解质,在心血管系统、骨骼肌、神经系统及各个器官功能正常运作中必不可少,而维持血钾水平稳定也需要不同器官的参与。追溯到Sepsis 3.0定义可知,脓毒症是由感染引起的致命性器官障碍[13],因此身体的每一个主要器官都会不同程度上产生一定的功能障碍。危重症患者电解质紊乱多由器官衰竭及肠内营养治疗导致。脓毒症患者常合并急性肾损伤(acute kidney injury, AKI)、肾衰竭、呼吸循环衰竭和DIC等器官功能障碍,上述合并症均是导致患者电解质紊乱的原因。
心血管系统功能障碍是脓毒性休克患者最严重的并发症,导致机体灌注异常,充分液体复苏也无法纠正的低血压,这是由于血管对儿茶酚胺的反应性降低及不同程度心肌抑制所导致的[14-15]。脓毒症所致血管低反应性的发生与一氧化氮(NO)途径、K+通道过度激活和血管加压素水平降低有关[16]。脓毒症及脓毒性休克所致的K+通道过度激活其中一个潜在的靶点是ATP敏感性K+通道(K+-ATP),这是一个对心血管应激反应至关重要的离子通道,血管通道的过度激活现在被认为是脓毒性休克中低血压和血管对儿茶酚胺反应性降低的主要原因[17]。K+通道是一种跨膜蛋白,正常情况下细胞膜上的通道开放会促进细胞内K+的流失,导致细胞膜超极化。K+通道的关键作用包括维持细胞的静息膜电位,调节神经元的兴奋性,释放神经递质,控制心率、平滑肌张力、激素分泌和上皮电解质转运[18]。K+的内稳态是通过不同的方法来维持的,人体K+的总含量是通过改变肾脏K+的排泄量来应对摄入量的变化达到的[19]。在肾脏疾病、心力衰竭和使用肾素血管紧张素醛固酮抑制剂等某些药物的患者中,血钾进一步升高,加重脓毒症患者心、肾功能障碍,从而增加病死率[8]
本试验研究中就合并症分析可见,呼吸衰竭、肾衰竭和合并DIC患者在高钾血症组占比更高,其预后更差。
脓毒症是ICU中AKI的主要病因,几乎占所有 AKI事件的一半。在ICU环境中,高钾血症经常发生在AKI或肾功能恶化的患者中。当发生肾损伤时,患者会出现氮质血症,水、电解质和酸碱平衡紊乱,尤其是高钾血症、代谢性酸中毒,以及全身各系统症状,若损伤不能及时得到治疗,会出现少尿(<400 mL/24 h或17 mL/h)或无尿(<100 mL/24 h),UA增高,甚至肾衰竭,导致K+潴留,加重脓毒症患者的病死率[20]。
呼吸衰竭时患者体内二氧化碳潴留会导致血钾水平明显上升,这些变化并不完全依赖于肾脏机制,肺心病患者经常发生原因不明的猝死,可能与PaO2的突然增加而导致的细胞外K+水平的突然上升有关,因此,在发生呼吸衰竭,尤其合并呼吸性酸中毒时常规吸氧治疗或早期机械通气更加重要[21]。
相反,高钾血症引起的心律失常或心脏泵血异常,导致心力衰竭和肺部充血,同时也会加重呼吸衰竭[22]。有研究[23]也表明,在ICU住院期间血钾≥5.5 mmol/L与住院期间呼吸衰竭风险明显增加有关。
DIC是由于凝血障碍导致的微血管广泛的血栓形成,是脓毒症常见的危及生命的并发症。脓毒症相关性DIC是由于凝血系统激活,纤溶系统受到抑制,导致器官功能障碍并伴有全身血管内炎症[24]。脓毒症相关性 DIC 发病机制包括组织因子的表达和随后凝血中的激活;纤溶酶原激活物抑制物-1(PAI-1)的产生抑制了纤维蛋白溶解;由内皮细胞功能障碍导致的生理抗凝通路的损伤[25],本研究中脓毒症患者合并DIC病死率更高。
既往很少有研究关注脓毒症患者高钾血症和病死率之间的关系。本研究结果表明,患者入住急诊ICU 24 h内高钾血症患者,尤其合并呼吸衰竭、肾衰竭和DIC与脓毒症患者病死率增加有关。本研究中,首先通过分析影响死亡组与存活组患者预后的相关因素,得出是否合并DIC、NEWS评分、UA、血Lac、PaO2、CRP为影响脓毒症患者28 d病死率的独立因素。根据血钾水平将患者分为三个独立的亚组,纳入多因素分析得出的独立影响因素,进一步分析不同血钾水平亚组间的差异。本研究结果还表明,在212例脓毒症患者中高钾血症的发生率为23.6%(50/212),其中高钾血症在存活组和死亡组的发生率分别为15.6%(17/109)、32.0%(33/103);不同血钾水平亚组间脓毒症患者病死率为低钾血症组38.7%、正常血钾组47.1%、高钾血症组66.0%,可以看出高钾血症组的病死率明显高于其他两组,且三组间的转归情况也有统计学意义(P=0.011),与正常血钾组比较,高钾血症组脓毒症患者病死率更高(P=0.036)。
脓毒症患者病情危重,病死率高,如果能够早期对预后进行评估将极大改善患者的预后。既往已有研究表明,PCT、CRP及急性生理学与慢性健康状况评估系统Ⅱ(APACHEⅡ)评分等指标对预测脓毒症等急危重症患者预后有较高的价值。本研究通过单因素及多因素分析后,最终纳入了NEWS评分、CRP及UA三项指标,且对应的AUC分别为0.905、0.853、0.592,表明NEWS评分相较于其他两项指标具有更高的诊断价值。本研究纳入NEWS评分比起全身炎症反应综合征(SIRS)评分、序贯器官衰竭评分(SOFA)、快速序贯器官衰竭评分(qSOFA)及APACHEⅡ评分等简单、易测,只需要进行基本生命体征监测即可对患者病情进行初步预测[26],NEWS评分简单、有效,更适用于急危重症患者评估预测。有研究[27]表明, 在疑似脓毒症患者中NEWS评分比qSOFA评分和SIRS评分更能准确预测患者10 d和30 d的病死率。此外,NEWS评分还可以用于急诊危重患者,根据不同科室、环境进行相应的补充和改良,从而更好地达到预警识别能力。因此,对于急危重症患者,本研究可以将脓毒症患者入院24 h内血钾与NEWS评分结合预测预后,进而缩短评估病情的时间,提高患者的生存率。
综上所述,本研究在最初多因素分析中纳入血钾,而在后期亚组分析中发现,不同血钾水平脓毒症患者间病死率差异有统计学意义,可见血钾水平异常本身不是影响脓毒症患者死亡的独立因素,而导致血钾水平异常的合并症对患者疾病预后影响更大。通过动态监测血K+水平可以提前预测治疗由脓毒症导致的相关器官功能障碍,降低患者病死率。因此,监测患者入院24 h内血钾水平,可初步预测脓毒症患者的预后,但是能否通过早期干预血钾水平来改善脓毒症患者的病情,仍有待进一步临床验证。本研究中仅纳入入院24 h内血钾水平,避免了后期用药及辅助治疗对血钾的干扰,但本研究也存在局限性,首先,本研究仅通过分析血钾水平来预测脓毒症患者的预后,指标比较单一,后期研究将入院血钾水平与NEWS评分联合来预测患者预后,从而提高预测效能。此外,本研究为单中心回顾性研究,研究对象仅为急诊ICU收治的脓毒症患者,具有一定的地域差异及统计偏倚;且纳入的样本量较少,得出的结论仍有待商榷,需进一步行多中心、更大样本量的前瞻性研究来验证这一结论,从而得到更有价值的研究结果。
