热损伤血管内皮细胞对巨噬细胞极化的影响
2022-06-17张玲琴谢建刚王倩梅徐云云
张玲琴, 谢建刚, 王倩梅, 徐云云, 黄 杨
热射病即重症中暑,是由于暴露在高温高湿环境中导致身体核心温度迅速升高,超过40 °C,伴有皮肤灼热、意识障碍(如谵妄、惊厥、昏迷)等多器官系统损伤的严重临床综合征[1]。热射病相关炎症反应类似于全身炎症反应综合征(systemic inflammatory response syndrome, SIRS),导致临床状态迅速恶化,导致弥散性血管内凝血、急性肺损伤、多器官功能障碍综合征和死亡[2]。热射病SIRS具有特殊性和复杂性,是一种由细胞热毒性、组织缺血缺氧及内毒素血症共同导致的剧烈免疫反应,并伴随着内皮细胞的广泛参与。正确认识热射病SIRS的特点,及时予以干预措施,阻断SIRS进一步发展在热射病治疗中亟需引起重视[3-5]。研究表明,热射病时免疫细胞的增加和功能调控可能与内皮细胞激活/功能障碍导致有关[6]。我们前期通过热射病患者外周血单个核细胞测序,利用生物信息学分析发现趋化因子5(chemokine ligand 5,CCL5)基因上调可能是热射病预后的关键基因[7]。因此,本研究拟通过建立内皮细胞热损伤模型观察内皮CCL5是否对巨噬细胞功能有一定调控作用,以期对热射病SIRS的形成进一步阐释,对热射病临床靶向治疗提供一定的参考。
1 材料与方法
1.1材料 小鼠巨噬细胞系(RAW264.7)细胞、小鼠肺微血管内皮细胞系(MPVECs)细胞均由空军军医大学免疫学教研室馈赠。CO2恒温培养箱购自美国热电公司;超微量核酸分析仪购自杭州奥盛仪器有限公司;安捷伦Mx3005P实时荧光定量聚合酶链反应仪购自Agilengt公司;Western blot电泳仪、转膜仪、化学发光成像系统购自Bio-Rad公司;全自动酶标仪购自Therm Scienctific公司;SH800流式细胞仪购自日本索尼公司;定量PCR常规引物合成由陕西擎科生物公司合成;RNA提取、反转录、定量PCR试剂盒购自北京Genestat公司;ELISA试剂盒购自北京中杉金桥生物公司;胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI1640培养基购自美国Gibico公司。马拉韦罗(UK-427857,Maraviroc)购自美国MCE公司。
1.2方法
1.2.1 细胞常规处理 从液氮中取出RAW264.7细胞、MPVECs细胞并37 ℃水浴快速复苏,用含100 mL/L胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI1640培养基在恒温37 ℃、50 mL/L CO2培养箱中培育。
1.2.2 热处理细胞模型建立 培养MPVECs细胞至对数生长期,消化细胞并计数,取适量细胞接种于培养皿中培养过夜。放入恒温40 ℃、50 mL/L CO2培养箱中处置1.5、3、6 h作为实验组,未热处理细胞作为对照组,完成内皮细胞热处理模型的构建。显微镜下观察细胞形态,胰酶消化后充分混匀细胞,取100 μL进行台盼蓝染色并计算细胞活性。其余细胞800 r/min离心5 min后吸取上清200 μL,ELISA检测培养上清中CCL5的含量。根据细胞形态、细胞活力和CCL5含量,选取热处理时间。实验重复三次。
1.2.3 内皮细胞热处理上清刺激RAW264.7细胞 选定热处理时间后,将MPVECS细胞热处理后,2000 g离心20 min,留取上清后利用0.22 μm滤器过滤备用。吸弃RAW264.7细胞培养液,换MPVECs细胞培养上清,根据加入MPVECs细胞培养上清的差异分为对照组(37 ℃培养上清)、处理组(40 ℃热处理培养上清)、干预组[40 ℃热处理培养上清+趋化因子5受体(chemokine receptor 5,CCR5)阻断剂Maraviroc 200 μg/mL],将三组RAW264.7细胞在恒温37 ℃、50 mL/L CO2培养箱培养6 h,收取细胞进行后续试验。
1.2.4 流式细胞术检测巨噬细胞M1/M2极化 各组培养6 h后收取细胞,吸弃培养上清,用预冷的流式洗液洗涤后,小心刮取细胞,使用CD11b、CD206抗体避光染色30 min,再次洗涤后上流式细胞仪进行检测,所得结果使用FlowJo软件进行分析。实验重复三次。
1.2.5 实时定量PCR检测RAW264.7细胞白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)的mRNA表达 各组培养6 h后收取细胞,提取总RNA并反转录,按以下反应体系将相应试剂加入0.1 mL荧光定量PCR 8联管:反转录产物1 μL,前后引物各0.5 μL,SYBR Green 5 μL,无RNA酶去离子水3 μL。样本加好后,按以下方法设置两步法反应程序:95 ℃持续2 min,模板变性;(95 ℃持续10 s,53 ℃持续15 s)×40次循环。按照2-△△Ct公式处理各组CT值并计算相对定量。实验重复三次。
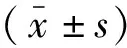
2 结果
2.1热处理3 h的培养上清适合用于刺激RAW264.7细胞 MPVECs细胞放入恒温40 ℃、50 mL/L CO2培养箱中处置1.5、3、6 h,显微镜下观察细胞形态。结果显示,1.5、3 h组细胞透明度良好,折光性强,细胞轮廓不清晰,胞质空泡较少,6 h组细胞透明度一般,折光性较差,细胞轮廓清晰,胞质空泡较多(见图1A);行台盼蓝染色并计算细胞活性发现,1.5、3 h组细胞活性较好,6 h组细胞活性稍差(见图1B);ELISA检测培养上清CCL5含量发现,3、6 h组CCL5含量较1.5 h组升高(见图1C)。MPVECs细胞40 ℃热处理3 h,细胞形态、细胞活性和培养上清CCL5含量均较好,适合作为热处理截止时间。

注:CCL5为趋化因子5;与0 h组比较,*P<0.05,**P<0.01
2.2各组RAW264.7细胞M1极化情况 各组细胞进行流式细胞染色及检验,结果表明,与对照组比较,处理组和干预组M1极化比例均明显上升,而阻断CCR5后干预组较处理组M1极化明显下降(P=0.002)。见图2。
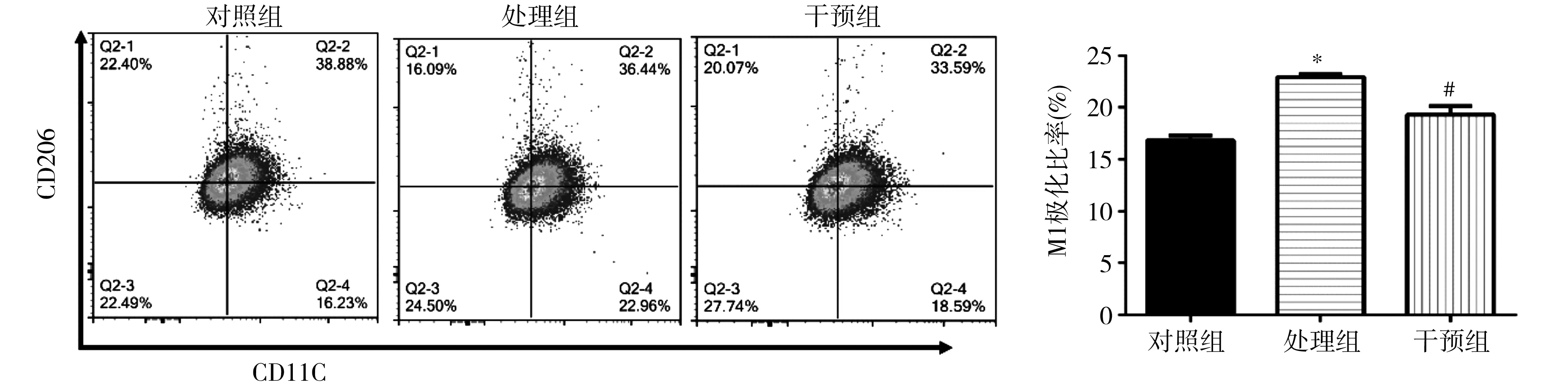
注:CD11c为白细胞分化抗原11c,巨噬细胞M1极化标志;CD206为白细胞分化抗原206,巨噬细胞M2极化标志;与对照组比较,*P<0.01;与处理组比较,#P<0.01
2.3各组RAW264.7细胞IL-1β、IL-6、TNF-α的mRNA表达和培养上清IL-1β、IL-6、TNF-α含量检测 实时定量PCR检测各组RAW264.7细胞炎症因子的mRNA相对表达量,结果发现,处理组IL-1β、IL-6、TNF-α的mRNA表达较对照组明显升高,干预组较处理组下降。ELISA检测各组细胞因子表达发现,处理组IL-1β、IL-6、TNF-α含量明显高于对照组(P<0.01)。其中干预组IL-1β明显低于处理组(P<0.01),且基本下降到对照组的水平(P>0.05)。干预组的IL-6虽高于对照组(P>0.05),但明显低于处理组(P<0.05)。TNF-α含量在干预组与处理组中差异无统计学意义(P>0.05)。见图3。
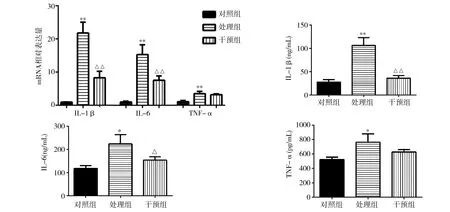
注:IL-1β为白细胞介素-1β;IL-6为白细胞介素-6;TNF-α为肿瘤坏死因子-α;与对照组比较,*P<0.05,**P<0.01;与处理组比较,△P<0.05,△△P<0.01
3 讨论
趋化因子CCL5属于CC趋化因子家族的成员,具有介导免疫细胞定向趋化的作用[8],其受体有3个,分别是CCR1、CCR3和CCR5,其中以CCL5与CCR5的亲和力最强,构成了CCL5/CCR5生物轴[9]。在炎性反应中,CCL5与配体特异结合,激活下游G蛋白,导致胞内钙离子浓度增加,进一步活化蛋白激酶C,产生相应免疫细胞的募集并激活免疫反应[10]。我们在前期研究发现劳力性热射病预后不良患者外周血单个核细胞CCL5基因表达水平和血浆CCL5含量较对照组患者明显升高,且与IL-6、PCT、CRP等促炎因子的表达正相关,强烈提示CCL5可能调控免疫细胞功能促进热射病SIRS的发生发展[7]。
趋化因子CCL5与其受体CCR5组成的通路轴参与各种病理过程,包括炎症、慢性疾病、癌症以及新型冠状病毒感染(COVID-19)[11]。一项对COVID-19相关的免疫反应和机制研究表明,CCL5/CCR5轴促进了免疫细胞活化及炎症损伤[12]。抗 CCR5 化合物Maraviroc 是第一个获得 FDA 批准的趋化因子受体靶向药物[13],在对抗COVID-19引起的细胞因子风暴中Maraviroc发挥出了意想不到的良好效果[14]。但是目前尚无阻断CCL5/CCR5轴在热射病中的研究报道。热射病发生时广泛的内皮细胞尤其是血管内皮细胞首先受到损伤[15],血管内皮细胞TLR4受体激活后促进CCL5等细胞因子的合成和释放[16]。CCL5的受体CCR5主要在巨噬细胞表面分布,血管内皮释放的CCL5可能与巨噬细胞表面的CCR5结合,调控巨噬细胞功能,参与热射病免疫调控过程。
为了验证血管内皮细胞来源的CCL5是否通过CCR5调控巨噬细胞功能,本研究设计了利用热处理后的血管内皮细胞培养上清刺激巨噬细胞,观察巨噬细胞功能的相关实验。首先,发现40 ℃热处理血管内皮细胞3 h细胞形态好、细胞活性高,且培养上清CCL5含量明显上升,适合作为热处理截止时间。其次,建立共培养体系刺激巨噬细胞,发现巨噬细胞明显向促炎的M1型极化,并且促炎细胞因子IL-1β、IL-6、TNF-α表达明显升高。巨噬细胞极化为M1型起促炎作用,可以释放大量的促炎细胞因子,扩大加重炎症,而巨噬细胞极化为M2型起抑炎作用,局限减轻炎症[17]。为了验证血管内皮细胞热损伤后释放的CCL5是否是促进巨噬细胞M1型极化的关键,本研究通过使用Maraviroc,靶向阻断CCL5/CCR5轴,发现阻断后巨噬细胞M1极化和促炎细胞因子表达均明显下降,尤其IL-1β基本下降到正常对照组的水平,提示血管内皮细胞热损伤后释放的CCL5是促进巨噬细胞M1极化的关键。CCL5对巨噬细胞的作用研究既往在肿瘤中开展较多,其在癌细胞增殖、抗凋亡、抗药性、迁移和侵袭中有不同的作用[18-20]。最近也有研究发现,CCL5 是巨噬细胞极化中的新型先天免疫调节剂,促进巨噬细胞向M1极化,导致了药物性肝损伤[21]。而另一项关于辐射诱导食道癌细胞的研究发现,上调 CCL5 表达促进THP-1 衍生的巨噬细胞向 M2 亚型极化,从而增强细胞转移[22]。对巨噬细胞极化作用的差异可能与机体状态有关。本研究通过监测M1极化相关的炎症因子表达发现,热处理血管内皮细胞上清可以促进巨噬细胞分泌IL-1β、IL-6、TNF-α,利用Maraviroc阻断CCL5/CCR5途径明显减少IL-1β的表达,但TNF-α含量无明显变化。这些变化可能与血管内皮细胞热损伤时分泌其他趋化因子及膜糖蛋白脱落有关,需要进一步研究。
总之,通过研究发现热处理血管内皮细胞可以释放CCL5促进巨噬细胞M1极化,并促进IL-1β、IL-6、TNF-α的分泌,使用Maraviroc阻断CCL5/CCR5途径可以抑制巨噬细胞M1极化和促炎细胞因子IL-1β、IL-6的分泌。使用Maraviroc靶向CCL5/CCR5轴可能对热射病SIRS防治有一定作用。
