表面微孔及内部管网结构促进聚醚醚酮与软组织结合的体内实验
2022-06-16冯晓珂白石柱赵铱民
冯晓珂 白石柱 赵铱民
聚醚醚酮(polyether ether ketone, PEEK)因良好的生物相容性和与人类皮质骨相近的弹性模量而被应用于医学领域[1]。但由于其本身为化学惰性材料导致PEEK植入后和周围的软组织不能形成良好的结合。植入物的空间结构对其与软组织的结合有重要的影响[2]。酸蚀后的PEEK植入动物体内后显示其与骨组织的结合能力有所提升[3]。但仅仅是表面结构的改变并不足以满足在颌面部缺损修复中应用PEEK植入来达到结合稳定、可靠的修复效果。因此,本研究拟利用数字化设计一种规则精细的内部管状孔隙网结构, 3D 打印出树脂代型再通过热压铸成型技术精确制作具有对应的PEEK试件,对具有该结构的植入物表面进行酸蚀从而形成表面微孔结构,成为一种表面积内部双空间结构改变的PEEK植入物,并进行新西兰大白兔皮下移植实验,对相应结果进行分析,为 PEEK 植入物的临床应用设计提供理论基础。
1 材料与方法
1.1 实验材料、试剂及设备
PEEK(Ketron LSG, 美国);原子粒显微镜(D3100,Veeco Instrμments, 美国);接触角检测仪(EASY DROP K100, KRUSS, 德国);扫描电镜 (S4800, Hitachi,日本);胎牛血清(HyClone, 美国);1%青霉素/链霉素(Sigma, 美国);高糖 DMEM (HyClone, 美国);PBS(HyClone, 美国);24 孔标准培养板(VWR,美国);金刚石线锯(E312,EXAKT,德国);磨片机(E400CS,EXAKT, 德国)。
1.2 方法
1.2.1 PEEK试件的制备 试件分组:直径为15 mm的圆盘:实心试件P(厚度3 mm)、管状孔隙网直径为1 mm的试件P1.0(厚度为3 mm)、管状孔隙网直径为1.5 mm的试件P1.5(厚度为3.5 mm)、管状孔隙网直径为1 mm的试件P2.0(厚度为4 mm)。3 组带孔隙的试件中相邻两孔洞间的间隔与孔洞直径相同。孔洞距离上下表面的距离分别为1 mm,即其内部支撑柱的上下边缘距离上下表面的距离均为1 mm。
试件制备过程: (1)在Materialize Magic 22.0软件中设计内部管状孔隙网结构的试件; (2)3D打印设计好的试件的树脂代型; (3)高压水枪清洗树脂代型中的支撑材料; (4)包埋树脂代型; (5)茂福炉中850 ℃烧结失模; (6)加入颗粒状PEEK原料并在400 ℃的铸瓷炉中压铸; (7)清洗PEEK铸件并抛光。喷砂去除铸件表面包埋材料后用抛光砂纸抛光。
1.2.2 PEEK铸件表面酸蚀 清洗抛光好的PEEK试样分别在98%浓硫酸中酸蚀5 min,得到微孔表面分别为SP、 SP1.0、 SP1.5、 SP2.0的组。酸蚀后,用去离子水、丙酮、无水乙醇依次清洗 PEEK 试样,去除表面残留的浓硫酸。为了确保最大程度去除样本表面的浓硫酸,一系列清洗过程后将试件放置在 120 ℃通风干燥炉中烘干4 h以进一步去除残余浓硫酸。最后,没有酸蚀的试件和酸蚀后的试件高温(121 ℃)和高压(0.12 MPa)灭菌为后续研究使用。
1.2.3 表面特征观察 用扫描电镜(SEM)对酸蚀前、后的PEEK试件表面进行比较。用无水乙醇对 PEEK 试件梯度脱水后干燥、喷金,然后在 SEM 下观察、并对其表面做与去离子水接触角实验。
1.2.4 体内软组织的结合实验 用10 只雄性新西兰大白兔,在其体内分别植入了P、 P1.0、 P1.5、 P2.0、 SP、 SP1.0、 SP1.5和SP2.0 组的 PEEK 压铸试件。
术后 4 周处死动物,取兔标本(10 只大白兔,每组10 个样本),用4%多聚甲醛溶液固定。48 h 后,包埋、切片,然后用苏木精-伊红(HE)染色。最后在光学显微镜下观察切片。
1.3 统计分析
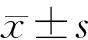
2 结 果
2.1 实验试件设计
如图 1所示,试件是直径为15 mm的圆盘,依据圆盘上设计的孔洞的直径不同,对应的圆盘厚度也不同。相邻两孔洞间的间隔与孔洞直径相同。孔洞距离上下表面的距离分别为1 mm,即其内部支撑柱的上下边缘距离上下表面的距离均为1 mm。

图 1 试件的设计图及相关参数
2.2 3D打印结果
如图 2第一行可见树脂代型的表面以及内部管状孔隙网中都充满了支撑材料。图 2第二行支撑材料清除后的树脂代型,可见孔洞结构清晰且完整与设计图一致。

图 2 3D树脂代型中支撑材料清理前后对比
如图 3所示,可见试件呈棕褐色,表面观管状孔隙网结构完整, 试件表面及内部均有包埋材料,铸道和排气道也较完整。第二行清理了包埋材料后的试件呈现PEEK原有的棕色,孔洞结构清晰完整。

图 3 最终压铸并清理后得到的PEEK试件
2.3 酸蚀结果
采用压铸成型技术制备的PEEK试样,酸蚀前(A) P, 酸蚀后(B) SP(图 4)。没有用硫酸酸蚀的试件(P)在抛光后获得镜面光滑表面(图 4)。硫酸酸蚀后的试件(SP)满是更粗糙的白垩色表面(图 4)。 两组试件表面的 SEM 图像如图 5所示。样本P光滑(图5);而 SP 试样表面比较粗糙(图 5)。标本 P(86.068°±0.061°)的水接触角明显高于酸蚀后的试样 SP(57.123°±0.202°)水接触角(图 5,n=6,P<0.001)。

图 4 PEEK铸件酸蚀前后对比图

图 5 压铸的PEEK样品的表面表征
2.4 动物皮下移植实验结果
PEEK 在新西兰大白兔皮下移植后4 周的取材。HE 染色结果表明,横断面和纵向截面视图都显示软组织和 P 组的 PEEK 样品之间有空隙形成,并没有完全、紧密结合(图 6)。但是在 SP 组的 PEEK 试件中没有这样的空隙。同时还可以观察到部分软组织长入 SP 组试件表面的酸蚀微孔中,这也增强了软组织和 PEEK 试件之间的结合 (图 6)。P1.0、 P1.5、 P2.0 组、 SP1.0组、 SP1.5 组和 SP2.0 组在横断面和纵向上均有软组织在 PEEK 内部管状孔隙网结构中生长。在 P1.0组、 P1.5组和P2.0 组(图 6)中可以观察到软组织与 PEEK标本之间的空隙并没有紧密结合,但在横断面上,SP1.0 组、 SP1.5 组和 SP2.0 组(图 6)中看不到这样的空隙,软组织与 PEEK 试件结合紧密。此外, SP1.0、 SP1.5和 SP2.0 组的 PEEK 试件表面的酸蚀微孔中也可以观察到有部分软组织生长进入。HE 染色也显示, P1.0和SP1.0组的PEEK试件中仅有部分软组织生长进入内部的管状孔隙网结构中,而 P1.5、 P2.0、 SP1.5 和 SP2.0 组的 PEEK 试件中有更多的软组织长入。
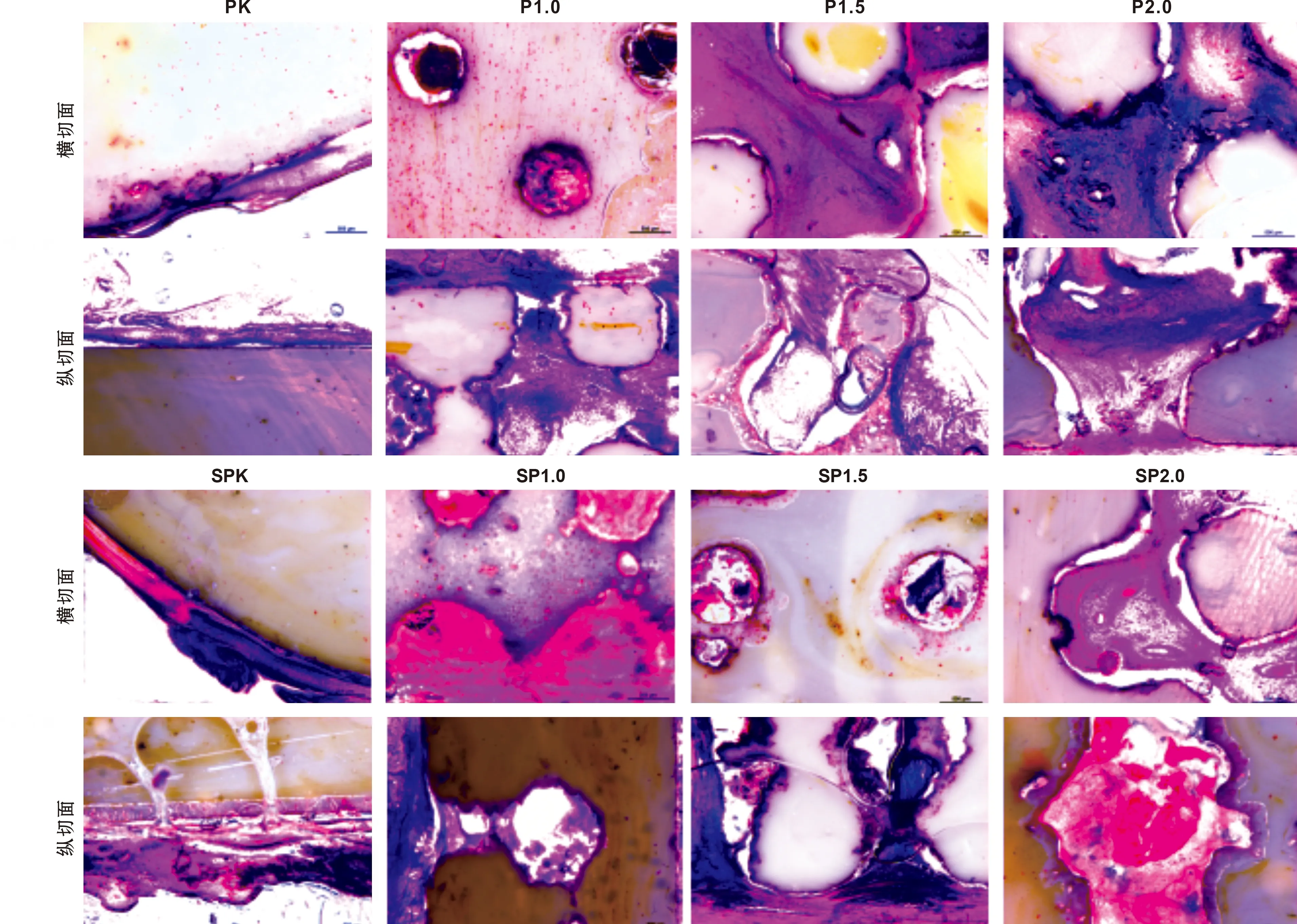
图 6 PEEK移植后4 周组织学观察 (HE, ×40)
3 讨 论
现有研究主要通过材料共混、表面改性等方式[4]解决PEEK和软组织结合能力差的问题。但材料共混比例不同混合后PEEK复合材料的机械性能也不同[5]。且表面涂层在实际应用时涂层和PEEK表面的结合力有限容易剥脱[6]。
因此急需开发一种新的方法来提升PEEK与植入后周围软组织的结合能力。浓硫酸酸蚀可使PEEK表面形成微孔结构,这些微孔增加了PEEK表面的粗糙度,从而提升了其亲水性,为细胞在PEEK上的早期粘附、增殖提供了良好环境[7],本实验结果与此研究一致。规则的、内部交通的管状孔隙网结构为营养物质输送和软组织长入提供了足够的空间[8]。不同于单纯的孔隙结构只能使软组织长入后形成独立的突起,这种相互交通的管状孔隙网结构使长入内部的软组织之间形成了交联,整体与PEEK形成了较强的结合。现有PEEK的3D打印技术——FDM和SLS[9]包括CAD/CAM在内对于精细内部结构的PEEK的加工仍存在困难[10]。因此本课题建立了间接制作法,3D打印出树脂代型,再用热压铸制作PEEK试件。这样的技术结合弥补了直接3D打印具有精细内部结构的PEEK的技术复杂和精度不稳定的缺点,同时成本更低,更适合在临床中推广。实验结果表明,软组织不同程度长入了PEEK内部的管状孔隙网结构中,而且随着管状孔隙网孔径的增大,长入 PEEK 内部的软组织越多。而长入的软组织越多,PEEK和软组织之间的结合也就越紧密。
综上所述,数字化设计、3D打印与热压铸相结合的制作法所制备的具有酸蚀微孔表面和内部管状孔隙网结构增强了PEEK在动物体内与软组织的结合能力,为临床加工制作PEEK提供了新的思路。
