Runx2缺失对小鼠颞下颌关节髁突软骨细胞肥大分化以及生物力学性能的影响
2022-06-16廖立凡李昱杨琳杨欣
廖立凡 李昱 杨琳 杨欣
颞下颌关节(temporomandibular joint, TMJ)为全身最复杂的关节之一。TMJ髁突软骨由表及里分为纤维层、增殖层、成熟层、肥大层和钙化层[1]。软骨细胞是髁突软骨中唯一的细胞类型。研究表明,软骨细胞,尤其是肥大层软骨细胞的一种亚类,可以转化为髁突软骨下骨细胞,而非之前认为的肥大软骨细胞凋亡继之被骨髓细胞浸入[2]。软骨基质主要成分是II型胶原(Col2a)、蛋白多糖(aggrecan),二者由软骨细胞分泌[3]。
Runt相关转录因子-2(runt-related transcription factor-2,Runx2)是Runt转录因子家族成员。在成骨细胞分化过程中起着至关重要的作用[4-5]。研究表明,Runx2在软骨细胞肥大和骨关节炎(osteoarthritis, OA)的发展中也起重要作用[6-7]。然而,有关Runx2对出生后髁突软骨成熟分化和生物力学的作用尚不清楚。因此,本研究创建了Runx2Agc1CreER小鼠模型,研究Runx2软骨细胞特异性删除对出生后小鼠TMJ髁突软骨细胞的肥大分化过程以及对其生物力学性能的影响。
1 材料与方法
1.1 动物
中科院深圳先进技术研究院提供Agc1-CreER和Runx2f/f小鼠,培育Agc1-CreER,ROSAmT/mG小鼠和Agc1-CreER,Runx2flox/flox(Runx2Agc1CreER,实验组)条件性敲除小鼠。在小鼠5 周龄时进行他莫昔芬腹腔注射(SigmaT5648, 上海,1 mg/10 g·d,持续5 d),并在小鼠9 周龄或13 周龄时取材进行组织学分析。Cre阴性同窝小鼠(Cre-)作为对照组。每组各13 只小鼠。
1.2 Cre重组效率
为了确认Agc1-CreER小鼠可以有效靶向成年小鼠髁突软骨细胞,将Agc1-CreER转基因小鼠与ROSAmT/mG报告基因小鼠进行繁殖。在小鼠5 周龄时腹腔注射他莫昔芬,在小鼠9 周龄时取材并制作冰冻切片,使用荧光显微镜观察冰冻组织切片。
1.3 组织学观察
收集Runx2Agc1CreER小鼠及其对应的Cre-小鼠的TMJ。将TMJ进行固定、脱钙、脱水、包埋等组织前期处理后,从TMJ髁突的内侧,分为3 个不同的层次(相距50 μm)切下3 μm厚的矢状连续切片,分别用苏木精伊红(HE)和阿尔新蓝/橘红(AB/HO)(AB/HO)方法进行切片染色。
1.4 免疫组化
将组织切片分别用抗Runx2(MBL,货号D130-3,沃本,美国,1∶200)、ColX(Abcam,货号ab58632, 1∶1000稀释度)、IHH(Abcam,货号ab39634, 1∶500)、PCNA(Abcam,货号ab18197, 1∶4000, 英国)一抗工作液进行免疫组化染色, 4 ℃孵育过夜。
1.5 纳米模量检测
取材后将组织保存在含有蛋白酶抑制剂的4 ℃ 1×PBS中来使组织蛋白的降解最小化,然后用纳米压痕检测技术进行检测。纳米压痕检测是用硼硅酸盐胶体球形探头和标尺对关节软骨表面进行检测。最后检测的结果用弹性模量(Eind)来表示, Eind增高说明组织的承力能力增强, Eind降低说明组织的承力能力减弱。
1.6 统计学分析
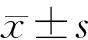
2 结 果
2.1 Agc1-CreER能够高效靶向表达于TMJ髁突软骨细胞
将Agc1-CreER和ROSAmT/mG转基因小鼠进行杂交得到Agc1-CreER,ROSAmT/mG小鼠。在小鼠5 周龄时进行他莫昔芬注射,在小鼠9 周龄和13 周龄时取材进行冰冻切片观察。结果显示,Cre-小鼠的TMJ髁突软骨中只有红色荧光信号,而Agc1-CreER,ROSAmT/mG小鼠的TMJ髁突软骨中有广泛的绿色荧光信号,这提示Agc1-CreER能够高效靶向TMJ髁突软骨细胞(图 1)。此外,Agc1-CreER,ROSAmT/mG小鼠髁突软骨下骨中也出现绿色荧光信号表达。

图 1 Agc1-CreER在髁突软骨细胞中的表达(荧光显微镜, n=3)
2.2 Runx2敲除引起小鼠髁突软骨细胞分化缺陷
HE染色显示,Cre-小鼠的TMJ髁突软骨细胞排列有序,由表及里分为纤维层、增殖层、成熟层、肥大层、钙化软骨层(图 2);而Runx2Agc1CreER小鼠髁突软骨细胞的有序排列被破坏,肥大层几乎完全缺失,增殖层和成熟层细胞密度也显著降低(图 2)。Cre-小鼠TMJ髁突软骨的潮标(非钙化和钙化软骨区的交界线)不明显,而9 周龄和13 周龄Runx2Agc1CreER小鼠TMJ髁突软骨的潮标变得非常明显(图 3,白色箭头)。除此之外,阿尔新蓝/橘红染色结果表明,Runx2Agc1CreER小鼠TMJ髁突软骨中阿尔新蓝的染色强度显著降低(图 3), 表明Runx2Agc1CreER小鼠髁突软骨免疫组化(IHC)染色评估了Runx2在Runx2Agc1CreER小鼠的TMJ髁突软骨中的敲除效率。Cre-小鼠髁突软骨的成熟层和肥大层中可以检测到大量Runx2表达,而Runx2Agc1CreER小鼠的相应区域几乎没有Runx2的阳性表达(图 4A)。Cre-鼠髁突软骨层中ColX蛋白表达丰富,而Runx2Agc1CreER小鼠的相应区域ColX表达显著降低(图 4A)。IHH在Cre-小鼠髁突软骨层中表达丰富,而在Runx2Agc1CreER小鼠该区域表达显著降低。与此一致,Cre-小鼠髁突软骨细胞可大量检测到PCNA表达, 而Runx2Agc1CreER小鼠髁突软骨层细胞中PCNA的表达显著降低(图 4B)。

图 2 Cre-小鼠髁突软骨分层(HE)

图 3 髁突软骨蛋白聚糖表达 (HE-伊红-阿尔新蓝/橘红染色, n=5)

图 4 髁突软骨中相关蛋白表达 (IHC, n=5)
2.3 Runx2敲除引起小鼠髁突软骨弹性模量增高
在小鼠6 周龄时进行他莫昔芬腹腔连续注射5 d,剂量为1 mg/10 g。 在小鼠9 周龄后进行取材,分别对Cre-小鼠和Runx2Agc1CreER小鼠的TMJ髁突进行弹性模量(Eind)检测(n=4)。Cre-组和Runx2Agc1CreER组的Eind(MPa)分别为0.089 8和0.762 0(P<0.05), 表明敲除出生后小鼠软骨中Runx2基因引起小鼠的髁突软骨硬度上升、力学性能增强。
3 讨 论
髁突表面覆盖着软骨层,髁突软骨层可缓冲作用于髁突上方的作用力。软骨组织结构的改变会直接影响其力学承载能力。阿尔新蓝/橘红染色可以将蛋白聚糖或糖胺聚糖染成蓝色或紫色。聚集蛋白聚糖主要位于肥大层和成熟层[8-9]。与此一致,我们发现阿尔新蓝阳性染色细胞主要位于Cre-小鼠的TMJ髁突软骨的肥大层,这表明肥大层软骨细胞是TMJ髁突软骨中产生蛋白聚糖的主要细胞。另外,在Runx2Agc1CreER小鼠中,由于肥大软骨层的丧失,阿尔新蓝阳性染色在钙化软骨层中才能检测到。
软骨细胞过度肥大分化在OA的起始和发展中发挥重要作用[10]。在软骨发育过程中,Runx2控制肥大层软骨细胞的成熟和终末分化,以及软骨内骨形成过程中的钙化和血管浸润[11-12]。此外,Runx2还通过软骨细胞肥大和基质分解影响关节不稳定诱导的OA的发病过程[7,11]。软骨细胞中Runx2的缺失降低了成年小鼠OA进展[6]。在本研究中,条件性敲除小鼠软骨细胞中Runx2的表达抑制了软骨细胞肥大分化,并引起增殖层软骨细胞以及软骨基质产生减少。这表明持续的Runx2表达对于协调和维持出生后小鼠软骨细胞正常分化至关重要。免疫组化结果显示,随着Runx2的敲除,软骨层中与软骨细胞肥大分化相关的ColX、IHH表达均下降[13-16]。
力学性能是软骨功能的直接指标[17-18]。有研究报道,小鼠软骨弹性模量的降低是术后骨关节炎起始和发展的敏感指标[19],随后髁突软骨表面结构和其力学性能的关系也逐渐被重视[20]。本研究的生物力学检测(髁突软骨的弹性模量)发现,Runx2Agc1CreER小鼠的髁突软骨弹性模量高于Cre-小鼠,表明敲除鼠的髁突软骨硬度上升、力学性能增强。这提示,Runx2的减少在一定程度上能够缓解TMJ-OA髁突力学性能的下降。Runx2和ColX是软骨内成骨的重要调控因子及标志物,它们的表达水平反映了TMJ生长和改建的情况[21]。不同作用方式、作用时间的下颌前伸力差异性调节髁突软骨细胞Runx2及ColX的表达水平。与持续性、静止性下颌前伸力相比,间歇性、周期性下颌前伸力显著增加了髁突软骨Runx2及ColX表达水平[21]。而本研究Runx2软骨敲除鼠髁突软骨的Runx2和ColX表达降低,导致了髁突弹性模量增高,承力作用增强。这些结果表明髁突软骨肥大分化和力学性能改变之间存在相互作用。
综上所述,在本研究发现敲除出生后小鼠软骨细胞Runx2导致TMJ髁突肥大软骨层丢失,软骨基质蛋白多糖表达降低,肥大分化相关蛋白表达降低;髁突软骨弹性模量值上升。这表明,持续的Runx2表达能够协调和维持出生后小鼠髁突软骨细胞的正常肥大分化过程,对该过程的干扰会影响髁突软骨细胞的正常分化和有序排列,以及髁突软骨细胞的细胞外基质分泌功能,进而导致髁突力学性能改变。软骨细胞的过度肥大分化是OA进展的重要促进因素,而且关节软骨承力作用的下降也是OA的敏感指标[19]。因此,本研究结果也提示,如果在TMJ OA软骨中减少Runx2的表达有可能会延缓或部分逆转TMJ OA的髁突软骨退变进程。
