射干苷对银屑病小鼠中Th17/Treg平衡的影响
2022-06-15裴文涛
裴文涛, 侯 静
(甘肃中医药大学附属医院,甘肃 兰州 730000)
银屑病是一种常见的慢性炎症性皮肤病,世界发病率约为2%[1],我国约为0.5%[2],临床分型以寻常型为主,约占90%[3],主要特征为白色鳞片覆盖的红斑斑块、皮损、瘙痒[4],病因主要包括遗传、感染、免疫异常、内分泌因素[5]。本病属于慢性复发性疾病,需长期治疗,相关药物包括甲氨蝶呤、环孢素A、阿维A、生物制剂、类固醇等[6],但均存在显著的骨髓抑制、肝功能异常、代谢紊乱等严重不良反应,从而限制了其临床应用[5]。因此,挖掘不良反应较少的新型药物对于银屑病的治疗意义深远。
Th17/Treg平衡在银屑病的发生发展中具有重要作用,常作为本病治疗靶点[7]。射干麻黄汤可通过下调Th2/Th17细胞,上调CD4+FoxP3+Tregs,改善哮喘气道高反应[8],但对银屑病的治疗作用尚不清楚。射干苷是一种提取自射干的异黄酮类衍生物,具有多种生物活性,对哮喘、扁桃体炎、其他炎症性疾病均具有较好疗效[9],表现出显著的抗炎和抗氧化活性[10-12],本研究将对该成分干预银屑病的药效和分子机制进行探索,以期为挖掘相关有效药物提供依据。
1 材料
1.1 动物 50只SPF级雄性C57BL/6小鼠,6~8周龄,体质量(180±10)g,购自兰州大学实验动物中心,实验动物生产许可证号SCXK(甘)2018-0002,饲养于SPF及环境,温度控制在25 ℃,昼夜周期12 h/12 h,自由饮食饮水,适应性饲养1周后开始实验。
1.2 试剂与药物 5%咪喹莫特乳膏(珠海联邦制药股份有限公司,批号8020750);甲氨蝶呤(上海上药信谊药厂有限公司,批号036170804)。射干苷对照品(纯度≥98%,上海源叶生物科技有限公司,批号B21608)。HE染色试剂盒、RIPA裂解液、5×上样缓冲液、SDS-PAGE凝胶制备试剂盒、BCA蛋白定量试剂盒(北京索莱宝科技有限公司,批号分别为G1120、R0010、P1040、P1200、PC0020);小鼠Th17/Treg检测试剂盒(美国BD公司,批号560767);小鼠TNF-α、IL-6、IL-10 ELISA检测试剂盒(上海酶联生物科技有限公司,批号ml002095、ml063159、ml037873);SP免疫组化试剂盒(北京中杉金桥生物技术有限公司,批号SP9001);RNAiso plus、Mir-X miRNA qRT-PCR TB Green® Kit、逆转录试剂盒、实时荧光定量PCR试剂盒(日本TaKaRa公司,批号分别为9108、638314、RR047A、RR420Q);JAK2、STAT3、p-JAK2、p-STAT3、Bcl-2抗体、HRP标记的山羊抗兔IgG、HRP标记的山羊抗鼠IgG(英国Abcam公司,批号分别为ab158096、ab235946、ab32101、ab76315、ab194583、ab7090、ab97040);鼠抗Bax多克隆抗体(杭州华安生物技术有限公司,批号ER0907)。
2 方法
2.1 分组与造模 50只小鼠随机分为正常组、模型组、甲氨蝶呤组及低、高剂量射干苷组,每组10只,脱去2 cm×2 cm背部毛,正常组于脱毛处涂抹凡士林,其余各组涂抹咪喹莫特乳膏,每次10 mg,每天2次,连续14 d。
2.2 给药方法 造模成功后,甲氨蝶呤组小鼠灌胃2.5 mg/kg甲氨蝶呤,高、低剂量射干苷组小鼠分别灌胃10、2.5 mg/kg射干苷,正常组、模型组小鼠均灌胃等容量生理盐水,连续30 d。
2.3 皮损程度评估 参考文献[13]报道,于造模第0、3、7、10、14天及干预第0、5、10、15、20、25、30天对小鼠红斑、鳞屑、浸润增厚程度(红斑向周围浸润,皮肤增厚)进行评分,三者总和即为小鼠皮损严重程度评分,标准见表1。

表1 皮损程度评分标准
2.4 样本收集 小鼠皮下注射2.5%戊巴比妥钠进行麻醉,心脏取血,每组取5只小鼠血液,采用EDTA抗凝管收集,用于外周血Th17、Treg细胞比例的检测;另取5只小鼠血液,采用普通采血管收集,离心后得血清,用于TNF-α、IL-6、IL-10水平的检测。采血完成后,颈椎脱臼处死小鼠,取下皮损区皮肤,分成若干等份,一份置于4%多聚甲醛进行固定,其余液氮中速冻后转入-80 ℃冰箱中保存。
2.5 HE染色观察皮肤组织病理变化 取4%多聚甲醛固定的小鼠皮肤组织,石蜡包埋、切片,依次进行二甲苯脱蜡、梯度乙醇水化,苏木素染色5 min,水洗10 min,1%盐酸乙醇分化30 s,水洗30 s,伊红染色2 min,水洗后梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察。
2.6 免疫组化法检测皮肤组织中Bax、Bcl-2和Ki67蛋白表达 取“2.5”项下小鼠皮肤组织切片,脱蜡水化后微波-酸修复抗原,随后H2O2阻断内源性过氧化物酶,山羊血清封闭,一抗4 ℃孵育过夜,生物素标记的二抗室温孵育2 h,HRP标记的链霉素37 ℃孵育30 min,DAB显色,苏木素染色,盐酸乙醇分化,梯度乙醇脱水,二甲苯透明,中性树胶封片,在显微镜下观察。
2.7 ELISA法检测血清TNF-α、IL-6、IL-10水平 从-80 ℃冰箱中取出小鼠血清,室温融化后按照ELISA试剂盒说明书检测TNF-α、IL-6、IL-10水平。
2.8 流式细胞术检测外周血中Th17/Treg细胞比例 取“2.4”项下小鼠全血,加入红细胞裂解液,按照小鼠Th17/Treg检测试剂盒说明书检测Th17/Treg细胞比例。
2.9 RT-qPCR法检测皮肤组织中miRNA-204-5p、JAK2、STAT3 mRNA表达 取“2.4”项下保存于-80 ℃的小鼠皮肤组织,加入液氮,置于研钵中充分研碎,采用Trizol法提取总RNA,其中JAK2、STAT3 mRNA表达的检测按照常规操作进行,总RNA经逆转录后,所得cDNA按照荧光定量PCR试剂盒说明书进行荧光定量PCR反应;miRNA-204-5p的检测按照加尾法进行,2-ΔΔCT法计算目的基因相对表达。引物序列见表2。

表2 引物序列
2.10 Western blot法检测皮肤组织中Bax、Bcl-2、JAK2、p-JAK2、STAT3、p-STAT3蛋白表达 取“2.9”项下研碎的小鼠皮肤组织,加入RIPA裂解液(含1 mmol/L PMSF),转移至匀浆器中,继续在冰上充分研磨裂解20 min,转移至EP管中,10 000×g离心15 min,取上清,即得总蛋白,取20 μL蛋白样本用于BCA试剂盒检测蛋白浓度,其余样本加入5×上样缓冲液,煮沸5 min变性,SDS-PAGE凝胶电泳分离蛋白,转膜,封闭,孵育一抗、二抗,ECL发光液显影,自动曝光仪曝光,采集图片,分析灰度值。
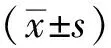
3 结果
3.1 造模及射干苷干预对银屑病小鼠皮损程度的影响 如图1A所示,随着造模天数的增加,正常组小鼠皮损程度无明显变化,均处于正常水平;模型组小鼠皮损程度逐渐增加,至造模结束后皮肤损伤均已达到相关要求。如图1B所示,随着干预时间延长,正常组小鼠皮损程度无明显变化,均处于正常水平;模型组小鼠皮损程度逐渐有略微恢复趋势,但直至干预结束均处于高损伤状态;低、高剂量射干苷组及甲氨蝶呤组均可对银屑病模型小鼠皮损有治疗作用,皮肤损伤逐渐恢复,治疗效果依次为甲氨蝶呤>高剂量射干苷>低剂量射干苷。
3.2 射干苷改善银屑病小鼠皮肤病理损伤 如图2所示,正常组小鼠皮肤结构完整,表皮未见角化过度和角化不全,表皮颗粒层清晰,真皮周围无炎性细胞浸润;与正常组比较,模型组小鼠表皮层不同程度角化过度,棘层肥厚,真皮层内血管扩张充血、新生血管增多、水肿伴炎性细胞浸润;射干苷干预后,银屑病小鼠皮肤组织过度角化或角化不足被校正,角质层破损程度减轻,棘层增厚被缓解,真皮内新生血管和浸润的炎症细胞数量减少,炎症反应缓解,并呈剂量依赖性;高剂量射干苷组与甲氨蝶呤组的效果几乎一致。
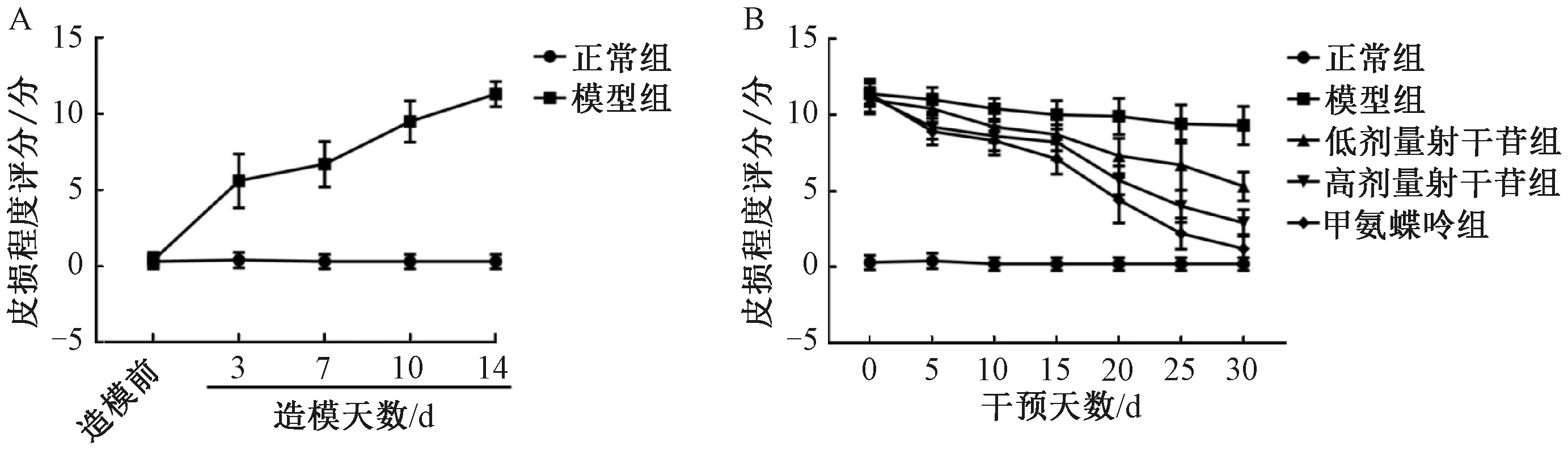
图1 造模及射干苷干预对银屑病小鼠皮损程度评分的影响Fig.1 Effects of modeling and tectoridin intervention on the scores of skin lesions in mice with psoriasis

图2 射干苷对银屑病小鼠皮肤病理损伤的影响(×200)Fig.2 Effects of tectoridin on skin pathological injury in mice with psoriasis(×200)
注:A为Bax、Bcl-2、Ki67蛋白免疫组化染色图(×200),B~D分别为Bax、Bcl-2、Ki67蛋白免疫组化灰度值半定量分析。与正常组比较,**P<0.01;与模型组比较,##P<0.01。图3 射干苷对银屑病小鼠皮损区皮肤基底层和棘层细胞增殖的影响Fig.3 Effects of tectoridin on cell proliferation of basal layer and spinous layer in psoriatic skin lesions of
3.3 射干苷对银屑病小鼠皮损区皮肤基底层和棘层细胞增殖的影响 如图3所示,与正常组比较,模型组小鼠皮损区表皮层细胞Bax表达降低(P<0.01),Bcl-2、Ki67表达升高(P<0.01);与模型组比较,甲氨蝶呤组和各剂量射干苷组小鼠皮损区表皮层细胞Bax表达升高(P<0.01),Bcl-2、Ki67表达降低(P<0.01),并呈剂量依赖性。
3.4 射干苷减轻银屑病小鼠炎症反应
3.4.1 血清TNF-α、IL-6、IL-17A水平 如图4所示,与正常组比较,模型组小鼠血清TNF-α、IL-6、IL-17A水平均升高(P<0.01);与模型组比较,甲氨蝶呤组、各剂量射干苷组小鼠血清TNF-α、IL-6、IL-17A水平均降低(P<0.01),并呈剂量依赖性。

注:与正常组比较,**P<0.01;与模型组比较,##P<0.01。图4 射干苷对银屑病小鼠血清TNF-α、IL-6、IL-17A水平的影响Fig.4 Effects of tectoridin on serum TNF-α, IL-6 and IL-17A levels in mice with

注:A为流式检测结果图,B~D分别为Treg、Th17、Th17/Treg细胞比例统计图。与正常组比较,**P<0.01;与模型组比较,##P<0.01。图5 射干苷对银屑病小鼠外周血Th17/Treg比例的影响Fig.5 Effects of tectoridin on ratios of Th17/Treg in peripheral blood of mice with psoriasis
3.4.2 外周血Th17/Treg比例 如图5所示,与正常组比较,模型组小鼠外周血Th17细胞及Th17/Treg比例升高(P<0.01),Treg细胞比例降低(P<0.01);与模型组比较,甲氨蝶呤组、各剂量射干苷组小鼠外周血Th17细胞及Th17/Treg比例降低(P<0.01),Treg细胞比例升高(P<0.01),并呈剂量依赖性。
3.5 射干苷促进银屑病小鼠皮肤组织中miRNA-204-5p表达并抑制JAK2/STAT3信号通路的激活
3.5.1miRNA-204-5p、JAK2、STAT3 mRNA表达
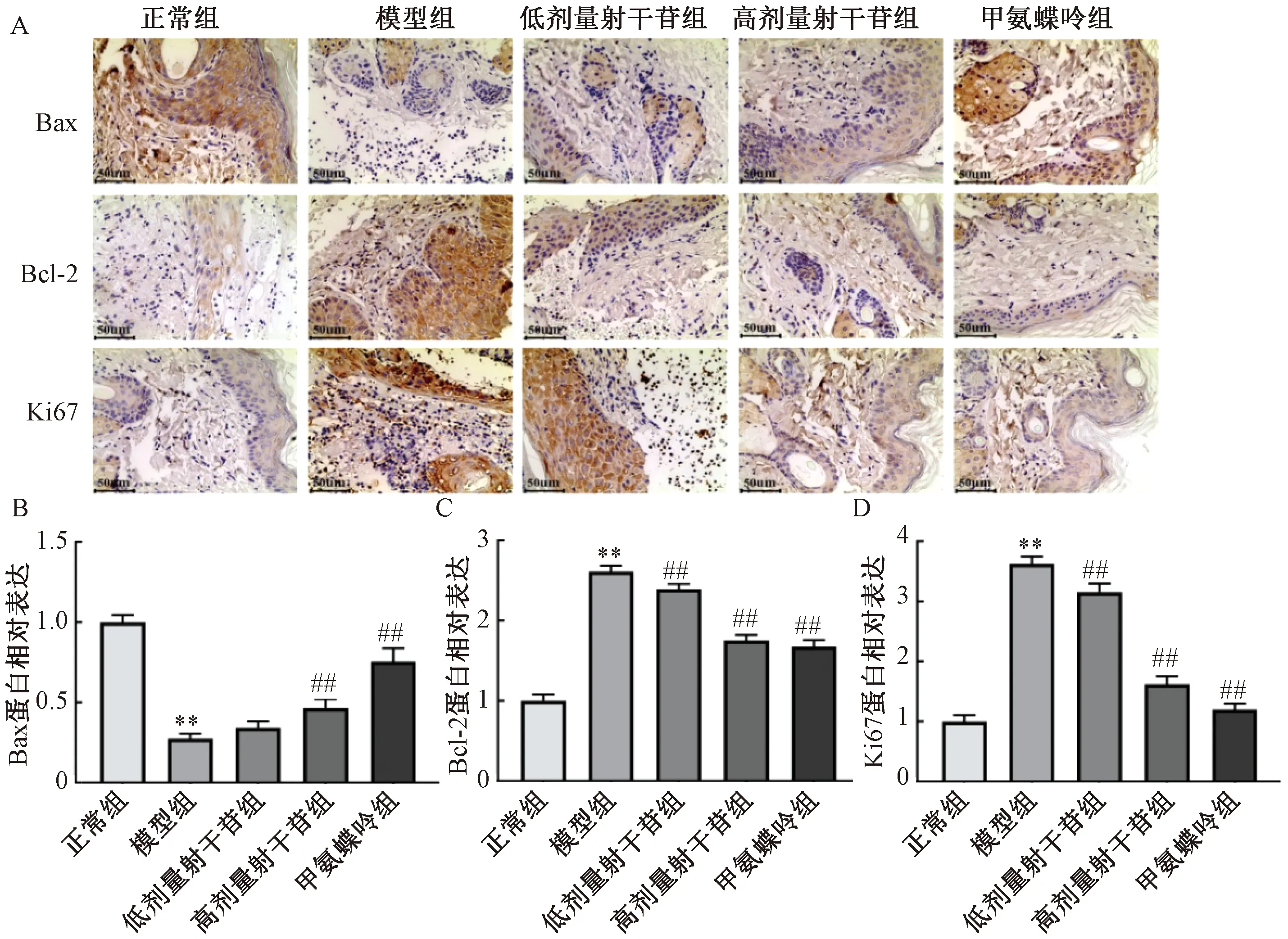
如图6所示,与正常组比较,模型组小鼠皮肤组织中miRNA-204-5p表达降低(P<0.01),JAK2、STAT3 mRNA表达升高(P<0.01);与模型组比较,甲氨蝶呤组、各剂量射干苷组小鼠皮肤组织中miRNA-204-5p表达升高(P<0.01),JAK2、STAT3 mRNA表达降低(P<0.01),并呈剂量依赖性。
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01。图6 射干苷对银屑病小鼠皮肤组织中miRNA-204-5p、JAK2、STAT3 mRNA表达的影响Fig.6 Effects of tectoridin on mRNA expressions of miRNA-204-5p,JAK2 and STAT3 in skin tissues of mice with psoriasis
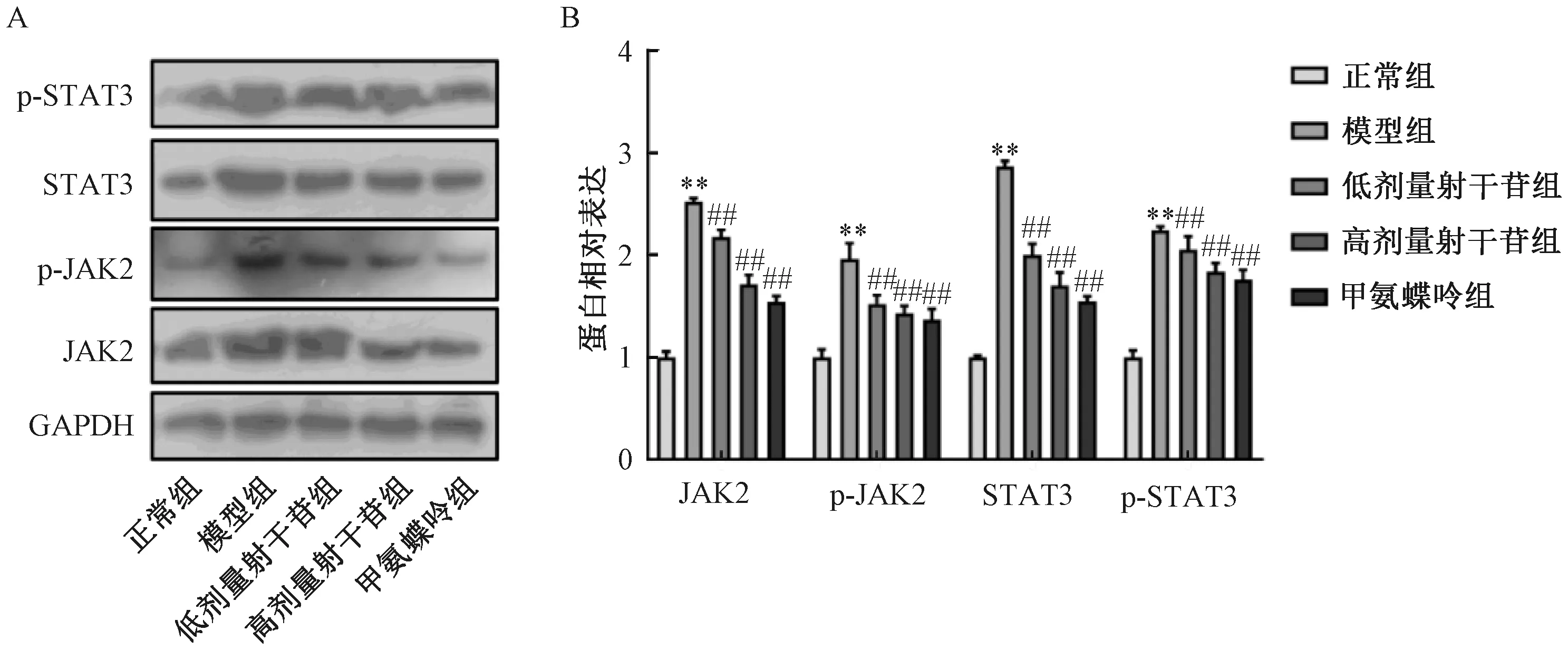
注:A为蛋白条带图,B为蛋白相对表达统计图。与正常组比较,**P<0.01;与模型组比较,##P<0.01。图7 射干苷对银屑病小鼠皮肤组织中JAK2/STAT3通路蛋白表达的影响Fig.7 Effects of tectoridin on protein expressions of JAK2/STAT3 pathway in skin tissues of mice with psoriasis
3.5.2 JAK2/STAT3通路蛋白表达 如图7所示,与正常组比较,模型组小鼠皮损区皮肤组织中JAK2、p-JAK2、STAT3、p-STAT3蛋白表达升高(P<0.01);与模型组比较,甲氨蝶呤组、各剂量射干苷组小鼠皮损区皮肤组织中JAK2、p-JAK2、STAT3、p-STAT3蛋白表达降低(P<0.01),并呈剂量依赖性。
4 讨论
本研究发现射干苷可改善银屑病小鼠的皮损区皮肤损伤症状,抑制皮损区炎症,校正紊乱的皮肤结构;可抑制银屑病小鼠皮损区生发层细胞中Ki67及Bcl-2蛋白的高表达,提高Bax蛋白的低表达。Ki67是一种增殖细胞的相关抗原,可作为细胞增殖的标志物,已有研究发现在银屑病皮损区角质层细胞和生发层细胞中Ki67异常高表达[14-15],可作为银屑病表皮细胞增殖的标志物。Bcl-2/Bax比例变化直接影响线粒体膜的通透性,进而决定细胞的凋亡,Bcl-2/Bax比例降低,通透性升高,促进凋亡[16-17]。本研究结果提示射干苷可抑制生发层细胞异常增殖,改善生发层细胞增殖与凋亡之间的平衡,使细胞增殖回归正常,进而改善银屑病。
目前,研究发现在银屑病中,角质形成细胞的增殖异常与其所处免疫微环境中免疫异常密切相关[18],TNF-α、IL-6、IL-17A异常高表达,可激活角质形成细胞中与增殖、分化、凋亡以及炎症反应相关的信号通路[19-22],而这些通路的激活又进一步促进炎症因子的释放以及T淋巴细胞的激活,形成恶性循环,最终导致角质形成细胞增殖异常,形成银屑病[18, 23]。本研究发现射干苷可降低银屑病小鼠血清TNF-α、IL-6、IL-17A水平,改善银屑病小鼠皮损区皮肤免疫微环境。在银屑病皮肤中,IL-17A导致角质形成细胞增殖能力增强,改变其分化[23];IL-6和TNF-α表达的升高诱导T细胞向Th17细胞分化,改变Th17/Treg平衡,进一步促进IL-17A的表达[24]。本研究发现射干苷可降低Th17/Treg比例,抑制银屑病小鼠皮损区炎症反应,对银屑病小鼠具有治疗作用。
JAK2/STAT3信号通路在角质形成细胞中异常激活,促进相关炎症因子的产生,调控T细胞功能分化[25];同时CD4+T细胞向Th17细胞分化过程中,IL-6和IL-21通过激活T细胞中JAK2/STAT3信号通路促进该分化过程[20]。本研究发现射干苷可抑制银屑病小鼠皮损区皮肤组织中JAK2和STAT3的表达,同时抑制二者蛋白的磷酸化水平,通过抑制银屑病中JAK2/STAT3信号通路的异常激活,使炎症反应回归正常。本课题组前期实验通过TargetScan软件发现miRNA-204-5p可靶向JAK2 mRNA的3′-UTR,形成8mer聚合物,诱导JAK2 mRNA翻译中止和降解。本研究结果发现射干苷可促进银屑病小鼠皮损区皮肤组织中miRNA-204-5p表达的上调。
综上所述,射干苷可提高银屑病小鼠皮损区皮肤组织中miRNA-204-5p表达,抑制JAK2/STAT3信号通路的异常活化,减轻炎症反应,进而通过平衡角质形成细胞的增殖与凋亡,改善银屑病小鼠皮肤症状。本研究为射干苷在临床治疗银屑病的应用提供了一定的理论依据。
