鹿红方通过调控自噬流对心肌梗死大鼠心功能障碍的影响
2022-06-15赵丹丹瞿惠燕张晓青
赵丹丹, 瞿惠燕, 杨 涛, 张晓青, 周 华
(上海中医药大学附属曙光医院,上海 201203)
心肌梗死是世界范围内发病率和死亡率最高的心脏疾病之一[1],发病后由于心肌细胞的持续性丧失及适应性的心脏重塑不良,导致心脏功能逐渐恶化,最终可致心力衰竭或死亡[2]。自噬是细胞的一种分解代谢过程,可在营养剥夺、缺氧、生长因子耗竭等应激条件下被激活,其各个阶段的协调平衡对及时清除体内受损的蛋白质及细胞器,维持机体内环境和细胞稳态有着重要作用[3-4]。近年来,越来越多证据表明自噬广泛参与心梗后心室重构的发生发展,并且缺血期间自噬流的受损与心脏的不良重构和持续性的心脏功能障碍密切相关[5-7]。
鹿红方是上海中医药大学附属曙光医院周华教授在“心肾同治”的理论基础上研制而成,具有温肾强心、活血通络的功效,在临床上应用数十年。课题组前期研究表明,鹿红方可以有效改善心梗后心衰患者的左室射血分数与中医证候积分,提高患者生活质量,同时可抑制心肌梗死大鼠的心肌纤维化与心肌肥厚,改善心肌细胞的能量代谢等[8-10]。本研究拟复制心肌梗死大鼠模型,同时结合自噬流抑制剂(氯喹)验证鹿红方的心脏保护作用与自噬的相关性,并初步探讨其可能的作用机制,以期为临床应用提供依据。
1 材料
1.1 动物 健康雄性SPF级Wistar大鼠60只,体质量180~200 g,购于北京维通利华实验动物技术有限公司,实验动物生产许可证号SCXK(京)2016-0006,饲养于上海中医药大学实验动物中心,伦理审查批准号PZSHUTCM200821018。实验按照动物研究指南——体内实验报告指南(ARRIVE)进行。
1.2 药物 鹿红方(组方药材鹿角片15 g、红花9 g、淫羊藿30 g、补骨脂20 g、山萸肉15 g、女贞子30 g、沉香6 g)由上海中医药大学附属曙光医院中药房提供,总提取物的制备方法为取各自处方量10倍量的药材置于不锈钢锅中,加水浸泡1 h,先武火煮沸后再文火煎煮1 h,滤过,滤液备用;药渣按上述方法再煎煮1次,合并滤液,减压浓缩,喷雾干燥,即得,每1 g约含4.08 g生药。氯喹(货号C6628)购自美国Sigma公司。
1.3 试剂 Beclin-1、LC3-Ⅱ、LC3B、P62、GAPDH、HRP标记山羊抗兔IgG抗体(货号3495、2775、12741、5114、5174、7074)均购自美国Cell Signaling Technology公司;LAMP2、P62抗体(货号66301-1-lg、66184-1-Ig)均购自美国proteintech公司;HE染液、Masson染液(货号G1003、G1006)购自武汉赛维尔生物科技有限公司;BCA蛋白定量检测试剂盒、SDS-PAGE凝胶快速制备试剂盒、RIPA裂解缓冲液、蛋白酶和磷酸酶抑制剂、 ECL发光显影液(货号P0012、P0012AC、P0013C、P1045、P0018AS)均购自上海碧云天生物技术有限公司;LDH测定试剂盒(货号A020-2)购自南京建成生物工程研究所;CK-MB检测试剂盒(货号FSEA3390)购自上海复申生物科技有限公司;异氟烷(货号S10010533)购自上海玉研科学有限公司。
1.4 仪器 小动物麻醉机、呼吸机(上海玉研科学仪器有限公司,型号ABS-100、SAR-100);动物用心电图仪(深圳邦健生物医疗设备股份有限公司,型号ECG-101G);全自动样品快速研磨仪(上海净信实业发展有限公司,型号JXFSTPRP-24L);酶标仪(美国Bio-Tek公司,型号Synergy H1);彩色多普勒超声诊断仪(美国GE公司,型号VIVID5),垂直电泳仪(美国Bio-Rad公司,型号165-8004);化学发光成像系统(上海天能科技有限公司,型号4600SF);透射电子显微镜(美国FEI公司,型号Tecnai G2 Spirit BioTWIN)。
2 方法
2.1 建模与分组 60只大鼠随机分为假手术组、模型组、鹿红方组、氯喹组、鹿红方+氯喹组,每组12只。除假手术组外,其余各组大鼠行冠状动脉左前降支(left anterior descending coronary artery, LAD)结扎术,术前禁食12 h,持续性吸入麻醉,仰卧位固定,气管插管连接呼吸机,记录术前Ⅱ导联心电图,剃毛、消毒皮肤后于左胸第3~4肋间靠近胸骨处剪开皮肤,钝性分离肌肉,逐层打开胸腔,去除心包膜,用6~0号带针线在左心耳下方2~3 mm处结扎LAD,结扎成功后可见结扎区室壁心肌立即变白,心电图Ⅱ导联示ST段呈弓背向上抬高。逐层缝合胸腔、肌肉与皮肤,术后每天肌肉注射40万单位的青霉素预防感染,连续3 d。假手术组在LAD处仅穿线不结扎,其余步骤同前。
2.2 给药 造模后第2天给药,按照人与大鼠体表面积法换算给药剂量,氯喹给药方法与剂量参照文献[7,11]报道,鹿红方组大鼠每天灌胃鹿红方浸膏2.76 g/kg,氯喹组大鼠每天腹腔注射氯喹50 mg/kg,鹿红方+氯喹组大鼠每天灌胃鹿红方浸膏2.76 g/kg+腹腔注射氯喹50 mg/kg,假手术组及模型组大鼠灌胃等容量生理盐水,每天给药1次,连续2周。
2.3 超声心动图检测 最后1次给药结束后,超声心动图评估大鼠心脏功能,从短轴视图中获取二维图像,检测左室射血分数(left ventricular ejection fraction, LVEF)、左室短轴缩短率(left ventricular fractional shortening, LVFS)、左室舒张末期内径(left ventricular internal dimension diastole, LVIDd)、左室收缩末期内径(left ventricular internal dimension systole, LVIDs)。
2.4 心肌组织病理学分析 大鼠心肌组织用4%多聚甲醛固定24 h后,石蜡包埋,切片5 μm,常规脱蜡、覆水,进行苏木精-伊红(HE)、马松(Masson)染色来观察其病理损伤及纤维化情况,采用Image J软件分析心肌纤维化的面积。
2.5 心肌损伤标志物检测 大鼠腹主动脉采血结束后室温下静置2 h,4 ℃、3 000 r/min离心15 min,取上清,检测血清乳酸脱氢酶(lactate dehydrogenase, LDH)、肌酸激酶同工酶(creatine kinase isoenzyme, CK-MB)活性。
2.6 透射电镜观察心肌细胞超微结构 取距大鼠左心室梗死边缘2 mm处的心肌,2.5%戊二醛固定至少2 h,然后常规洗涤、固定、包埋,制作超薄切片,醋酸双氧铀+柠檬酸铅双染色,在透射电子显微镜下观察线粒体、自噬体等超微结构。
2.7 Western blot法检测心肌组织自噬蛋白的表达 取大鼠左心室梗死边缘区的心肌组织约50 mg,加入裂解液、磷酸酶和蛋白酶抑制剂,组织研磨机研磨,裂解充分后离心取上清,BCA法检测蛋白浓度。SDS-PAGE凝胶电泳进行蛋白分离,湿转至PVDF膜上,5%的脱脂牛奶封闭2 h,一抗4 ℃孵育过夜,回收一抗,TBST洗膜3次,加入二抗室温孵育2 h,TBST洗膜3次,滴加ECL发光液后置于化学发光成像系统中曝光,采用Image J软件进行定量分析。
2.8 免疫组织化学检测心肌组织自噬蛋白的表达 取大鼠心肌组织石蜡切片,常规脱蜡至水,柠檬酸钠进行抗原修复,PBS缓冲液冲洗,加入5%BSA,37 ℃封闭30 min,滴加一抗,4 ℃孵育过夜,加入二抗37 ℃孵育30 min,DAB显色,终止显色后苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。每张片子随机拍摄3个视野,采用Image-Pro Plus 6.0软件分析积分光密度(integrated optical density, IOD)值,其大小与蛋白表达呈正比。
3 结果
3.1 一般情况 假手术组大鼠没有出现死亡情况,而模型组、鹿红方组、氯喹组、鹿红方+氯喹组大鼠分别有3、2、4、3只大鼠死亡。与假手术组比较,模型组、氯喹组、鹿红方+氯喹组大鼠精神状态较差,活跃度明显减退,进食量减少,体质量增加不明显,后期出现腹水、大便稀溏等症状;鹿红方组大鼠上述情况均明显改善。
3.2 鹿红方对心肌梗死大鼠心功能的影响 与假手术组比较,模型组大鼠LVEF、LVFS降低(P<0.01),LVIDd、LVIDs升高(P<0.05,P<0.01);与模型组比较,鹿红方组大鼠LVEF、LVFS升高(P<0.05,P<0.01),LVIDd、LVIDs降低(P<0.05,P<0.01);与鹿红方组比较,鹿红方+氯喹组大鼠LVEF、LVFS降低(P<0.05,P<0.01),LVIDs升高(P<0.05),LVIDd有升高趋势,但差异无统计学意义(P>0.05),说明鹿红方对心脏的保护作用被氯喹所阻断;与氯喹组比较,鹿红方+氯喹组LVEF、LVFS、LVIDd、LVIDs无明显变化(P>0.05),见图1。

注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与鹿红方组比较,&P<0.05,&&P<0.01。图1 各组大鼠心功能Fig.1 Cardiac functions of rats in each group
3.3 鹿红方对心肌梗死大鼠心肌组织病理形态的影响 假手术组大鼠心肌细胞形态正常,排列整齐,极少量的胶原纤维沉积;与假手术组比较,模型组大鼠心肌细胞变性、坏死,排列紊乱,局部心肌细胞被增生的结缔组织取代,大量的胶原纤维沉积,纤维化面积增加(P<0.01);与模型组比较,鹿红方组大鼠心肌损伤减轻,细胞坏死、肥大改善,纤维化面积减少(P<0.01);与鹿红方组比较,鹿红方+氯喹组大鼠心肌损伤加重,细胞大量水肿、坏死,结缔组织增生和胶原纤维沉积增多,纤维化面积增大(P<0.01);与氯喹组比较,鹿红方+氯喹组大鼠心肌组织的病理表现类似,纤维化面积无明显变化(P>0.05),见图2~4。

注:标尺为100 μm。图2 各组大鼠心肌组织HE染色Fig.2 HE staining of myocardial tissues of rats in each group

注:标尺为1 000 μm/100 μm。图3 各组大鼠心肌组织Masson染色Fig.3 Masson staining of myocardial tissues of rats in each group

注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与鹿红方组比较,&&P<0.01。图4 各组大鼠心肌纤维化面积Fig.4 Myocardial fibrosis areas of rats in each group
3.4 鹿红方对心肌梗死大鼠血清LDH、CK-MB活性的影响 LDH、CK-MB正常情况下位于心肌细胞的细胞质中,心肌受损时会释放入血,常用来评估心肌损伤的严重程度[12]。与假手术组比较,模型组大鼠血清LDH、CK-MB活性升高(P<0.01);与模型组比较,鹿红方组大鼠血清LDH、CK-MB活性降低(P<0.01);与鹿红方组比较,鹿红方+氯喹组大鼠血清LDH、CK-MB活性升高(P<0.01);与氯喹组比较,鹿红方+氯喹组大鼠血清LDH、CK-MB活性无明显变化(P>0.05),见图5。

注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与鹿红方组比较,&&P<0.01。图5 各组大鼠血清LDH、CK-MB活性Fig.5 Activities of serum LDH and CK-MB of rats in each group
3.5 鹿红方对心肌梗死大鼠心肌组织超微结构的影响 假手术组大鼠肌节及肌丝完整、排列规则,线粒体结构清晰,无破坏、肿胀;模型组大鼠心肌组织萎缩、溶解,肌丝断裂,肌节破坏,线粒体部分肿胀、结构破坏,胞质中液泡状的自噬体结构增多;鹿红方组大鼠心肌损伤减轻,肌节、肌丝排列规整,线粒体肿胀缓解,与模型组比较,胞质中的自噬溶酶体数量增多;氯喹组及鹿红方+氯喹组大鼠心肌超微结构与模型组相似,液泡状的自噬体结构增多,见图6。
3.6 鹿红方对心肌梗死大鼠心肌组织中自噬蛋白表达的影响 氯喹是常用的自噬流抑制剂,能够破坏溶酶体的酸性环境,损害溶酶体的功能,同时抑制自噬体与溶酶体的融合,使自噬过程不能完成,故LC3-Ⅱ、P62会积聚。与假手术组比较,模型组大鼠心肌组织中Beclin1、LC3-Ⅱ、P62蛋白表达升高(P<0.05,P<0.01),LAMP2蛋白表达降低(P<0.01),说明心梗后心肌组织存在溶酶体功能受损,自噬流受阻;与模型组比较,鹿红方组大鼠心肌组织中Beclin1、LAMP2、LC3-Ⅱ蛋白表达升高(P<0.05),P62蛋白表达降低(P<0.01),说明鹿红方可以改善溶酶体的功能,促进受损心肌的自噬流;与模型组比较,氯喹组大鼠心肌组织中LAMP2蛋白表达降低(P<0.05),LC3-Ⅱ、P62蛋白表达升高(P<0.01),证实了氯喹可以损害溶酶体的功能,阻碍自噬流的通畅;与鹿红方组比较,鹿红方+氯喹组大鼠心肌组织中LAMP2蛋白表达降低(P<0.01),LC3-Ⅱ、P62蛋白表达升高(P<0.01),说明氯喹消除了鹿红方对自噬的调节作用;与氯喹组比较,鹿红方组+氯喹组大鼠心肌组织中Beclin1蛋白表达升高(P<0.01),P62蛋白表达降低(P<0.05),LAMP2、LC3-Ⅱ蛋白表达无明显变化(P>0.05),见图7。
3.7 鹿红方对心肌梗死大鼠心肌组织中LC3B、P62表达的影响 LC3B、P62蛋白表达呈阳性时,在细胞质及细胞间质中可见棕黄色颗粒。与假手术组比较,模型组大鼠心肌组织中LC3B、P62光密度值升高(P<0.05);与模型组比较,鹿红方组大鼠心肌组织中LC3B光密度值升高(P<0.05),P62光密度值降低(P<0.01),说明鹿红方可增强心肌梗死大鼠心肌的自噬通量;与模型组比较,氯喹组大鼠心肌组织中LC3B、P62光密度值升高(P<0.01);与鹿红方组比较,鹿红方+氯喹组大鼠心肌组织中LC3B、P62光密度值升高(P<0.01);与氯喹组比较,鹿红方+氯喹组大鼠心肌组织中LC3B和P62光密度值无明显变化(P>0.05),见图8~9。
4 讨论
心肌梗死后的数天至数周,心室重构进程启动,并进行性出现容量负荷超载、心肌肥厚、心肌细胞死亡等失代偿改变,最终导致心功能不断恶化[13-14]。临床上,虽然ACEI、ARB及β受体阻滞剂等药物的广泛应用可以一定程度稳定或改善心梗后患者的心功能障碍,但心梗后心衰的预后仍不理想,并且长期应用也会导致耐药性和不良反应增多[15]。目前,越来越多的研究证实中医药治疗心肌梗死疗效确切,且具有毒副作用小的优势,中西医结合论治心肌梗死已成为当下研究的热点与趋势[16]。
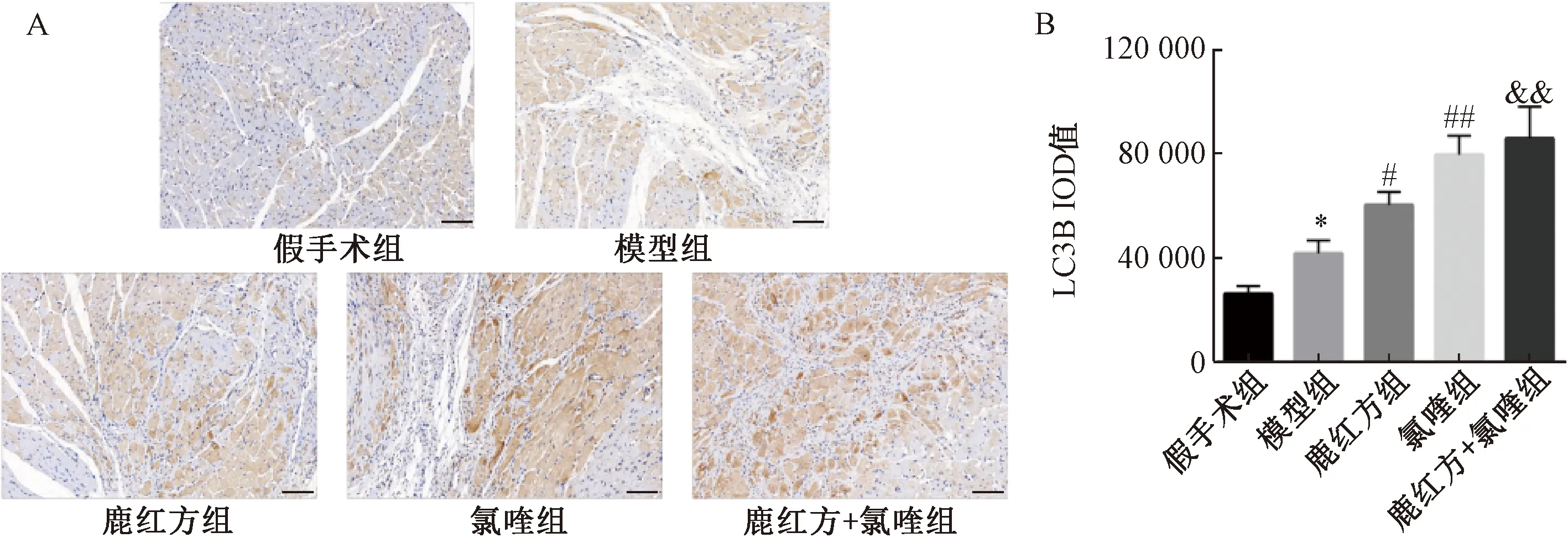
注:A为心肌组织中LC3B免疫组化染色图,B为LC3B光密度值定量分析统计图。标尺为100 μm。与假手术组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01;与鹿红方组比较,&&P<0.01。图8 各组大鼠心肌组织LC3B免疫组化Fig.8 LC3B immunohistochemistry in myocardial tissues of rats in each group

注:A为心肌组织中P62免疫组化染色图,B为P62光密度值定量分析统计图。标尺为100 μm。与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与鹿红方组比较,&&P<0.01。图9 各组大鼠心肌组织P62免疫组化Fig.9 P62 immunohistochemistry in myocardial tissues of rats in each group
自噬是机体应对损伤的一个过程,完整的自噬包括自噬前体的形成、自噬体的形成、自噬溶酶体的形成以及自噬溶酶体的降解,这整个发生过程称为“自噬流”[17]。完整、顺畅的自噬过程不仅可以通过三磷酸腺苷循环提供能量,还可以消除受损的蛋白质和细胞器来保护心脏,是心梗后维持正常心脏功能所必需的[18]。有研究表明,在使用海藻糖、雷帕霉素、白藜芦醇等自噬激动剂促进或恢复受损心肌的自噬流后,限制了心肌缺血时的损伤,减少了慢性缺血重构;而在抑制自噬的表达后,加剧了心梗后的缺血损伤及心功能障碍[19-23]。
在自噬调节的标志物中,Beclin1是启动自噬的关键因子,是自噬小体形成所必须的,其表达量的高低与自噬活性呈正相关[24]。LC3-Ⅱ是自噬小体的标志蛋白,其数量的增加既可能是自噬诱导,也可能是低效的溶酶体降解,要结合自噬流这一整体过程进行评估[25]。P62是一种泛素结合蛋白,当自噬溶酶体形成障碍,自噬降解速率降低时可在胞内累积,其水平与自噬流的强弱呈反相关[26]。此外,一个健康、功能良好的溶酶体系统对于自噬流的整个过程也是至关重要的,而LAMP2正是调节溶酶体功能的关键因子,能促进自噬体与溶酶体的融合[27]。本研究结果显示,鹿红方可以改善心梗大鼠的心功能,减少心肌纤维化的面积,减轻心肌组织结构损伤,降低血清LDH、CK-MB活性;同时可以提高心梗大鼠心肌组织中Beclin1、LAMP2、LC3-Ⅱ表达,降低P62表达,增加心梗后心肌组织中自噬小体和自噬溶酶体的形成,促进受损心肌的自噬流,但是在与氯喹合用后,鹿红方的上述调节作用均被阻断,提示鹿红方至少部分通过促进心肌细胞的自噬流来改善心梗后的心肌损伤和心功能障碍。
综上所述,鹿红方可以通过调节Beclin1/LAMP2介导的途径,提高自噬小体的形成和促进自噬流的通畅来减轻心肌梗死后的心脏功能障碍,发挥心脏保护作用。然而,调控Beclin1/LAMP2的上游通路众多,鹿红方是如何上调Beclin1/LAMP2表达的机制尚不明确,这将是本课题组下一步的研究计划。
