胰岛素泵短期强化方案在初诊2 型糖尿病患者中的应用研究
2022-06-15薛建国
薛建国
商河县人民医院肾病内分泌科,山东商河 251600
2 型糖尿病以高血糖为特征的代谢疾病, 随着病情的进展可进一步诱发心脏、神经、血管等相关并发症,严重影响了患者的健康与生活质量[1]。 有研究发现, 胰岛β 细胞分泌受损与胰岛素抵抗是2 型糖尿病发病的重要环节, 其中初诊2 型糖尿病患者多数胰岛β 细胞残存率达50%,功能状态良好,所以改善此类群体的胰岛功能细胞, 对于保障患者预后具有至关重要的作用[2]。 目前,临床治疗2 型糖尿病以外源性胰岛素为主,以期控制疾病进展[1]。 外源性胰岛素用药方式包括胰岛素泵持续给药与胰岛素多次皮下注射两种, 胰岛素泵能够模拟人体胰岛素的生理性分泌规律,自动且持续地输入胰岛素,继而达到显著的控糖目的; 胰岛素多次皮下注射则通过每日定时注射控制高血糖状态[3]。虽然胰岛素泵持续泵入治疗2 型糖尿病的相关研究较多, 但关于胰岛素强化方案在初诊2 型糖尿病患者中的应用方案尚未有统一意见[4]。为了进一完善初诊2 型糖尿病患者的治疗方案, 商河县人民医院于2019 年1 月—2020年12 月对收治的75 例2 型糖尿病患者应用了胰岛素泵短期强化方案, 并与常规皮下多次注射胰岛素患者的应用情况进行比较,现报道如下。
1 资料与方法
1.1 一般资料
150 例研究对象均为商河县人民医院收治的初诊2 型糖尿病患者, 商河县人民医院伦理委员会对于研究内容予以批准。 纳入标准:符合《中国2 型糖尿病防治指南(2017 年版)》[5]中对于2 型糖尿病的诊断标准;初次诊断为2 型糖尿病;未接受过任何降糖药物与胰岛素治疗; 该次研究方案均向患者进行告知同意。 排除标准:合并糖尿病急慢性并发症者;冠心病、高血压病史者;恶性肿瘤者;严重脏器功能障碍者;血液系统疾病者;急慢性感染者;妊娠期或哺乳期女性;精神疾病者。 150 例患者以随机数表法划分为两组,对照组75 例患者中男43 例,女32 例;年龄32~68 岁, 平均 (45.30±5.88) 岁; 体质指数(BMI)18.65~29.02 kg/m2,平均(23.52±1.50)kg/m2。研究组75 例患者中男44 例,女31 例;年龄32~68 岁,平均(45.50±5.43)岁;BMI 18.60~29.05 kg/m2,平均(23.51±1.48)kg/m2。 两组一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组采取常规胰岛素皮下注射治疗, 即餐前15 min 皮下注射门冬胰岛素(国药准字J20150073,规格: 3 mL:300 单位×1 支/盒), 睡前皮下注射甘精胰岛素 (国药准字J20140052, 规格: 3 mL:300 单位),初始用量为0.4~0.6 IU/(kg·d),之后根据患者血糖水平进行调整,持续治疗4 周。
研究组应用胰岛素泵短期强化治疗, 在患者脐部两侧皮下组织留置胰岛素泵, 持续输入生物合成人胰岛素注射液 (国药准字J20171005, 规格:400 IU/10 mL×1 支),治疗2 周后改为皮下注射胰岛素,再治疗2 周后进行效果观察。
1.3 观察指标
(1)比较两组治疗前后血糖、胰岛功能与炎症因子的变化。 ①血糖:糖化血红蛋白、空腹血糖、餐后2 h 血糖。 ②胰岛功能:通过化学发光检测器对空腹胰岛素(FINS)进行检测,以稳态模型计算胰岛β 细胞指数(HOMA-β)与胰岛素抵抗指数(HOMA-IR)。HOMA-β=20×FINS/(空 腹 血 糖-3.5);HOMA-IR=FPG×FINS。③炎症因子:采集患者3 mL 空腹静脉血3 000 r/min 离心10 min,分离后,通过酶联免疫吸附法对于超敏C 反应蛋白(hs-CRP)、 白细胞介素-6(IL-6)与肿瘤坏死因子-α(TNF-α)予以测定。
(2)比较两组不良反应情况,包括皮疹、低血糖、恶心呕吐、头晕头痛等。
1.4 统计方法
采用SPSS 22.0 统计学软件进行数据分析,符合正态分布的计量资料以(±s)表示,组间差异比较采用t检验;计数资料以频数和率(%)表示,组间差异比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 治疗前后两组血糖水平比较
治疗前, 两组各项血糖水平差异无统计学意义(P>0.05);治疗后,研究组糖化血红蛋白、空腹血糖、餐后2 h 血糖较对照组更低,差异有统计学意义(P<0.05)。 见表1。
2.2 治疗前后两组胰岛功能比较
治疗前, 两组各项胰岛功能指标差异无统计学意义(P>0.05);治疗后,研究组HOMA-IR 较对照组低,HOMA-β 较对照组高, 差异有统计学意义(P<0.05)。 见表2。
表2 治疗前后两组患者胰岛功能比较(±s)
?
2.3 治疗前后两组炎症因子比较
治疗前, 两组各项炎症因子结果差异无统计学意义(P>0.05);治疗后,在IL-6、hs-CRP、TNF-α 指标比较中,研究各项炎症因子较对照组低,差异有统计学意义(P<0.05)。 见表3。
2.4 两组不良反应发生率对比
对照组治疗期间发生低血糖2 例, 研究组未见不良反应。研究组不良反应发生率(0.00%)与对照组(2.67%) 对比差异无统计学意义 (χ2=0.507,P=0.477)。
3 讨论
近年来2 型糖尿病群体量日益攀升, 这可能与人们生活方式与饮食习惯的变化有关[6-7]。 2 型尿病初诊患者普遍表现为胰岛素分泌缺失, 降低了胰岛β 细胞功能,且提高了脂肪分解作用,继而导致血糖升高[8]。目前,胰岛素是治疗2 型糖尿病的主要手段,具有降糖与保护胰岛功能的功效, 可作为2 型糖尿病患者的终身替代药物[9]。胰岛素常用的给药途径为皮下注射, 即根据患者的血糖情况选择长效或短效胰岛素皮下注射,合理调整用量,以便维持血糖的水平[10]。 然而,皮下注射胰岛素存在用量不稳定的问题,用量过少或过多均会引起不适,致使整体收效有所欠缺[11]。
胰岛素泵能够模拟人体胰岛分泌,在24 h 内维持血糖与糖化血红蛋白在正常范围内, 更为符合人体生理状态[12]。 有研究发现,初诊2 型糖尿病患者尚未完全丧失胰岛β 细胞功能,此期间采用胰岛素短期强化治疗不仅可以改善血糖水平, 且对其胰岛β细胞具有修复作用[13]。徐建宾等[14]将104 例初诊2 型糖尿病患者分为两组, 对照组行常规皮下注射胰岛素治疗,观察组行胰岛素泵强化治疗,结果发现观察组治疗后餐后2 h 血糖(8.94±0.89)mmol/L、空腹血糖(6.12±0.72)mmol/L 较对照组(9.35±0.97)mmol/L、(6.54±0.76)mmol/L 低。 该文研究结果显示,治疗后研究组糖化血红蛋白(6.65±1.03)%、 空腹血糖(5.67±1.00)mmol/L、餐后2 h 血糖(7.68±1.02)mmol/L 较对照组 (7.82±1.25)%、(6.82±1.02)mmol/L、(8.62±1.27)mmol/L 低(P<0.05)。 上述结果均说明,胰岛素短期强化治疗可以模拟机体胰岛素的分泌规律,较皮下注射更能稳定且有效地控制血糖水平,抑制疾病进展。 HOMA-β 与HOMA-IR 是评价胰岛β 细胞功能与胰岛素抵抗情况的重要指标。学者湛文世等[15]对50 例初诊2 型糖尿病患者应用胰岛素泵强化治疗, 结果发现该组治疗后HOMA-IR (2.82±0.21)较皮下注射胰岛素的对照组(4.35±0.90)低(P<0.05),HOMA-β (85.46±18.26) 较对照组 (64.29±13.29)高(P<0.05)。该文研究与此结果相近,治疗后,研究组HOMA-IR(2.80±0.20)较对照组(4.30±0.52)低(P<0.05),HOMA-β(80.32±14.65)较对照组(64.04±12.74)高(P<0.05)。 可见,胰岛素泵短期强化方案可以在早期抑制高血糖毒性对于胰岛β 细胞的损伤,并提供了正常的生理胰岛素分泌作用, 逆转早期胰岛细胞损伤,保护胰岛功能。
表1 治疗前后两组患者血糖水平比较(±s)
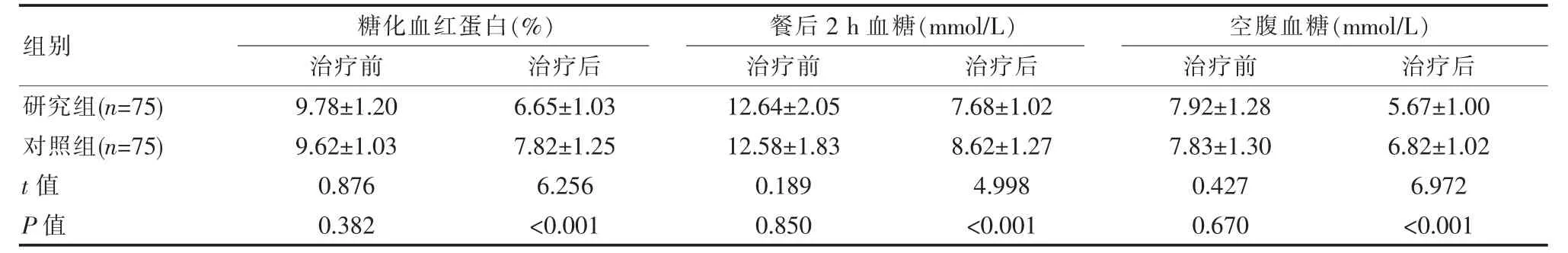
表1 治疗前后两组患者血糖水平比较(±s)
?
表3 治疗前后两组患者炎症因子比较(±s)
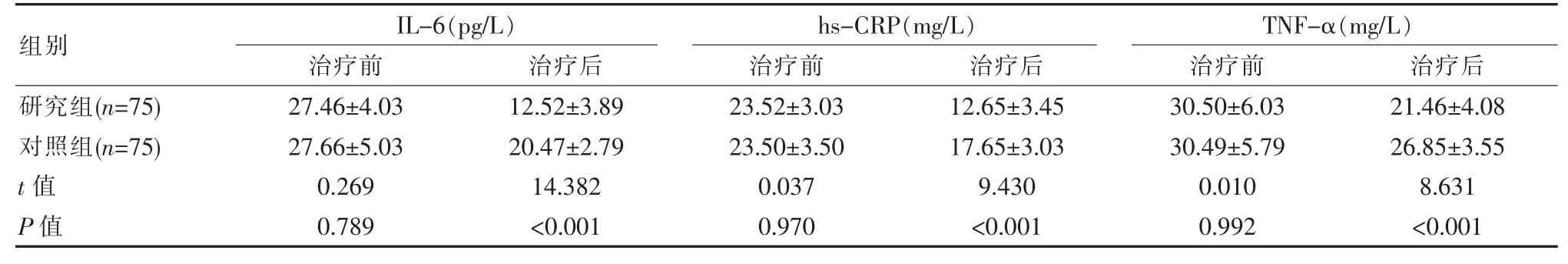
表3 治疗前后两组患者炎症因子比较(±s)
?
近年研究发现,2 型糖尿病患者发病、病情进展与炎症因子介导密切相关[16]。 其中IL-6 是胰岛素抵抗形成中重要组成部分, 能够激活急性反应;hs-CRP 能够加重胰岛素抵抗, 抑制胰岛受体活性;TNF-α 由巨噬细胞分泌,在胰岛素抵抗形成与炎症过程中发挥着重要作促进作用[17]。 陈凯庭等[18]对71例新诊断2 型糖尿病患者应用短期胰岛素泵强化治疗,结果发现患者治疗后IL-6(12.23±3.81)pg/L、hs-CRP(12.37±3.23)mg/L、TNF-α(22.53±5.42)mg/L 较治疗前低(P<0.05)。 该文研究中研究组治疗后指标与上述结果相近,即IL-6(12.52±3.89)pg/L、hs-CRP(12.65±3.45)mg/L、TNF-α(21.46±4.08)mg/L,且该指标显著低于对照组的 (20.47±2.79)pg/L、(17.65±3.03)mg/L、(26.85±3.55)mg/L(P<0.05)。结果说明,短期胰岛素泵强化治疗能效抑制炎性作用, 究其原因可能与胰岛β 细胞恢复与胰岛素抵抗减弱有关。 此外, 研究组不良反应发生率0.00%与对照组2.67%相近(P>0.05)。 可见胰岛素泵短期强化方案并未增加低血糖等并发症的风险,安全性较佳。
综上所述, 胰岛素泵短期强化方案在初诊2 型糖尿病患者中具有显著的应用效果,适于推广。
