铁皮石斛花多糖的复合酶解法提取及生物有效性研究
2022-06-14聂杨根刘艾芬董霞吴荣书
聂杨根,刘艾芬,董霞,吴荣书
(云南农业大学食品科技学院,云南 昆明 650201)
铁皮石斛(Dendrobium candi dum)又名黑节草,在民间也有铁吊兰、铁皮兰之称。铁皮石斛是一种草本植物,为兰科(Orchida ceae)石斛属(Dendrombium),味甘、淡,性属微寒,具有滋阴清热和养胃生津的功效[1]。铁皮石斛可用于热病津伤,胃阴不足,病后虚热不退,阴虚火旺等病症的治疗[2]。其主要的药用成分是石斛多糖,除此之外还含有石斛碱、黄酮和一些微量元素[3-4]。药理学研究发现石斛多具有抗氧化衰老、治疗哮喘、降低血糖和提高免疫力等药理作用[5-6]。早期研究主要集中在铁皮石斛种苗培育、种植技术、茎的药用价值利用方面,近年来研究聚焦在产业化发展、区域竞争力、以及茎、叶的功效成分上[7-9]。铁皮石斛花在民间多干制成花茶饮用,冲泡1次~2次便将其丢弃,利用方式较为单一,资源利用不充分。
铁皮石斛花是很好的药食同源植物,有着非常难得的平调阴阳功效,是当之无愧的滋补极品。铁皮石斛花资源量大,具有重要开发价值,铁皮石斛花含有萜类、脂肪族、芳香族化合物为主的挥发性化合物,同时富含石斛碱[10-11]、黄酮及酚类[12-13]、多糖[14-16]、氨基酸[17]和花色苷[18]等多种有效成分。多糖具有抗肿瘤、抗氧化、调节免疫等药理作用,Zhang等[19]研究表明,铁皮石斛花多糖主要由葡萄糖、甘露糖、半乳糖、半乳糖醛酸和阿拉伯糖5种单糖组成,其中甘露糖组成比例最高,可见铁皮石斛除了茎和叶外,花也有很好的应用价值。
常用的植物多糖提取方法有浸渍法[20]、回流法[21]、超声辅助法[22]、酶解法[23]等,以上方法均已应用于铁皮石斛茎多糖的提取。缪园欣等[24]应用超声波-微波协同法提取铁皮石斛花多糖,而应用酶解法提取铁皮石斛花多糖研究较少。本试验采用复合酶解法提取铁皮石斛花多糖,基于酶的高度专一性,根据石斛花的成分特性,将3种酶解温度、pH值条件较一致的纤维素酶、果胶酶、碱性蛋白酶配合使用,以便找到复合酶解法的最佳提取条件,进而对其生物有效性进行评价。
生物有效性[23]是评价人体摄入的食品在机体中的消化、吸收、运输、利用等情况,生物利用度是生物有效性的重要方面,主要体现营养成分在人体内的吸收利用情况。人体营养评价试验需要几周乃至几个月的时间,基于人体消化系统所建立的消化模型是一种简单、有效地评价人体对食品生物利用度的方法[20]。
本试验采用复合酶解法对铁皮石斛花多糖进行提取,测定铁皮石斛花提取液多糖、黄酮和多酚的生物有效性,以热水浸提法为对照,评价复合酶解法提取工艺的可行性。
1 材料和方法
1.1 材料
铁皮石斛花:市售。
1.2 仪器和试剂
果胶酶(100 000 U/g)、纤维素酶(50 000 U/g)、碱性蛋白酶(200 000 U/g)(均为食品级):北京索莱宝科技有限公司;葡萄糖(食品级):合肥博美有限公司;蒽酮试剂(分析纯):国药集团化学试剂有限公司;福林酚:北京博奥拓达科技有限公司;芦丁(生物试剂):上海源叶生物科技有限公司;没食子酸标品:酷尔化学科技有限公司;无水乙醇(分析纯):天津市大茂化学试剂厂;硝酸铝、氯化钠(分析纯):天津市风船化学试剂科技有限公司;浓硫酸(分析纯):川东化工有限公司;唾液淀粉酶(3 700 U/g)、胃蛋白酶(3 000 U/g~3 500 U/g)、胰蛋白酶(>250 000 U/g)(生物试剂);硫氰酸钾(分析纯):上海国药集团化学试剂有限公司。
JHF-250A高速多功能粉碎机:永康市速锋工贸有限公司;HH-8数显恒温水浴锅:国华电器有限公司;SHZ-D(Ⅲ)循环水式真空泵:合肥矛华仪器有限公司;AX223ZH/E电子天平:奥豪斯仪器(常州)有限公司;SHA-F振荡器:上海笃特科学仪器有限公司;721-100紫外可见分光光度计:杭州微米派科技有限公司;TDL-50B高速离心仪:上海菲恰尔分析仪器有限公司。
1.3 试验方法
1.3.1 铁皮石斛花成分的测定
1.3.1.1 铁皮石斛花多糖含量的测定
参照孙晓玲[21]的蒽酮-硫酸法进行测定。精密量取葡萄糖标准液 0.2、0.4、0.6、0.8、1.0、1.2 mL 置于具塞试管中,加蒸溜水定容至2.0 mL,摇匀,加蒽酮-硫酸溶液(现配现用)定容至8 mL,迅速混合均匀,后沸水浴15 min,取出冰水浴冷却至室温。空白用2.0 mL蒸溜水代替葡萄糖标准液。样品于620 nm波长条件下测定其吸光度A。以葡萄糖浓度X为横坐标,吸光值Y为纵坐标,绘制标准曲线,建立回归方程:Y=15.45X-0.127 9(R2=0.992 8)。标准曲线如图1所示。
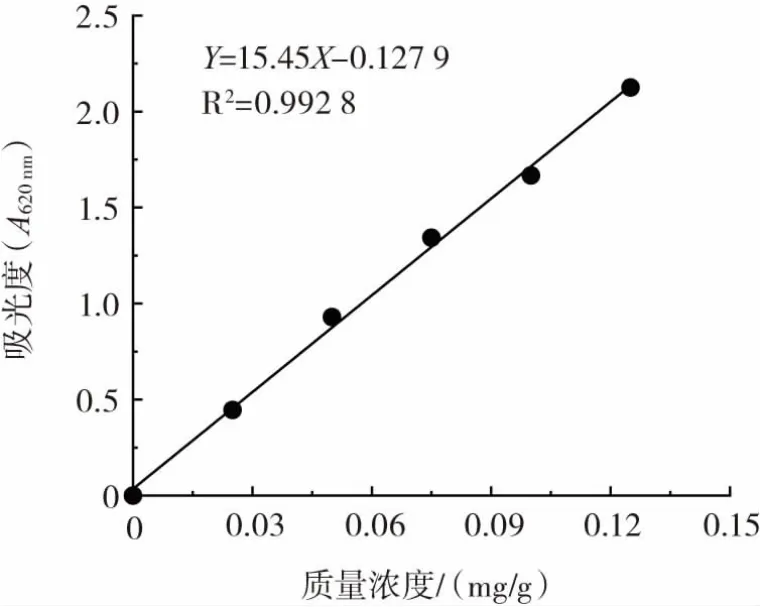
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
1.3.1.2 铁皮石斛花总黄酮含量的测定
参照李金凤等[22]的怀菊花中总黄酮测定方法进行测定。精密取芦丁标准品4mg于10mL容量瓶中,用60%乙醇溶液稀释至刻度,摇匀,即得浓度为0.4 mg/mL的芦丁标准溶液。分别取上述溶液 0、0.5、1、2、2.5、4 mL于10 mL容量瓶中,加60%乙醇溶液定容至4 mL,各加5%亚硝酸钠溶液0.4mL,摇匀,放置反应6min,再各加10%硝酸铝溶液0.4mL,摇匀,放置6min,各加4%氢氧化钠溶液4 mL,用60%乙醇定容至刻度,摇匀,放置15 min,以蒸馏水作空白对照,利用可见分光光度计在510 nm波长处测量吸光度,以浓度X1为横坐标,吸光值Y1为纵坐标,绘制标准曲线,建立回归方程:Y1=9.451 8X1-0.007 4(R2=0.999 6),标准曲线如图2所示。
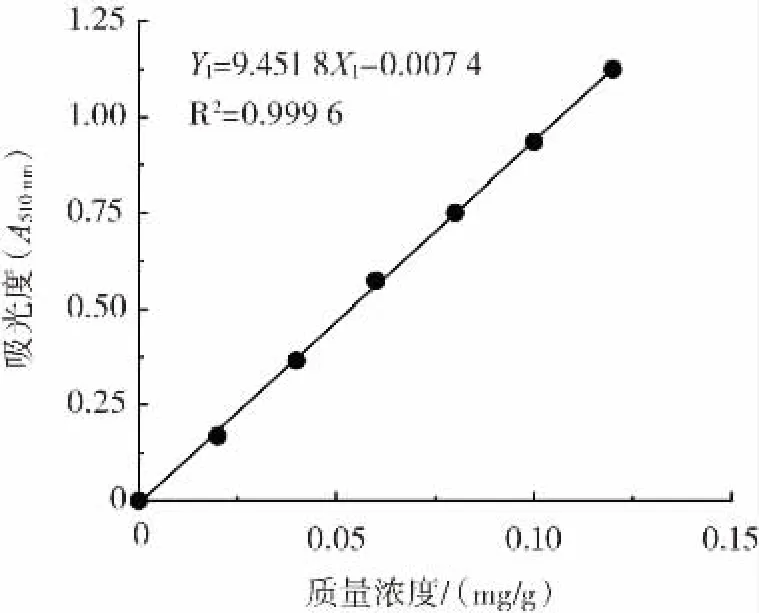
图2 芦丁标准曲线Fig.2 Standard curve of rutin
1.3.1.3 铁皮石斛花总多酚含量的测定
参照阿力同其米克等[25]的金莲花多酚测定方法测定。分别精密量取标准品溶液0.1、0.3、0.5、0.7、0.9 mL于10mL容量瓶中,各加6mL蒸馏水,摇匀,再加0.5mL福林试剂,摇匀。1 min后加入碳酸钠溶液(浓度75 g/L)1.5 mL,混匀,用蒸馏水定容至刻度,水浴75℃反应10 min,在760 nm波长处测定吸光度。建立标准曲线,以浓度X2为横坐标,吸光值Y2为纵坐标,绘制标准曲线,建立回归方程:Y2=12.891X2+0.0021 8(R2=0.998 6)。标准曲线如图3所示。
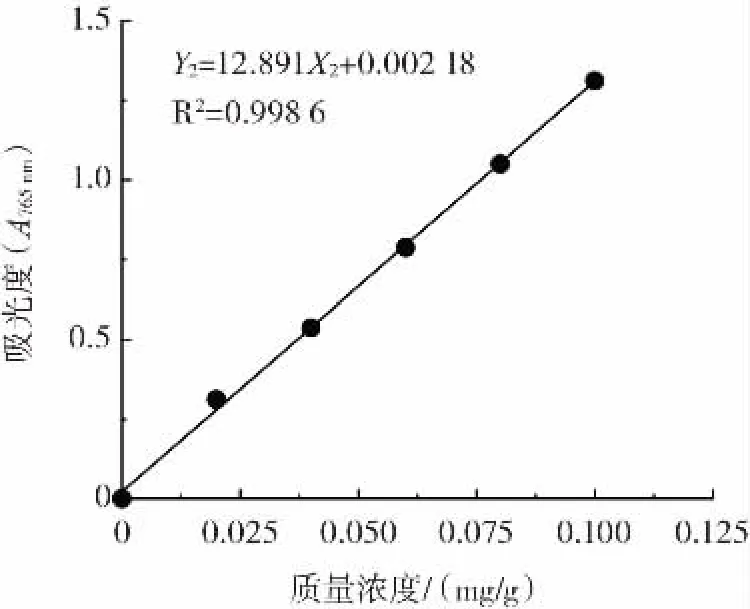
图3 没食子酸标准曲线Fig.3 Standard curve of gallic acid
1.3.2 铁皮石斛花粗多糖提取工艺
1.3.2.1 热水浸提法
以料液比1∶20(g/mL)加入蒸馏水,浸提温度90℃下浸提2 h,制备铁皮石斛花提取液,测定其铁皮石斛花粗多糖含量。
1.3.2.2 单一酶(果胶酶)提取法
以果胶酶添加量 0.4%,料液比 1∶20(g/mL),酶解pH值为4,酶解时间2.0 h,酶解温度40℃,测定其铁皮石斛花粗多糖含量。
1.3.2.3 石斛花粗多糖复合酶解提取工艺
1)工艺流程
石斛花→除杂→打碎过筛(60目)→称量→加定量蒸馏水→搅拌均匀→加酶→水浴→冷却→过滤→收集提取液。
2)酶的筛选
参考郝梅梅[23]的铁皮石斛酶解法提取工艺,采用单因素试验设计考察3种酶对铁皮石斛粗多糖含量的影响,具体见表1。选取最佳酶添加量,酶解温度为55℃,酶解pH值为5,以多糖提取率为指标,通过正交试验确定酶的最佳添加量。

表1 酶添加量单因素水平Table 1 Single factor levels of added enzymes
3)提取工艺研究
在最佳酶添加量的基础上,按表2中单因素试验设计,考察酶解pH值、酶解温度、酶解时间、料液比对粗多糖提取率的影响,通过四因素三水平正交试验确定最佳酶解参数。
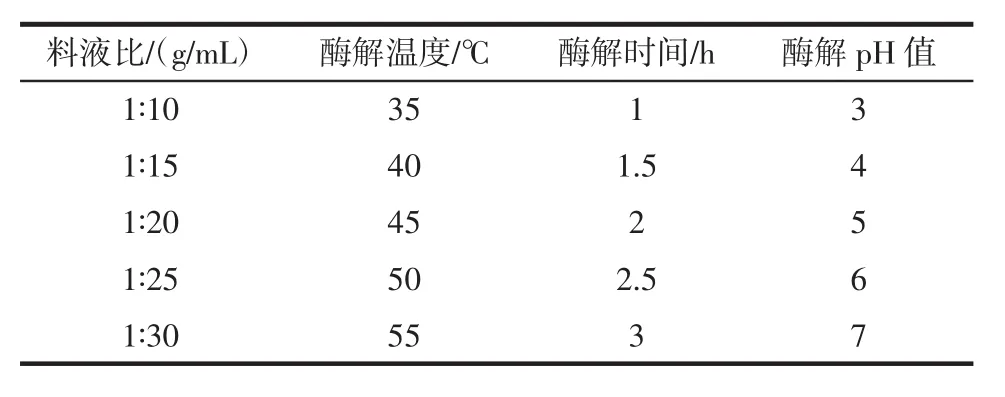
表2 酶解法参数单因素水平Table 2 Single factor levels of enzymatic hydrolysis parameters
1.3.3 铁皮石斛花生物有效性研究
1.3.3.1 建立体外消化模型
本研究主要模拟在口腔、胃和小肠三部分的消化过程,参考 Miller等[26]、Gil-Izquierdo 等[27]、Bednar等[28]的试验方法设定口腔、胃和小肠的消化时间分别为6 min、1.5 h、1.5 h,消化液的 pH 值为 6.5、1.5、7.0,消化液的体积分别为3、5 mL和10 mL。
生物有效性试验路线如下:样品→口腔消化(37℃,6 min)→胃消化(37℃,1.5 h)→肠消化(37℃,1.5 h)→一次离心(22℃,30 min,转速为 10 000 r/min)→二次离心(22℃,30 min,转速为 10 000 r/min)→上清液→生物有效性检测。
1)口腔电解质溶液:用1 L蒸馏水溶解0.9 g KCl、0.2 g KSCN和1.02 g NaH3PO4;体外模拟口腔液:唾液淀粉酶14.5 mg溶于100 mL口腔电解质溶液中,混合均匀,pH值在6.5±0.3左右。
2)胃电解质溶液:用1 L蒸馏水溶解0.15 g CaCl2、0.6 g NaHCO3、3.1 g NaCl和 1.1 g KCl;体外模拟胃液:胃蛋白酶200 mg溶于200 mL胃电解质溶液中,混合均匀,然后用pH值为1.0的HCl调节pH值至1.5。
3)肠电解质溶液:用1 L蒸馏水溶解0.33 g CaCl2、5.4 g NaCl和0.65 g KCl;体外模拟肠液:胰蛋白酶6 g溶于100mL肠电解质溶液中,混合均匀,然后用1mol/L的NaHCO3调节pH值至7.0。
1.3.3.2 模拟体外消化过程
分别取3 mL石斛花提取液样品液加入3 mL模拟口腔液中,37℃条件下保温振荡6 min,模拟口腔的消化过程;结束后使用盐酸溶液将pH值调至1.5,加入模拟胃液5 mL,37℃条件下保温振荡1.5 h,模拟胃的消化过程;后加入NaOH溶液调pH值至7.0,加入模拟肠液10 mL,37℃条件下保温振荡1.5 h,模拟肠道的消化过程。将消化液在5 000 r/min条件下离心30 min,得上清液,弃渣。取上清液到离心管中重复离心1次,去渣取上清液,测定其生物利用度。通过对提取液消化前后主要营养成分的生物利用度,初步研究了提取液的生物有效性,生物利用度计算公式如下。

1.3.4 数据处理
采用 origin 2019 64 Bit、SPSS 25.0 、Design Expert 8.0.6.1软件对试验数据进行分析处理。
2 结果与分析
2.1 石斛花多糖复合酶解法提取工艺研究
2.1.1 复合酶添加量的筛选
2.1.1.1 复合酶添加量单因素试验
固定酶解温度40℃,酶解时间2 h,酶解pH值,在料液比1∶15(g/mL)的条件下,观察3种酶的添加量对石斛花粗多糖含量的影响,结果如图4所示。
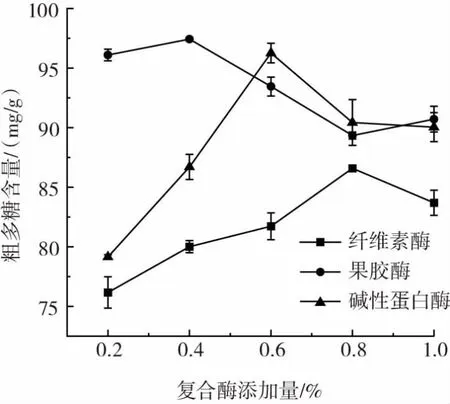
图4 复合酶添加量对粗多糖含量的影响Fig.4 Effect of the amount of enzymes on content of crude polysaccharides
如图4所示,当纤维素酶添加量增加时,石斛花粗多糖含量也先增加后降低,在添加量为0.8%时达到最大值;当果胶酶添加量增加时,石斛花粗多糖含量整体上呈现先增加再减少的趋势,在添加量为0.4%时达到最大值;当碱性蛋白酶添加量增加时,石斛花粗多糖含量也随之增加,在添加量为0.6%时达到最大值。由此说明,在一定程度上,增加酶的添加量可有助于提升粗多糖的含量,但当酶添加量达到饱和时,继续加大酶添加量反而减少石斛花粗多糖的含量。由图4可知,纤维素酶最佳添加量为0.8%,果胶酶最佳添加量0.4%,碱性蛋白酶最佳添加量0.6%。以此3种因素进行正交试验。正交试验因素水平如表3所示。
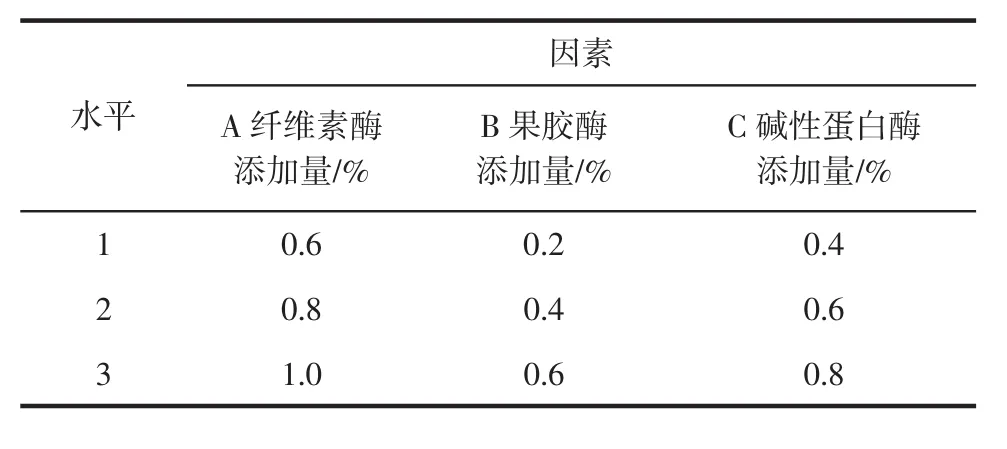
表3 酶筛选正交试验因素水平Table 3 Orthogonal experimental factors for enzyme screening
2.1.1.2 复合酶添加量正交试验
固定酶解温度40℃,酶解时间2 h,酶解pH值,在料液比1∶15(g/mL)的条件下,以粗多糖含量为评价指标,通过L9(33)正交试验对复合酶添加量进行优化,正交试验结果如表4所示。
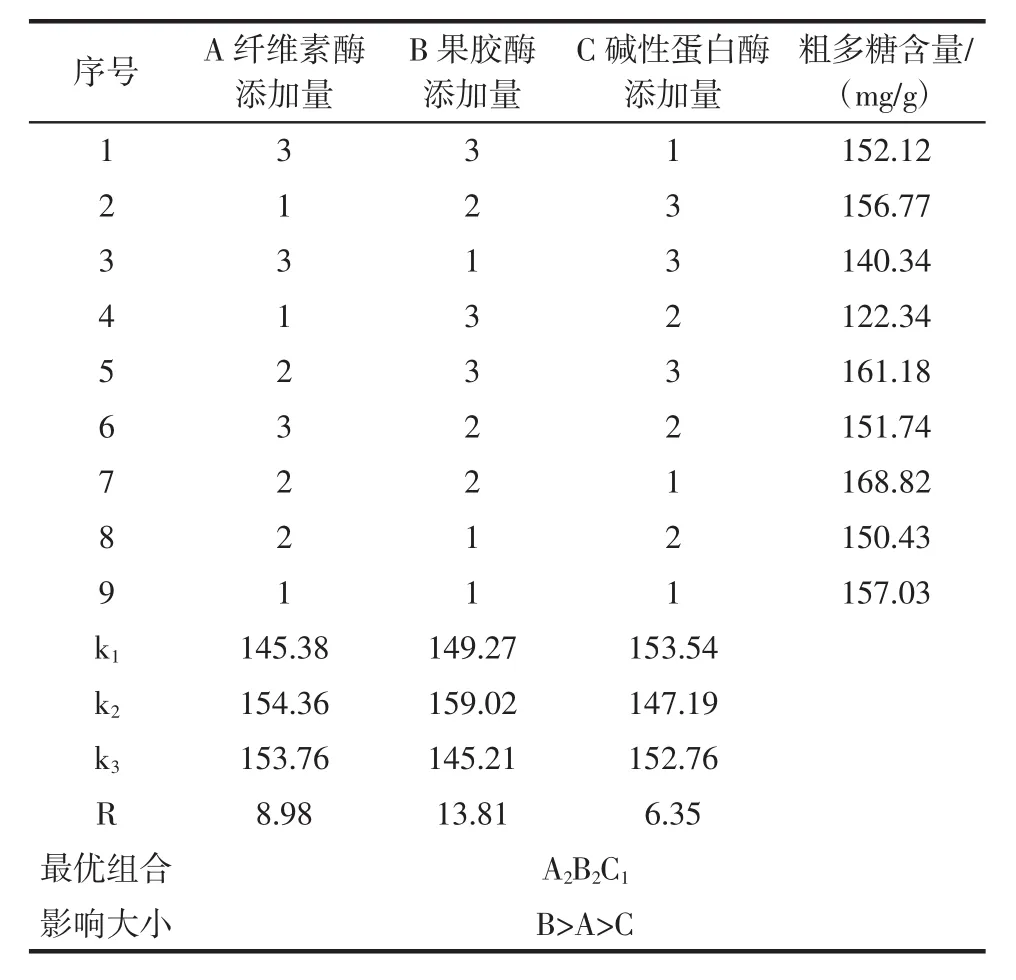
表4 酶的筛选正交试验结果与分析Table 4 Results and analysis of orthogonal experiment for enzyme screening
由表4可知,通过比较各因素的极差值R可以看出,酶添加量对多糖含量的影响依次为果胶酶添加量>纤维素酶添加量>碱性蛋白酶添加量,依据极差分析结果,得最佳配比为A2B2C1,即纤维素酶添加量为0.8%,果胶酶添加量为0.4%,碱性蛋白酶添加量为0.4%。此优化结果与第7组正交结果相吻合。
2.1.2 料液比对粗多糖提取的影响
在最佳复合酶添加量的基础上,将提取温度固定为40℃、酶解pH值为5、提取时间为2 h,对比不同料液比对粗多糖含量的影响,如图5所示。
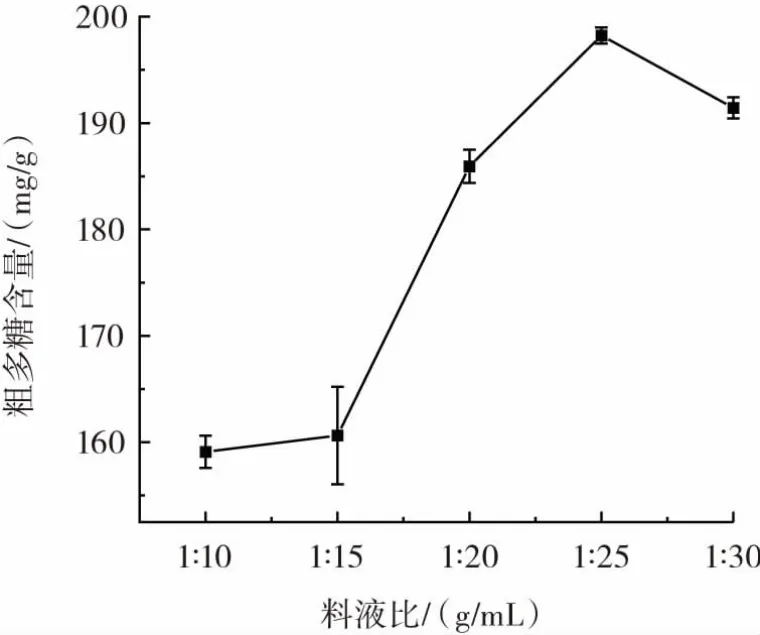
图5 料液比对粗多糖提取的影响Fig.5 Effect of material-to-liquid ratio on extraction of crude polysaccharides
由图5可知,随着溶剂添加量的增大,石斛花粗多糖提取率呈不断增大再降低的趋势,料液比在1∶25(g/mL)时,石斛花粗多糖含量最大。这可能是由于底物浓度降低,与酶的结合能力也随之降低,因此多糖溶出降低。故选择料液比为1∶25(g/mL)进行后续正交试验。
2.1.3 pH值对粗多糖提取的影响
在最佳复合酶添加量的基础上,固定提取温度40 ℃、提取时间 2 h和料液比 1∶25(g/mL),对比不同酶解pH值对粗多糖含量的影响,如图6所示。
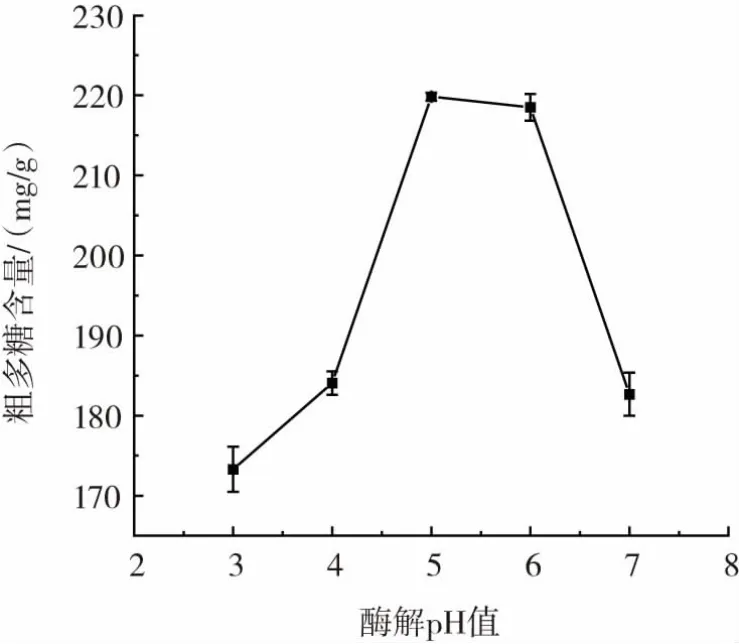
图6 pH值对粗多糖提取的影响Fig.6 Effect of pH value on extraction of crude polysaccharides
由图6可知,石斛花粗多糖的含量随着酶解pH值的增大而增大,在pH值为5时,含量达到最大,说明pH值为5时,有利于复合酶发挥作用。pH值偏小或偏大时,酶的活性都会受到影响而失活,从而影响多糖的含量。故选择酶解pH值为5进行后续正交试验。
2.1.4 酶解时间对粗多糖提取的影响
在最佳复合酶添加量的基础上,固定提取温度40℃、酶解pH值为5和料液比 1∶25(g/mL),对比不同酶解时间对粗多糖含量的影响,如图7所示。
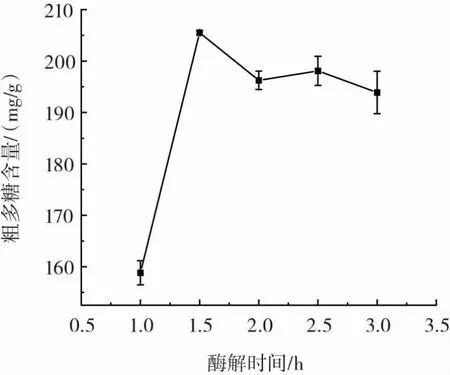
图7 酶解时间对粗多糖提取的影响Fig.7 Effect of enzymolysis time on extraction of crude polysaccharides
由图7可知,粗多糖的含量在1.5 h达到最大值,而后则趋于平稳状态,含量随着时间变长而降低,说明酶解时间在1.5 h时,酶与底物结合较完全。故选择酶解时间1.5 h进行后续正交试验。
2.1.5 酶解温度对粗多糖提取的影响
在最佳复合酶添加量的基础上,固定提取时间1.5 h、酶解 pH 值为 5 和料液比 1∶25(g/mL),对比不同酶解温度对粗多糖含量的影响,如图8所示。
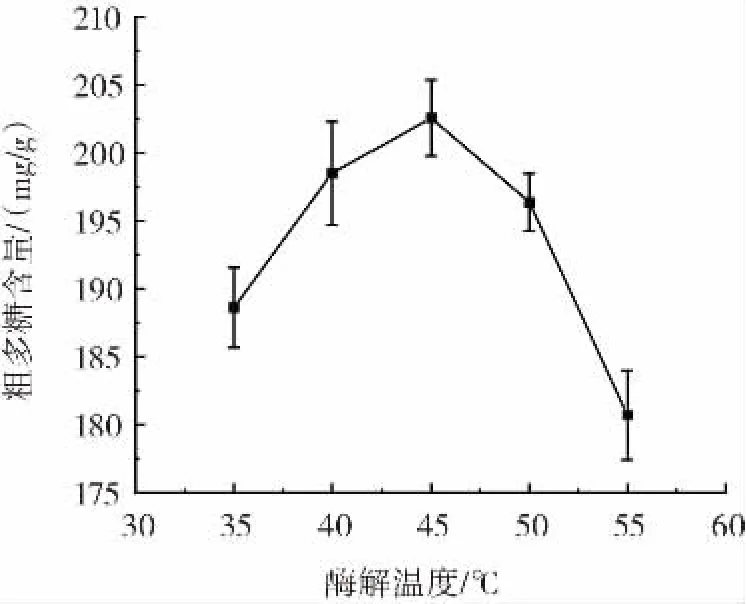
图8 酶解温度对粗多糖提取的影响Fig.8 Effect of enzymolysis temperature on extraction of crude polysaccharides
由图8可知,粗多糖的含量在45℃达到最大值,而后则呈下降趋势,温度低时酶的作用得不到发挥,温度过高,则使酶失活,此两者均使酶的酶的活性降低。基于酶的特异性,与底物结合时有最适温度,因此选取酶解温度45℃进行后续正交试验。
2.1.6 酶解参数正交试验优化
2.1.6.1 正交优化
根据热水浸提单因素试验可知,最佳提取料液比为1∶25(g/mL),最佳酶解pH值为5,最佳酶解时间为1.5 h,最佳温度为45℃,以粗多糖含量为评价指标,通过L9(34)正交试验对酶解参数进行优化,并用SPSS软件进行结果分析,正交试验因素水平如5所示,正交试验结果如表6所示。

表5 酶解参数正交试验因素水平Table 5 Factors and levels of the orthogonal experiment
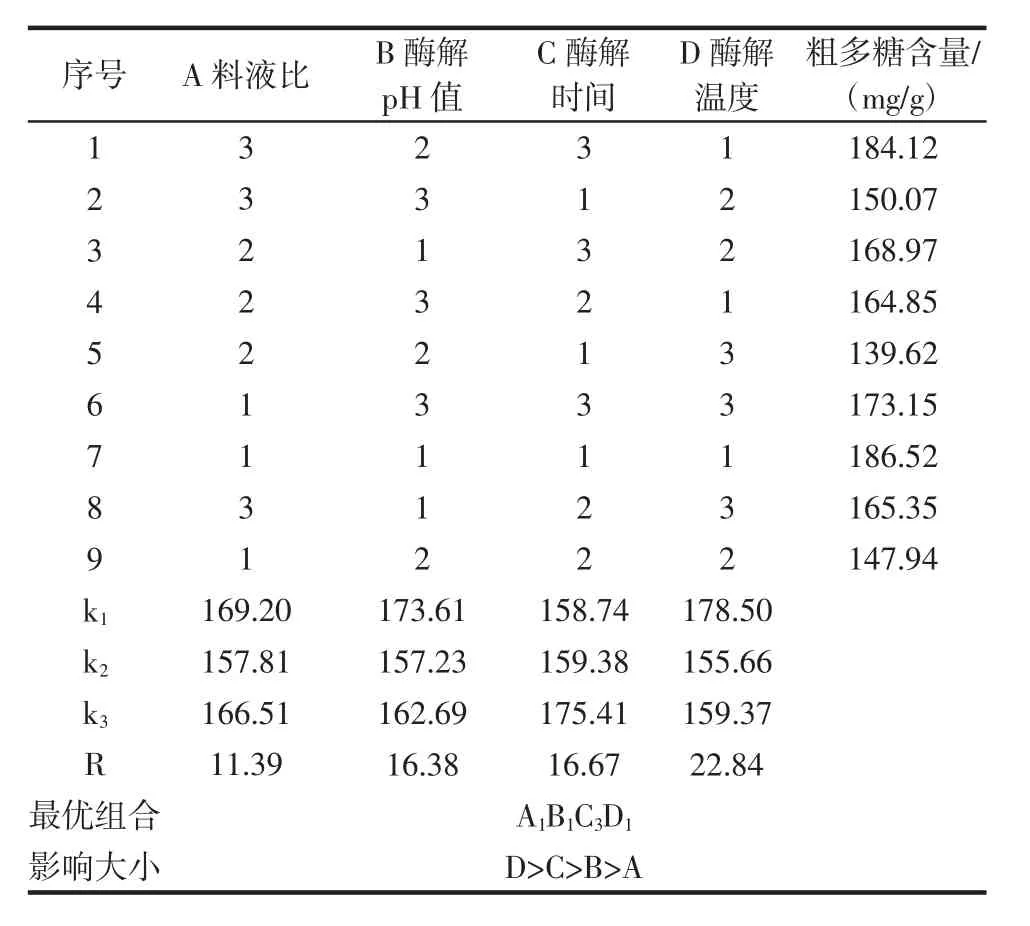
表6 酶解参数正交试验结果分析Table 6 Analysis of orthogonal experiment results for enzymatic hydrolysis parameters
由表6可知,通过比较各因素的极差值R可以看出,酶解参数对多糖含量的影响依次为酶解温度>酶解时间>酶解pH值>料液比,根据极差结果分析可以得到最佳的酶解参数为 A1B1C3D1,即料液比 1∶20(g/mL),酶解pH值为4,酶解时间2.0 h,酶解温度40℃。
2.1.6.2 方差分析及其显著性
利用Design-Expert.8.0.6软件,对表6中的数据进行方差分析,结果如表7所示。
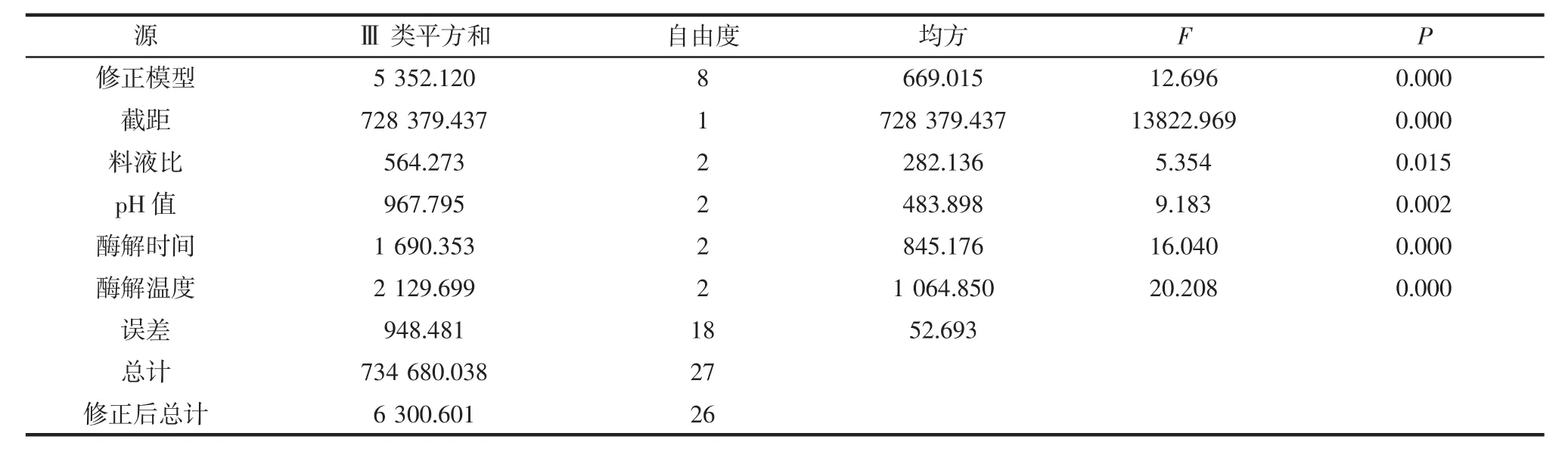
表7 酶解参数主体间效应分子结果Table 7 Results of main effect model of enzymolysis parameters
如表7所示,修正模型R2=0.959(调整后R2=0.941),正交设计模型极显著(P<0.01),说明模型具有可行性。料液比、酶解时间、酶解温度、酶解pH值皆具有显著性(P<0.05)。
2.1.6.3 验证试验
在最佳酶解参数下,做3次验证试验,粗多糖平均含量为189.30(mg/g),此值大于正交试验结果中的最大值。试验中采用热水浸提法对铁皮石斛花进行提取,提取得率为85.93(mg/g)。采用单一酶(果胶酶)提取铁皮石斛花多糖,提取得率为97.42(mg/g)。曹雪原等[29]采取回流提取的方法提取石斛花,铁皮石斛花多糖提取率为137.4(mg/g),说明复合酶解法提取多糖具有较好效果。
2.2 不同提取工艺对生物有效性的影响
2.2.1 铁皮石斛花不同提取工艺对生物有效性的影响
在铁皮石斛花的不同提取工艺条件下,对其进行生物有效性评价,并选用果胶酶的提取试验作为平行对照,结果如图9所示。
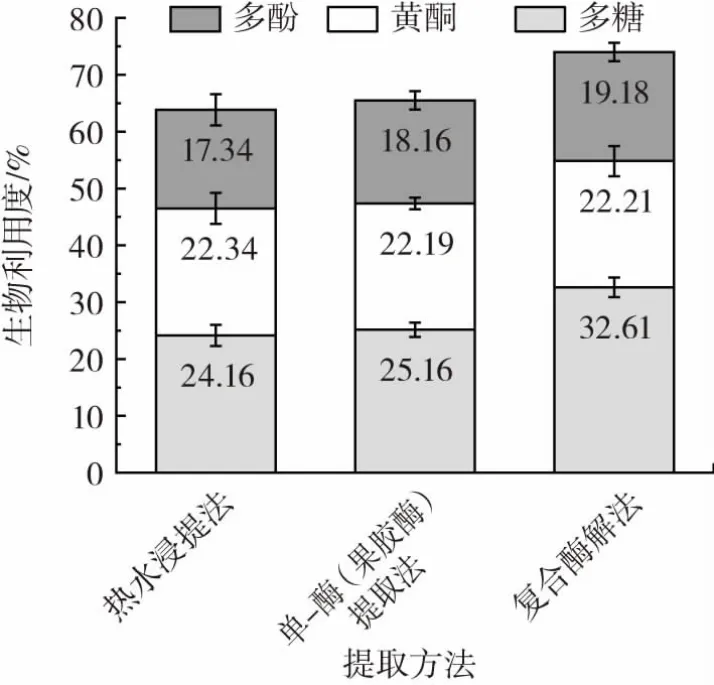
图9 不同铁皮石斛花提取工艺的生物有效性Fig.9 Bioavailability of the products extracted from Dendrobium officinale flower with different methods
因在复合酶试验中,果胶酶添加量对多糖提取率影响最大,所以选用果胶酶作为单一酶进行对比。由图9可知,酶解法提取工艺下多糖的生物有效性显著优于单一酶(果胶酶)提取工艺和热水提取工艺,酶解法的多糖生物利用度为32.61%,单一酶的多糖生物利用度为25.16%,水提法的多糖生物利用度为24.16%。这说明复合酶解工艺能够较好地维持多糖的生物有效性,使多糖更容易被人体吸收利用。
热水浸提法、单一酶解法和复合酶解法提取工艺下黄酮的生物有效性无明显差别,酶解法的黄酮生物利用度为22.21%,单一酶的黄酮生物利用度为22.19%,水提法的黄酮生物利用度为22.34%。复合酶解法提取工艺下多酚的生物有效性显著优于单一酶解工艺和热水提取法工艺,复合酶解法的多酚生物利用度为19.18%,单一酶解法的多酚生物利用度为18.16%,水提法的多酚生物利用度为17.34%。
李喜宏等[30]通过建立体外消化模型,对白灵茹储藏期间多糖的生物有效性进行评价,结果证明,气调包装在贮藏前期能较好地维持多糖生物有效性。Tamargo等[31]通过体外消化模型,考察膳食纤维对体外动态胃肠消化发酵模拟腔流量的影响,很好地了解了纤维消化过程中的物理变化。本试验建立体外消化模型,对比热水浸提法和复合酶解法生物有效性,结果表明,复合酶解法可较好地维持多糖、多酚和黄酮的生物有效性。
2.2.2 提取工艺生物有效性的多重比较
对石斛花提取工艺的生物有效性进行多重比较分析,分析其显著性差异,结果如表8所示。
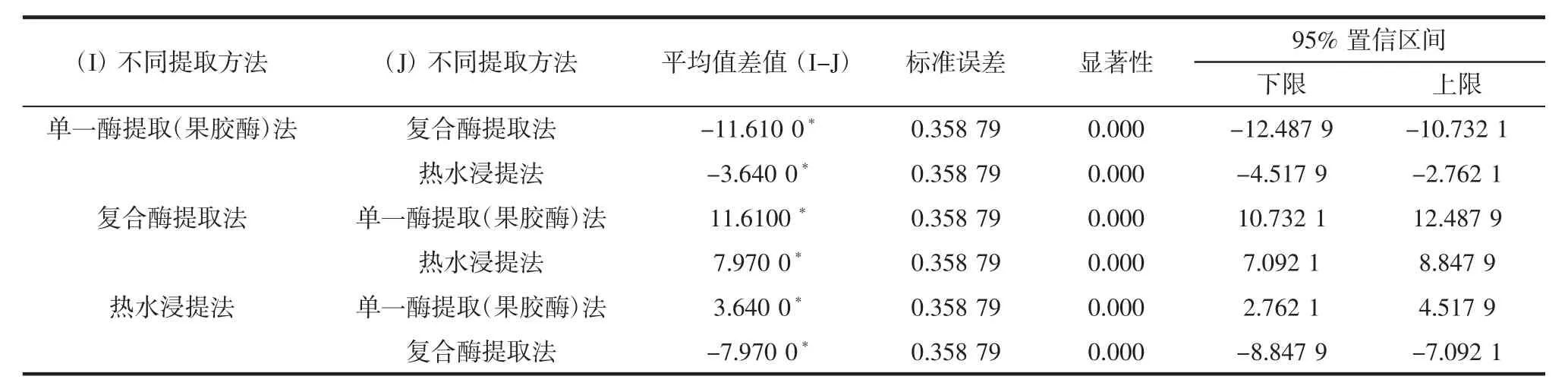
表8 多糖生物有效性的多重比较Table 8 Multiple comparisons of polysaccharide bioavailability
由表8可知,单一酶提取(果胶酶)法、复合酶提取法和热水浸提法对多糖的生物利用度呈极显著性差异(p<0.01)。
3 结论
以铁皮石斛花为原料生产的产品品种较为单一,其精加工有待加强。本文通过试验探寻新型的复合酶解提取法并对其生物有效性进行评价,最终得到了铁皮石斛花多糖最佳提取工艺和生物有效性评价指标,结果如下。
1)以粗多糖为评价指标,采用复合酶解法对石斛花进行提取,经过酶的筛选,确定了酶的种类以及添加量:纤维素酶添加量为0.8%,果胶酶添加量为0.4%,碱性蛋白酶添加量为0.4%,粗多糖含量为168.82 mg/g;在添加3种酶的基础上得到了最佳酶解工艺:料液比1∶20(g/mL),酶解 pH 值为 4,酶解时间 2.0 h,酶解温度40℃,粗多糖含量达到169.3 mg/g。
2)以生物有效性为评价指标:复合酶解法的多糖生物利用度为32.61%,黄酮生物利用度为22.21%,多酚生物利用度为19.18%;水提法的多糖生物利用度为24.16%,黄酮生物利用度为22.34%,多酚生物利用度为17.34%。对比发现,复合酶解法显著高于热水浸提法。复合酶解法可较好的提取铁皮石斛花多糖,且可较好的维持其多糖、多酚和黄酮的生物有效性。
