当归补血汤含药血清对TNF-α诱导HFLS-RA细胞增殖的影响
2022-06-14何艳新王颖航
何艳新, 田 乐, 吉 聪, 王颖航, 潘 志*
(1.长春中医药大学人参科学研究院,吉林 长春 130000;2.长春中医药大学附属医院,吉林 长春 130000)
类风湿关节炎是一种慢性炎症性自身免疫性疾病,主要病理表现为滑膜细胞的异常增殖,形成血管翳而导致滑膜炎症及进行性骨和关节破坏,滑膜成纤维细胞是病理变化过程中的关键效应细胞,在发病中起着重要作用[1-3]。目前,尚无治愈类风湿关节炎的方法,以非甾体抗炎药及慢性抗风湿药为主,但起效慢,不良反应大,生物制剂价格昂贵,大多数患者无法长期使用[4]。现代研究表明,中医药具有抗氧化、抗炎镇痛、免疫调节等多种药理作用,同时具有不良反应少、对肝脏损害较小等优势,在类风湿关节炎治疗上具有一定优势[5]。
当归补血汤源自《内外伤辨惑论》,由黄芪、当归按5∶1比例组成,方中黄芪大补脾肺之气,当归养血和营,二者合用,气血双补[6],全方具有抗炎、补气生血、调节免疫等作用[7-8],并且课题组前期研究发现其有效成分黄芪甲苷、阿魏酸等对类风湿关节炎疗效显著。因此,本实验观察当归补血汤对人类风湿关节炎成纤维样滑膜细胞(human fibroblast-like synoviocytes,HFLS-RA)增殖及相关炎症因子表达的影响,探讨该方治疗类风湿关节炎的可能机制,为相关研究提供新途径。
1 材料
1.1 药物 雷公藤多苷片(上海复旦复华药业有限公司,国药准字Z31020415,批号20190520)。当归、黄芪购自吉林省长春市宏检大药房,经长春中医药大学蔡广知副教授鉴定为正品。
1.2 细胞与动物 HFLS-RA细胞购自北京北纳创联生物技术研究院,取3~7代用于实验。清洁级健康雄性Wistar大鼠42只,体质量(200±20)g,购自吉林省长春市亿斯实验动物技术有限责任公司,实验动物生产许可证号SCXK(吉)2011-0004,饲养于长春中医药大学动物实验中心,温度(23±2)℃,相对湿度(50±5)%。
1.3 试剂及仪器 H-DMEM培养基(美国HyClone公司,批号AE26287263);MTT(北京索莱宝科技有限公司,批号M8180);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(美国Pepro Tech公司,批号300-01A-10);转化生长因子-β(transforming growth factor-β,TGF-β)ELISA试剂盒(批号CK-E10113H)、白细胞介素10(interleukin-10,IL-10)ELISA试剂盒(批号CK-E10155H)、白细胞介素6(interleukin-6,IL-6)ELISA试剂盒(批号CK-E10140H)、白细胞介素17(interleukin-17,IL-17)ELISA试剂盒(批号CK-E10082H)(上海优选生物科技有限公司);PCR试剂盒(北京天根生化科技有限公司,批号DP419);GAPDH抗体(批号AP0063)、叉头状螺旋转录因子(fork-head box p3,Foxp3)抗体(批号BS90536)、转录激活因子3(signal transducer and activator of transcription 3,STAT3)(批号AP0365)(美国Bioworld公司);维甲酸相关核孤儿受体γt(retinoic acid-related orphan nuclear receptor γ t,ROR-γt)抗体(批号bs-23019R)、Goat anti-Rabbit IgG(H&L)-HRP(北京博奥森生物技术有限公司)。离心机(北京大龙兴创实验仪器有限公司,型号DM0412);恒温箱(上海和呈仪器制造有限公司,型号DHG-9000/5A);基因扩增仪(苏州东胜兴业科学仪器有限公司,型号ETC811);荧光倒置显微镜(上海比目仪器有限公司,型号BFM-800E);培养箱(日本Sanyo公司,型号MCO-18AIC);超净工作台(苏州净化设备有限公司,型号SW-CJ-2D);电泳仪(型号165-8000)、转膜仪(型号170-3930)(美国Bio-Rad公司);智能成像系统(美国Thermo Fisher Scientific公司,型号FL1000)。
2 方法
2.1 含药血清制备 42只SD大鼠按照随机数字表分为空白组、模型组、雷公藤多苷组及当归补血汤低、中、高剂量组,每组7只。当归补血汤按原方黄芪-当归5∶1配伍比称取药材,煎煮浓缩至水煎液含生药1.5 g/mL,即当归补血汤高剂量组,同法制备当归补血汤中、低剂量水煎液,在4 ℃下保存备用。按人与动物体表面积换算得出,灌胃给药剂量分别为15、7.5、3.75 g/kg,雷公藤多苷给药剂量为每天6.25 mg/kg[9],灌胃给药,每天2次,7 d后腹主动脉采血,收集血清,56 ℃灭活,在-20 ℃下保存备用。
2.2 细胞培养与分组 细胞随机分为6组,即空白组(10%空白大鼠血清培养基培养细胞)、模型组(20 ng/mL TNF-α+10%空白组大鼠血清培养基)、雷公藤多苷组(20 ng/mL TNF-α+10%雷公藤多苷组大鼠血清培养基)、当归补血汤低剂量组(20 ng/mL TNF-α+10%当归补血汤低剂量组大鼠血清培养基)、当归补血汤中剂量组(20 ng/mL TNF-α+10%当归补血汤中剂量组大鼠血清培养基)、当归补血汤高剂量组(20 ng/mL TNF-α+10%当归补血汤高剂量组大鼠血清培养基)。
2.3 MTT法检测细胞增殖活力 待细胞生长达到80%~90%时,用0.25%胰蛋白酶消化细胞,计数,调整密度至1×105/mL。将每孔200 μL细胞悬液接种于96孔板上,按“2.2”项下方法分组、给药,24 h后每孔加入20 μL MTT,4 h后每孔加入150 μL DMSO,在490 nm波长处检测光密度(OD)。
2.4 ELISA法检测细胞上清液中IL-6、IL-10、IL-17、TGF-β水平 按“2.2”项下方法分组和给药,培养24 h后收集细胞上清,离心,在-20 ℃下保存,按照说明书操作步骤检测目标因子水平。
2.5 PCR法检测细胞中Foxp3、ROR-γt、STAT3 mRNA表达 提取总RNA,检测其纯度、浓度、完整性,逆转录合成cDNA,反应条件为42 ℃ 50 min,70 ℃ 10 min,再配制50 μL体系扩增,条件为94 ℃ 5 min,94 ℃ 10 s,55 ℃ 30 s(循环39次),72 ℃ 15 s,72 ℃ 5 min,每个样品设置3个复孔,平行3次,检测目的基因、内参标准灰度值,两者比值即为目的基因相对表达量。引物序列见表1。

表1 引物序列
2.6 Western blot法检测细胞中Foxp3、ROR-γt、STAT3蛋白表达 提取细胞总蛋白,BCA蛋白浓度检测试剂盒检测蛋白浓度,制胶(12%分离胶、5%浓缩胶),上样后以SDS-PAGE电泳法分离蛋白样品(80 V、30 min跑上层胶,110 V、90 min跑下层胶),电泳结束后进行蛋白转膜(100 V、100 min),5%脱脂奶粉封闭1 h后,TBST洗膜3次,每次10 min,4 ℃下孵育一抗(GAPDH 1∶2 500,Foxp3 1∶500,ROR-γt 1∶500,STAT3 1∶500)过夜;TBST洗膜3次,每次10 min,室温摇床上孵育二抗(1∶1 000)1 h,TBST洗膜3次,每次10 min;ECL化学发光,蛋白凝胶电泳成像仪中进行成像,计算灰度值。
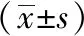
3 结果
3.1 当归补血汤含药血清对TNF-α诱导HFLS-RA细胞增殖抑制作用 与空白组比较,模型组HFLS-RA细胞增殖增加(P<0.01);与模型组比较,雷公藤多苷组、当归补血汤各剂量组HFLS-RA细胞增殖抑制(P<0.01),见表2。

表2 当归补血汤含药血清对TNF-α诱导HFLS-RA增殖抑制作用
3.2 当归补血汤含药血清对TNF-α诱导HFLS-RA细胞上清液中IL-6、IL-17、TGF-β、IL-10水平的影响 与空白组比较,模型组细胞上清液中IL-6、IL-17水平升高(P<0.01),TGF-β、IL-10水平降低(P<0.01);与模型组比较,雷公藤多苷组、当归补血汤高剂量组细胞上清液中IL-6、IL-17水平降低(P<0.01),TGF-β、IL-10水平升高(P<0.01);与雷公藤多苷组比较,当归补血汤高剂量组细胞上清液中IL-6水平降低(P<0.01),IL-10水平升高(P<0.01),见表3。

表3 各组HFLS-RA细胞上清液中IL-6、IL-17、TGF-β、IL-10水平比较
3.3 当归补血汤含药血清对TNF-α诱导HFLS-RA细胞中ROR-γt、STAT3、Foxp3蛋白表达的影响 与空白组比较,模型组细胞中ROR-γt、STAT3蛋白表达升高(P<0.01),Foxp3表达降低(P<0.01);与模型组比较,雷公藤多苷组和当归补血汤中、高剂量组细胞中ROR-γt、STAT3蛋白表达降低(P<0.01),当归补血汤高剂量组细胞中Foxp3蛋白表达升高(P<0.01),见图1。

注:A为蛋白印迹图,B为蛋白表达统计图。与空白组比较,**P<0.01;与模型组比较,##P<0.01。图1 各组HFLS-RA细胞中ROR-γt、STAT3、Foxp3蛋白表达
3.4 当归补血汤含药血清对TNF-α诱导HFLS-RA细胞中ROR-γt、STAT3、Foxp3 mRNA表达的影响 与空白组比较,模型组细胞中ROR-γt、STAT3 mRNA表达升高(P<0.01),Foxp3 mRNA降低(P<0.05);与模型组比较,雷公藤多苷组、当归补血汤高剂量组细胞中ROR-γt、STAT3 mRNA表达降低(P<0.01),Foxp3 mRNA表达升高(P<0.05,P<0.01);与雷公藤多苷组比较,当归补血汤高剂量组细胞中ROR-γtmRNA表达降低(P<0.01),见表4、图2。

图2 各组HFLS-RA细胞中ROR-γt、STAT3、Foxp3 mRNA表达

表4 各组HFLS-RA细胞中ROR-γt、STAT3及Foxp3 mRNA表达比较
4 讨论
类风湿关节炎是一种慢性炎症性自身免疫性疾病,其特征在于关节肿胀、压痛,严重会导致残疾,潜在病因及发病机制目前尚不明确。成纤维样滑膜细胞(HFLS-RA)是血管翳-软骨连接处最常见的细胞类型,可产生细胞因子、趋化因子和基质降解分子迁移并侵入关节软骨来破坏关节,参与类风湿关节炎的整个过程[10-11]。通过查阅文献可知,T细胞亚群在类风湿关节炎病理演变中起着非常重要的作用,其分泌的细胞因子也与类风湿关节炎疾病的发生发展密切相关。现代药理研究表明,当归补血汤具有免疫调节、造血、抗氧化、抗疲劳等多种药理作用[12]。本课题组结合前期研究,以HFLS-RA为对象,探当归补血汤含药血清治疗类风湿关节炎的可能机制。
目前,调节辅助性T细胞17(helperTcells17,Th17)和调节性T细胞(regulatoryTcell,Treg)平衡已成为治疗类风湿关节炎疾病的新途径及新的研究热点。Th17细胞可导致自身免疫性疾病,但Treg细胞可抑制自身免疫性疾病,两者在功能和分化过程中相互影响,相互拮抗。Th17细胞是类风湿关节炎疾病的主要参与者,它可产生IL-17、IL-22和IL-23,招募中性粒细胞,促进感染部位的炎症;Treg细胞产生抗炎因子IL-10和TGF-β,抑制多种免疫细胞的活性[13]。STAT3在T细胞抗原受体(TCR)/共刺激信号刺激下,与TGF-β和IL-6一起被激活[14-15],然后STAT3诱导转录因子RAR相关孤儿受体(ROR)-γt的表达,将细胞引向Th17亚群[16],如果能够抑制STAT3的表达等同于抑制ROR-γt的表达,则能减少Th17细胞数量。Treg细胞是由TCR刺激而产生的,导致Foxp3表达增加,Treg细胞数量增多,此外TGF-β在体外也能诱Foxp3+Treg细胞[17]。因此,调节影响和维持多种因素对于Th17/Treg的平衡、抑制炎症反应对类风湿关节炎发展有着非常重要的作用。
本研究发现,高剂量当归补血汤干预时TNF-α诱导HFLS-RA细胞的增殖明显受到抑制,IL-6、IL-17水平及ROR-γt、STAT3mRNA和蛋白表达降低,TGF-β、IL-10水平及Foxp3mRNA和蛋白表达升高。由此认为,当归补血汤含药血清对类风湿关节炎滑膜炎症具有抑制作用,可能通过调节Th17/Treg,维持正常的免疫平衡来发挥作用。
