肝癌调控细胞凋亡抑制因子1的表达及其对细胞增殖和凋亡的影响
2022-06-14杨刚王冠熊永福李芸雷蓉柳弥
杨刚 王冠 熊永福 李芸 雷蓉 柳弥
肝癌是全球癌症死因的第二大原因,占原发性肝癌的70%~90%[1-2]。深入研究肝细胞癌发生发展机制,发现新的治疗靶点对改善肝癌病人预后至关重要[3-4]。 TP53调控细胞凋亡抑制因子1(TRIAP1)是一种新发现的具有抑制凋亡作用的9k-Da的蛋白质[5-6]。据文献报道,TRIAP1可以与进化和淋巴相关的蛋白(PRELI)形成复合体,通过调控心磷脂抑制凋亡[7]。 有研究显示,TRIAP1可通过与热休克蛋白70(HSP70)相互作用,阻止凋亡蛋白酶激活因子1(APAF1)、细胞色素C和Caspase 9形成凋亡复合物,调节凋亡通路[8]。TRIAP1也在多个研究中被发现与肿瘤发生发展有关,肿瘤组织中TRIAP1表达较癌旁组织明显上调,且与病人生存预后呈负相关[5,9]。本研究通过TCGA数据库验证肿瘤组织与正常组织中TRIAP1表达差异,利用siRNA沉默方法探究TRIAP1对肝癌细胞的影响及作用机制。
材料与方法
一、材料
Huh7、HepG2人肝癌细胞系、siTRIAP1小干扰RNA等。
二、方法
1.细胞培养:人肝癌细胞株Huh7和HepG2分别培养于含10%胎牛血清和1%青链霉素混合物的RPMI1640培养基,于37 ℃,5% CO2的细胞培养箱中常规培养。每天观察细胞状态,根据生长情况每2~3天进行细胞换液或消化传代处理。
2.细胞总RNA的提取以及TRIAP1 mRNA相对水平的测定:RNA的提取和TRIAP1相对水平的测定参考试剂商提供的产品说明书。
3.细胞分组与转染构建敲低TRIAP1细胞系:使用上海吉凯生物科技有限公司提供的siTRIAP1小干扰RNA及对照,分别对人肝癌细胞株Huh7和HepG2两种细胞进行转染,根据上述供应商提供的说明书转染Huh7和HepG2细胞系。具体操作如下:细胞生长至50%时,使用Opti-MEM培养基对细胞进行饥饿处理2小时,将转染试剂Lipo2000、小干扰RNA分别与Opti-MEM混合均匀,转染体系为2 ml/孔,分别取125 μl Opti-MEM培养基与5 μl Lipo2000和5 μl siRNA混合,静置5分钟后将两种体系混合均匀,静置20分钟,加入培养皿,4~6小时后更换完全培养基。48~72小时收获细胞提取蛋白,用于Western blot印迹实验检测转染效率。
4.CCK8细胞检测:利用胰酶将处于对数生长期的转染后细胞消化至无菌离心管,离心后加以RPMI1640培养基重新吹打均匀,进行细胞计数后,以 2×103/孔接种于96孔板,培养于37 ℃,5% CO2细胞培养箱,按照时间梯度,分别在0小时、24小时、48小时、72小时、96小时时每孔加入10 μl CCK8试剂,继续孵育1小时后,酶标仪450 nm检测其每孔OD值,以上实验过程重复3次,使用GraphPad 7.0对数据进行统计绘图。
5.Western blot印迹检测 :提取贴壁细胞蛋白后,参考之前的研究进行Western blot实验[8]。
6.Annex inV/PI法检测细胞凋亡:细胞铺板(以六孔板为例):收取细胞进行铺板,每孔接种5×109个细胞,待细胞贴壁后,使用PKA激活剂FI,抑制剂H89,KT5720处理细胞,培养箱内孵育24小时。胰酶消化细胞,计数细胞5×105/ml~1×106/ml。使用预冷的PBS清洗细胞,1 000 prm,4 ℃离心5分钟,3次。加入凋亡binding buffer重悬细胞,使其密度为1×107个/ml。每管加入100 μl细胞、5 μl FITC-AnnexinV及5 μl PI。室温避光孵育15分钟或4 ℃孵育半小时:标记抗体后,加入100 μl 1×binding buffer终止反应,1小时内上流式机检测。
三、统计学处理
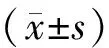
结果
1.TRIAP1在肝癌及正常组织中的表达:对TCGA数据库中肝癌病人数据进行分析。结果显示,人肝癌组织中TRIAP1的表达高于癌旁组织。将这些肝癌病人依据TRIAP1表达水平分为高低两组,分析两组病人的TRIAP1表达水平对无疾病生存期(disease free survival,DFS)的影响。结果显示,TRIAP1高表达的肝癌病人的DFS明显缩短(P=0.003 3)。以上实验结果表明,TRIAP1在肝癌的发生发展过程中起着重要的作用,并与肝癌病人预后呈负相关(图1)。
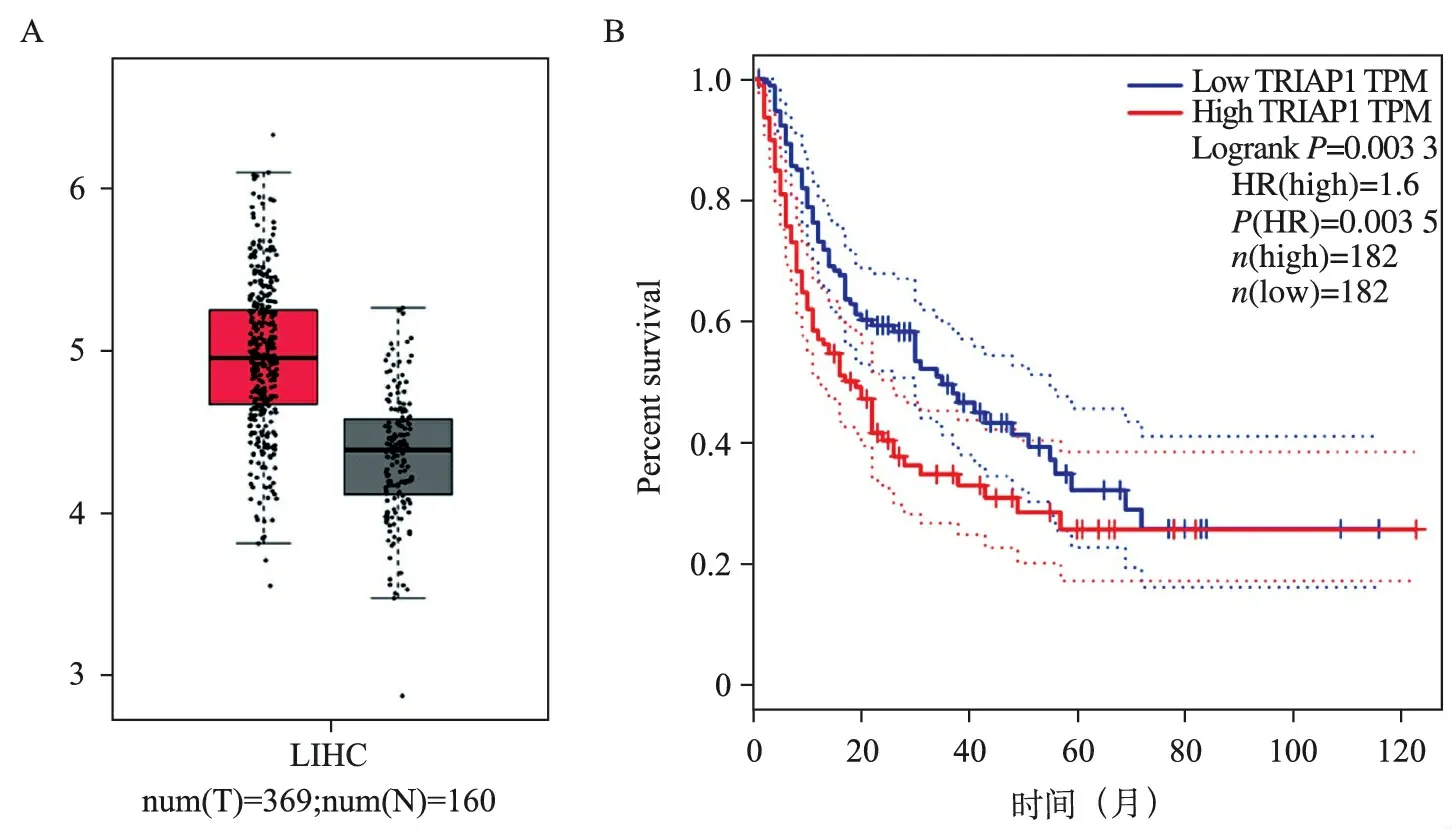
A:TCGA数据库分析肝癌组织与癌旁组织TRIAP1表达差异的箱式图。B:TCGA数据库分析TRIAP1表达水平与肝癌病人预后的K-M生存曲线
2.TRIAP1敲低的肝癌细胞系并验证:Western blot结果显示,Huh7和HepG2转染siRNA实验组的TRIAP1表达显著降低,验证了转染siRNA可有效敲低TRIAP1表达水平(图2)。
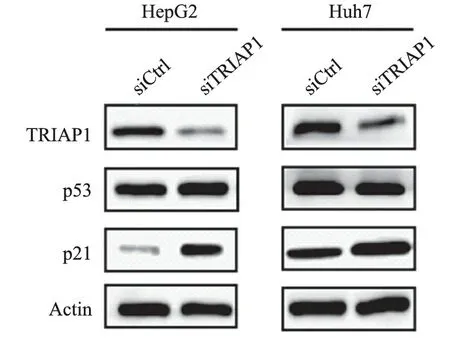
图2 Western blot验证转染TRIAP1 siRNA敲低效率及敲低TRIAP1后p53、p21蛋白水平
3.TRIAP1敲低对肝癌细胞中p53和p21表达的影响:Western blot结果显示,敲低TRIAP1实验组与对照组的p53蛋白水平未发现明显差异,而p21蛋白的表达水平在敲低TRIAP1后反而显著增高(图2)。说明在肝癌细胞中TRIAP1可能不通过p53而是直接调控它的下游p21表达发挥作用。为了证实TRIAP1对p21的调控作用,本研究通过RealTime-PCR在RNA水平上进行验证(表1),TRIAP1敲低后p21的表达水平升高,明确了TRIAP1对 p21表达的调控作用,且与p21表达呈负相关。本研究还采用Capase3/7细胞凋亡检测试剂盒检测敲低TRIAP1后凋亡水平,结果显示,HepG2和Huh7细胞在敲低TRIAP1后Capase3/7的蛋白活性比对照组明显增强(表2)。以上结果进一步证实了TRIAP1可通过调控p21表达进而影响肝癌细胞凋亡。

表1 敲低TRIAP1后p21 mRNA的相对表达水平
4.敲低TRIAP1对肝癌细胞增殖的影响见图3。敲低TRIAP1实验组比对照组细胞的增殖能力下降,且呈时间依赖性,在第4天时差异有统计学意义(P<0.01),表明TRIAP1有抑制肝癌细胞增殖能力的作用。

图3 敲低TRIAP1后对肝癌细胞增殖的影响
5.敲低TRIAP1对肝癌细胞凋亡的影响见图4。结果表明,敲低TRIAP1实验组比对照组细胞的凋亡细胞显著增多(P<0.01)。以上结果表明,TRIAP1可作用于肝癌细胞凋亡过程,抑制TRIAP1可以促进肝癌细胞的凋亡。

图4 敲低TRIAP1对肝癌细胞凋亡的影响(A:HepG2;B:Huh7)
讨论
本研究通过在人肝癌细胞株Huh7和HepG2中敲低TRIAPI表达,并评估其对细胞凋亡和增殖的影响,探讨了TRIAPI对肝癌生物学行为的重要性。本研究首先使用TCGA数据库验证了TRIAP1在肿瘤组织中高表达且与不良的预后密切相关。我们通过CCK8、流式细胞术等技术揭示了敲低TRIAP1削弱了肝癌细胞的增殖能力,促进了肝癌细胞的凋亡过程。与TRIAP1在鼻咽癌中发挥促癌作用一致[10],本研究同样揭示了TRIAP1可促进肝癌发生发展。因此,TRIAP1可成为预测肝癌病人不良预后的重要生物标志物。随着小分子抑制剂研究迅猛发展,TRIAP1也有望成为提高肝癌病人生存率和改善预后的新靶点。
转录因子p53是重要的抑制肿瘤发生发展的蛋白,该转录因子调控参与细胞功能和癌变的关键基因,如凋亡、衰老和DNA修复,大约50%的人类癌症的发生都存在p53基因突变[11]。肿瘤中突变型p53可以导致突变型p53蛋白的表达,这些突变型p53蛋白不仅缺失了野生型p53蛋白的肿瘤抑制活性,反而有助于肿瘤恶性进展[12]。p21作为p53生长抑制通路的重要组成部分,直接受到p53的调控,具有调节如细胞周期进展、细胞生长、DNA损伤和细胞干性等多种细胞功能的作用[13]。也有研究表明,p21的表达可以不依赖于p53诱导。因为无论p53处于野生型或突变型, p21均可被诱导表达[14]。本研究结果表明,敲低TRIAP1后上调了p21的表达,而敲低TRIAP1实验组和对照组的p53表达并无差异。因此,在肝癌细胞中TRIAP1表达可能与p53表达无关,或者通过其他通路导致p53表达变化不明显;而TRIAP1在肝癌中可直接地调控p21的表达,进而延滞细胞周期,促进肿瘤细胞增殖。本研究证明了TRIAP1在肝癌发生发展中的作用,明确TRIAP1通路在肿瘤中的作用机制。
