改良格拉斯哥预后评分联合纤维蛋白原与前白蛋白比值对胸腔镜肺叶切除术治疗肺癌的预后评估价值
2022-06-14詹浩东王荣李剑
詹浩东 王荣 李剑
肺癌发病率、致死率均居恶性肿瘤之首[1]。胸腔镜肺叶切除术能够有效治疗早期肺癌,但部分病人未能在早期诊断,导致术后生存情况仍未得到明显改善[2]。有研究发现,肺癌术后5生存率约36.5%,术后复发、转移是影响预后的重要因素[3]。有研究证实,炎症反应与肿瘤发生发展密切相关[4]。有研究发现,改良格拉斯哥预后评分(modified Glasgow prognostic score,mGPS)评分、纤维蛋白原与前白蛋白比值(fibrinogen to pre-albumin ratio,FPR)等炎性指标均可作为评估肿瘤病人预后的有效指标[5-6]。本研究分析mGPS、FPR对胸腔镜肺叶切除术治疗肺癌的预后评估价值。
对象与方法
一、对象
2016年10月~2019年12月我院行胸腔镜肺叶切除术治疗的肺癌病人63例。男性40例,女性23例;年龄35~80岁,平均年龄(52.25±6.36)岁。本研究已获得我院医学伦理委员会审核批准。纳入标准:(1)经病理学检查已确诊为肺癌,均行胸腔镜肺叶切除术;(2)术前未接受放化疗治疗。排除标准:合并肝、肾、心功能障碍;伴其他恶性肿瘤;术前接受辅助治疗;补充性全肺切除;临床资料不全。
二、方法
1.资料收集:包括性别、年龄、吸烟史、卡氏评分(Karnofsky,KPS)、TNM分期(国际肺癌研究协会第8版TNM分期标准)、病理类型、化疗周期数、化疗方案以及生化指标中性粒细胞计数、淋巴细胞计数、血清纤维蛋白原(fibrinogen,FIB)和前白蛋白(pre-albumin,PA)水平,计算FPR。
2.指标检测:术前采集空腹外周静脉血,应用透射比浊法检测病人血清FIB、PA值,计算FPR比值。术前1周测定病人血清白蛋白和C反应蛋白(C-reactive protein,CRP)值,并根据白蛋白、CRP水平进行mGPS评分。白蛋白正常(>35 g/L)且CRP(<10 mg/L)时mGPS为0分;仅CRP升高(>10mg/L)时mGPS为1分;白蛋白降低(<35 g/L)和CRP升高(>10 mg/L)时mGPS为2分[7]。
3.随访:出院后采用电话、住院或门诊病历资料查询等方进行随访,术后第1年每3个月复查1次,术后第2年每半年复查1次,术后第3年每年复查1次。随访内容包括病人术后结局(无病生存或复发、死亡),死亡原因以及具体时间。随访截止日期为2021年7月。
三、统计学分析
运用SPSS23.0软件进行数据分析,采用受试者工作特征曲线(receiver operating characteristic curve,ROC)确定FPR的最佳截断值,χ2检验分析mGPS、FPR与肺癌临床病理特征的关系,多因素Cox回归分析影响胸腔镜肺叶切除术治疗肺癌预后的相关因素。P<0.05为差异有统计学意义。
结果
1.肺癌病人mGPS、FPR情况:63例中mGPS 0分38例,1分16例,2分9例。将0分纳入正常组(38例),1~2分纳入异常组(25例)。FPR中位数为0.089。ROC曲线最佳截断值为0.096。见图1。根据FPR将病人分为高FPR组(FPR >0.096,19例)和低FPR组(FPR≤0.096,44例)。
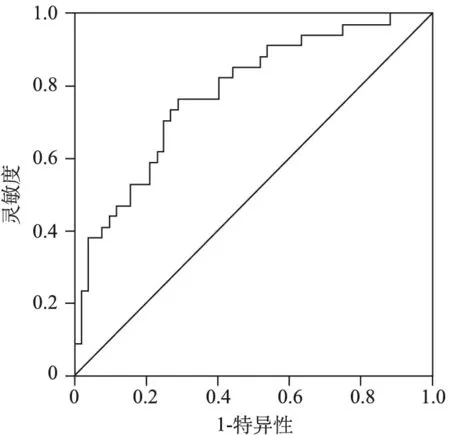
图1 FPR对肺癌诊断效能的ROC曲线
2.mGPS、FPR与病人临床病理特征关系:mGPS、FPR与病人年龄、性别、病理类型、分化程度、淋巴结转移均无明显关系(P>0.05),与TNM分期显著相关,mGPS异常、高FPR肺癌病人TNM分期 Ⅲ期比例更高(P<0.05)。见表1。
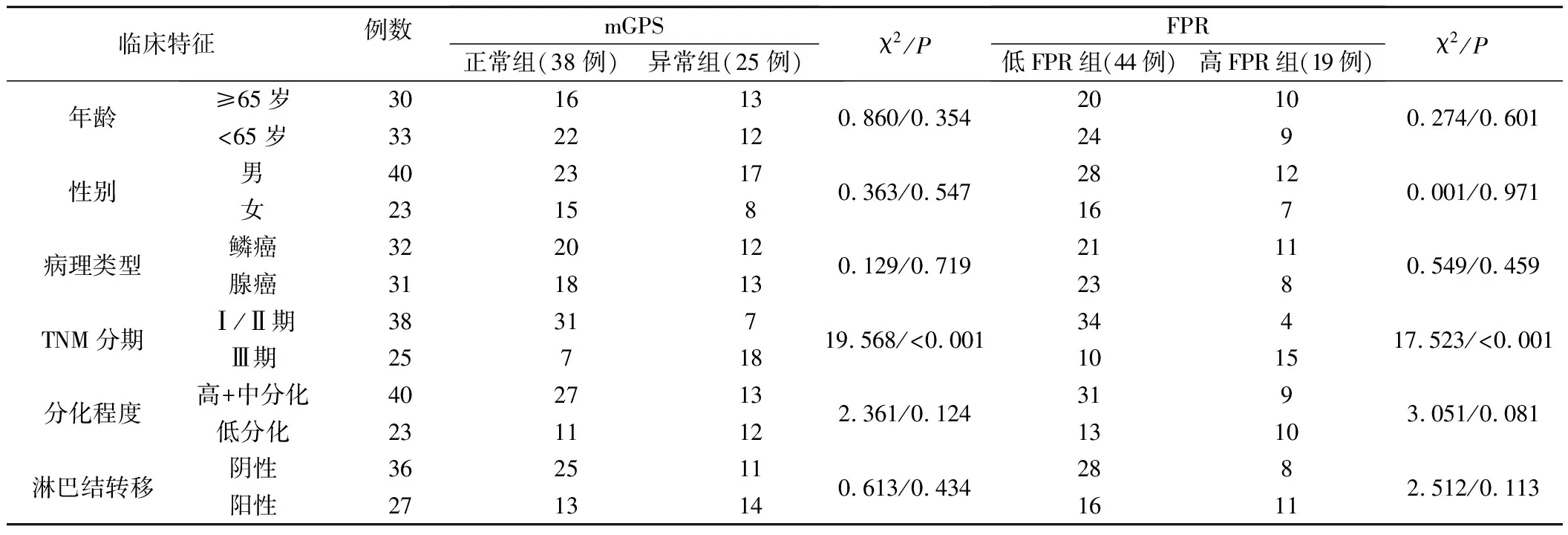
表1 mGPS、FPR与肺癌病人临床病理特征关系(例)
3.病人预后生存分析:自出院后随访时间为2~45个月,3年无病生存率为66.67%(42/63)。mGPS正常组、异常组病人3年无病生存率分别为78.95%(30/38)和48.00%(12/25);低FPR组、高FPR组病人3年无病生存率分别为75.00%(33/44)和47.37%(9/19),正常组、低FPR组3年无病生存率分别高于异常组、高FPR组(χ2=6.499、4.559,P=0.011、0.033)。18例mGPS联合FPR均异常(mGPS异常且高FPR)病人3年无病生存率为38.89%(7/18),明显低于二者非均异常肺癌病人(77.78%,35/45)(χ2=8.750,P=0.003)。
4.单因素分析见表2。结果表明,TNM Ⅲ期、mGPS异常、高FPR、mGPS联合FPR均异常(mGPS异常且高FPR)的胸腔镜肺叶切除术肺癌病人3年无病生存率均明显降低(P<0.05)。
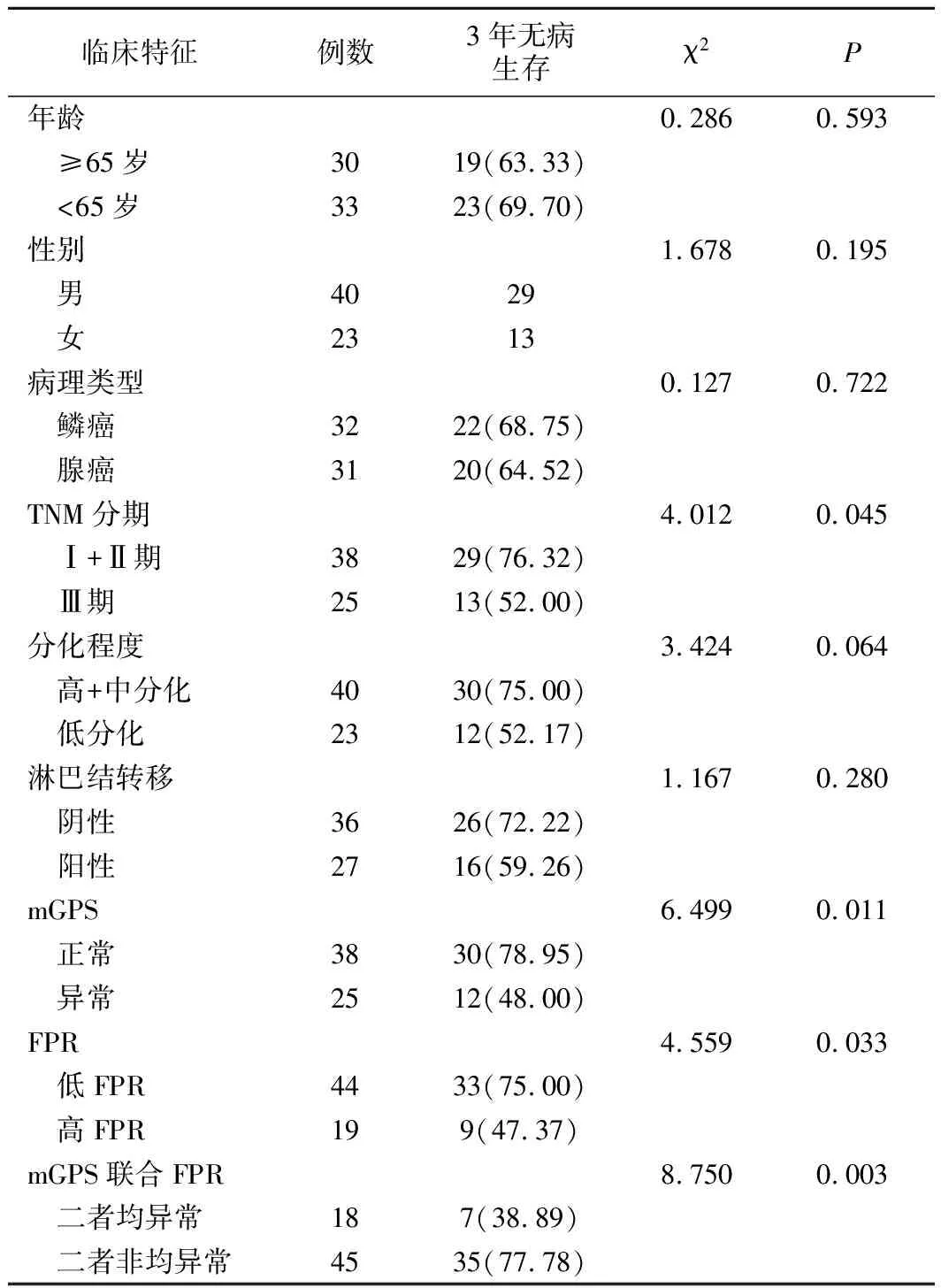
表2 病人预后单因素分析(例,%)
5.影响病人预后多因素Cox回归分析见表3。多因素Cox比例风险回归模型分析显示,TNM Ⅲ期、mGPS异常、高FPR、mGPS联合FPR比值均异常(mGPS异常且高FPR)均为影响胸腔镜肺叶切除术肺癌病人预后的独立危险因素(P<0.05)。
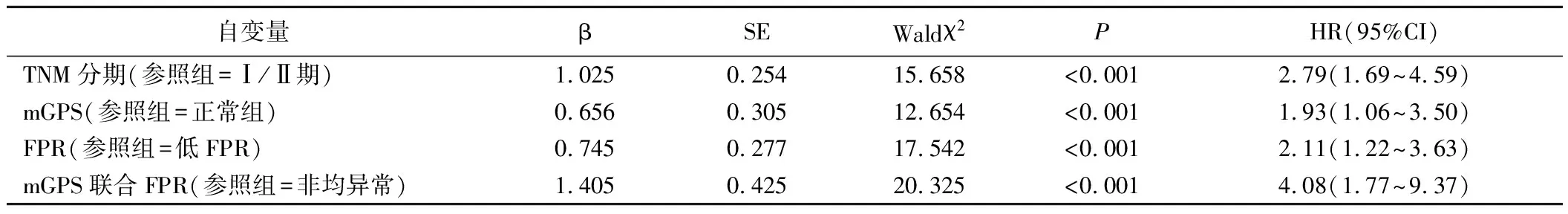
表3 影响病人预后多因素Cox回归分析
讨论
胸腔镜肺切除术损伤小、切口恢复快、切口瘢痕易遮蔽。手术可有效去除肿瘤病灶,但术后生存情况仍不容乐观[8]。因此,发掘和完善能够可靠评估病人生存预后的有效指标至关重要。而目前临床对于肺癌的研究热点是如何利用一些方便、简单、创伤小以及能综合反应病人机体及肿瘤状态的生物标志物,如GPS评分、C反应蛋白、纤维蛋白原等对肺癌预后预测[9-10]。既往研究显示,多项指标联合预测肿瘤预后价值更好[11]。
FIB是一种由肝脏合成的糖蛋白,主要参与机体的凝血反应,同时可增加红细胞黏附和血栓形成[12]。有研究显示,FIB与肿瘤预后密切相关[13]。PA是一种反映机体营养状况的急性时相反应蛋白,当机体出现损伤、营养不良或者炎症时其血清中含量降低[14]。既往研究显示,PA与肿瘤预后存在关联[15]。因此,FPR参与肿瘤疾病预后。mGPS是目前临床反应机体营养水平与症状态的常见评分系统,在既往相关文献中mGPS对多种肿瘤预后具有一定预测价值[16]。
本研究结果显示,mGPS、FPR与肺癌病人TNM分期显著关系,说明mGPS、FPR参与肺癌疾病的发生、发展。本研究显示,mGPS正常组、低FPR组3年无病生存率均高于异常组、高FPR组,说明mGPS、FPR与肺癌预后密切相关,当mGPS异常、低FPR提示病人预后不良。单因素、多因素分析结果显示, 肺癌病人3年无病生存率与TNM分期、mGPS、FPR有关,且TNM Ⅲ期、mGPS异常均为影响胸腔镜肺叶切除术肺癌病人预后的独立危险因素,由此证实,mGPS、FPR与胸腔镜肺叶切除术肺癌病人预后密切相关,能够作为预测疾病预后的有效指标。FPR比值能够反映机体高凝状态和营养不良,mGPS与反应机体炎症反应。而肺癌在疾病发展过程中与炎症反应、营养状况以及与凝血异常均密切相关[17]。当肺癌随着疾病逐渐恶化时,可伴随机体炎症反应、凝血异常加重,营养状况差。因此,mGPS升高,高FPR可作为疾病的独立危险因素。
本研究显示,mGPS联合FPR均异常(mGPS异常且高FPR)3年无病生存率低于二者非均异常者,且为影响病人预后的独立危险因素,说明mGPS及FPR均异常病人预后更差。二者联合预测胸腔镜肺叶切除术肺癌病人预后的风险比率(HR)值大于二者单独检测。因此,临床通过联合监测mGPS与FPR更能够准确评估疾病预后状况,从而可为临床治疗提供依据。既往研究显示,GPS联合NLR能够预测肺癌预后[18],与本研究结果相似。可能是由于mGPS、FPR均能够评估病人预后,但联合应用mGPS与FPR更具有互补作用。
综上所述,术前mGPS异常、高FPR的胸腔镜肺叶切除术肺癌病人生存率显著降低,二者均异常者生存率更低,mGPS联合FPR有望作为评估肺癌病人预后的有效指标。本研究样本量较小,更多结果需进一步研究。
