叉头框蛋白Q1和细胞周期蛋白D1在非小细胞肺癌组织中的表达与临床病理特征及预后的关系
2022-06-14叶彬向秋金文杰
叶彬 向秋 金文杰
肺癌分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),NSCLC占肺恶性肿瘤的80%左右[1-2]。NSCLC预后依然较差[3]。叉头框蛋白Q1(forkhead box Q1,FOXQ1)是一个具有高度保守的叉头框(FOX)结构的转录因子,在肿瘤的侵袭和远处转移过程中起重要作用[4]。细胞周期蛋白D1(CyclinDl)是肿瘤细胞增殖周期G1、S期限制点的调控因子,与肿瘤发生发展有关[5]。本研究探讨FOXQ1和CyclinDl两种因子在NSCLC组织中的表达与临床病理特点、预后的相关性,以及二者是否存在相关性、二者联合检测对NSCLC预后分析的意义。
对象与方法
一、对象
2014年12月~2017年10月我院胸心外科确诊并接受根治性手术的NSCLC病人196例,选取NSCLC组织作为观察组,同时选取癌旁组织(距肿瘤边缘>5cm)作为对照组。纳入标准:(1)均符合原发性肺癌诊疗规范(2018年版)中肺癌手术适应证和禁忌证,且经术后病理诊断为NSCLC;(2)均行肺癌根治性切除术;(3)有完整详细的临床随访资料和病理诊断资料;(4)术前未接受免疫治疗、放化疗或靶向治疗;(5)死亡原因均为肺癌;(6)病人或家属签署知情同意书。排除标准:术前接受新辅助治疗;合并有其他原发性肿瘤;行姑息性手术;随访资料缺失。196例病人中男147例,女49例;年龄33~76岁,平均年龄(54.97±9.76)岁;中高分化125例,低分化71例;鳞癌72例,腺癌90例,其他类型34例;已发生淋巴结转移112例,无淋巴结转移84例;Ⅰ期50例,Ⅱ期75例,Ⅲ期63例,Ⅳ期8例。
二、方法
1.检测方法:采用EnVisio法检测组织中FOXQ1和CyclinDl蛋白的表达。石蜡切片,经抗原修复、清除内源性过氧化物酶、血清封闭后,滴加FOXQ1、CyclinDl抗体进行一抗孵育,后加入生物素标记进行二抗孵育,通过DAB显色及复染后完成免疫组织化学染色。结果判断:两种蛋白阳性显色为浅黄色至棕黄色颗粒。根据染色强度与染色阳性细胞百分比对结果进行评定。随机观察5个高倍镜(×400)视野进行计数,每个视野计数≥1000个细胞。染色细胞百分率评分:阳性细胞率≤10%为0分,11%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;染色强度评分:浅黄色为1分,棕黄色为2分,棕褐色为3分。表达结果为2项乘积,0~3分为低或无表达,4~12分为高表达。
2.随访:采用来院就诊或电话随访。随访截至2020年8月31日,随访时间1~60个月。随访内容为病人无进展生存期(progression-free survival, PFS)和总体生存时间(overall survival, OS)。PFS为手术开始至第1次肿瘤出现继发性生长的时间;OS为手术开始至末次随访或死亡的时间。
三、统计学处理
采用SPSS22.0软件分析数据。计数资料以例(%)表示,组间比较采用χ2检验。采用Spearman秩相关分析FOXQ1与CyclinD1在NSCLC组织中表达的相关性。采用Cox比例风险模型进行单因素和和多因素分析,生存率分析采用Kaplan-Meier法,比较采用Log-rank检验。P<0.05为差异有统计学意义。
结果
1.FOXQ1、CyclinDl蛋白在NSCLC和癌旁组织中表达比较见表1和图1。NSCLC组织中FOXQ1、CyclinDl蛋白高表达率高于癌旁组织,差异有统计学意义(P<0.05)。
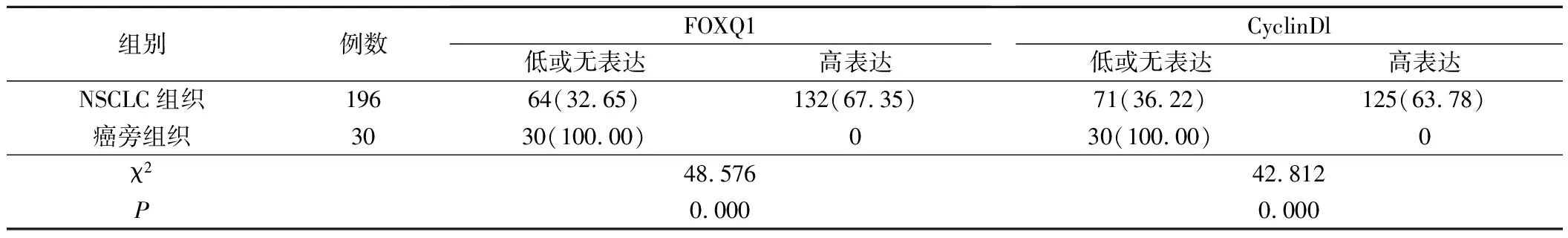
表1 FOXQ1、CyclinDl蛋白在NSCLC和癌旁组织中表达(例,%)
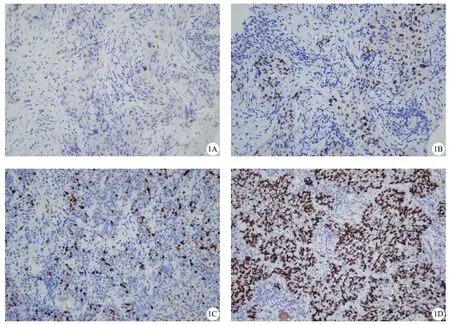
A:FOXQ1蛋白在NSCLC组织中高表达;B:FOXQ1蛋白在NSCLC组织中低表达;C:CyclinDl蛋白在NSCLC组织中高表达;D:CyclinDl蛋白在NSCLC组织中低表达
2.NSCLC病人FOXQ1、CyclinDl蛋白表达情况与临床病理特征的关系:NSCLC组织中FOXQ1、CyclinDl高表达与年龄、性别、吸烟、病理类型、肿瘤大小无关(P>0.05),与病理分化程度、临床分期、淋巴结转移相关(P<0.05)。见表2。
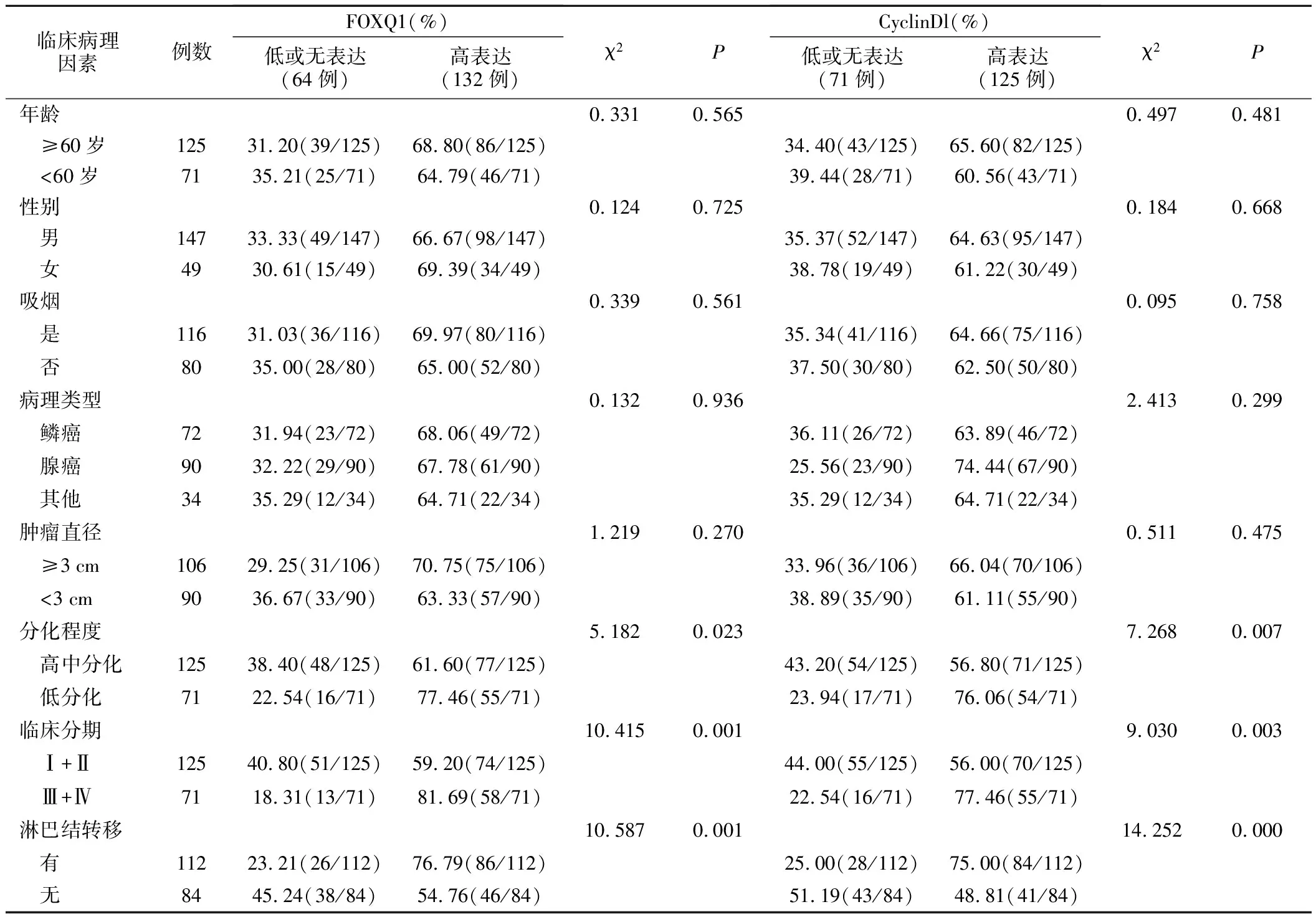
表2 FOXQ1、CyclinDl蛋白表达与NSCLC病人临床病理特征的关系
3.NSCLC组织中FOXQ1和CyclinDl蛋白的相关性分析:在NSCLC组织中,FOXQ1和CyclinDl蛋白均为高表达的有89例,FOXQ1和CyclinDl蛋白均为无或低表达的有30例,FOXQ1高表达和CyclinDl蛋白无或低表达的有41例 ,FOXQ1无或低表达和CyclinDl高表达的有36例。Spearman等级相关性分析显示,在NSCLC组织中,FOXQ1和CyclinDl蛋白的表达情况呈正相关(r=-0.639,P<0.001)。
4.预后影响因素分析:采用Cox比例风险回归模型对影响NSCLC根治术病人PFS和OS的因素进行分析。影响NSCLC根治术病人PFS的单因素分析显示,病理分化程度、临床分期、淋巴结转移、FOXQ1高表达、CyclinDl高表达、FOXQ1高表达+CyclinDl高表达均与病人PFS有关(P<0.05);为了排除各因素之间的相互影响,将单因素分析中有意义的变量纳入多因素分析显示,临床分期、淋巴结转移、FOXQ1高表达、CyclinDl高表达、FOXQ1高表达+CyclinDl高表达均是影响病人PFS的独立危险因素(P<0.05)。见表3。影响NSCLC根治术病人OS的单因素分析显示,病理分化程度、临床分期、淋巴结转移、FOXQ1高表达、CyclinDl高表达、FOXQ1高表达+CyclinDl高表达均与病人OS有关(P<0.05);为了排除各因素之间的相互影响,将单因素分析中有意义的变量纳入多因素分析显示,临床分期、淋巴结转移、FOXQ1高表达、CyclinDl高表达、FOXQ1高表达+CyclinDl高表达均影响病人OS的独立危险因素(P<0.05)。见表4。
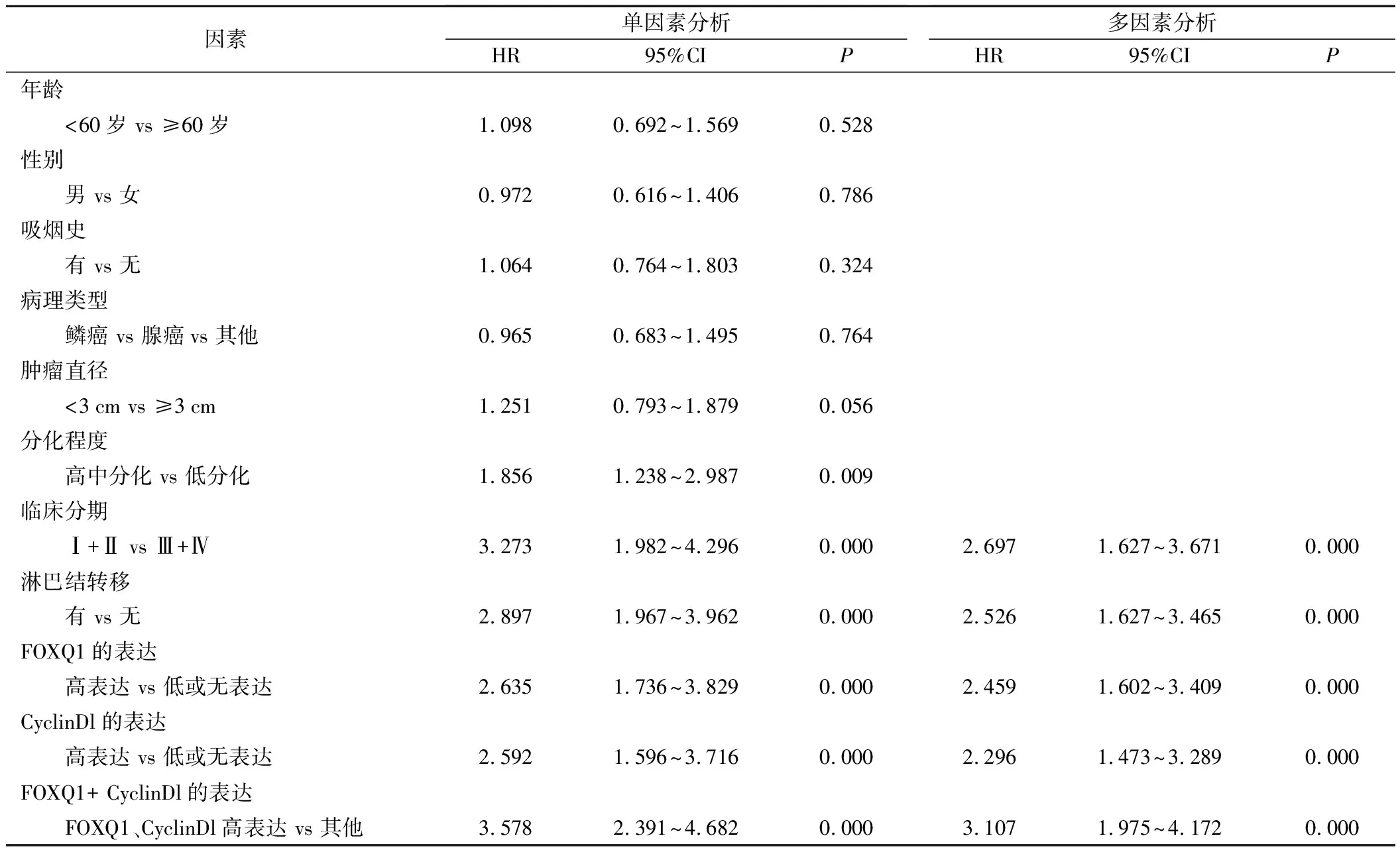
表3 PFS的单因素和多因素分析
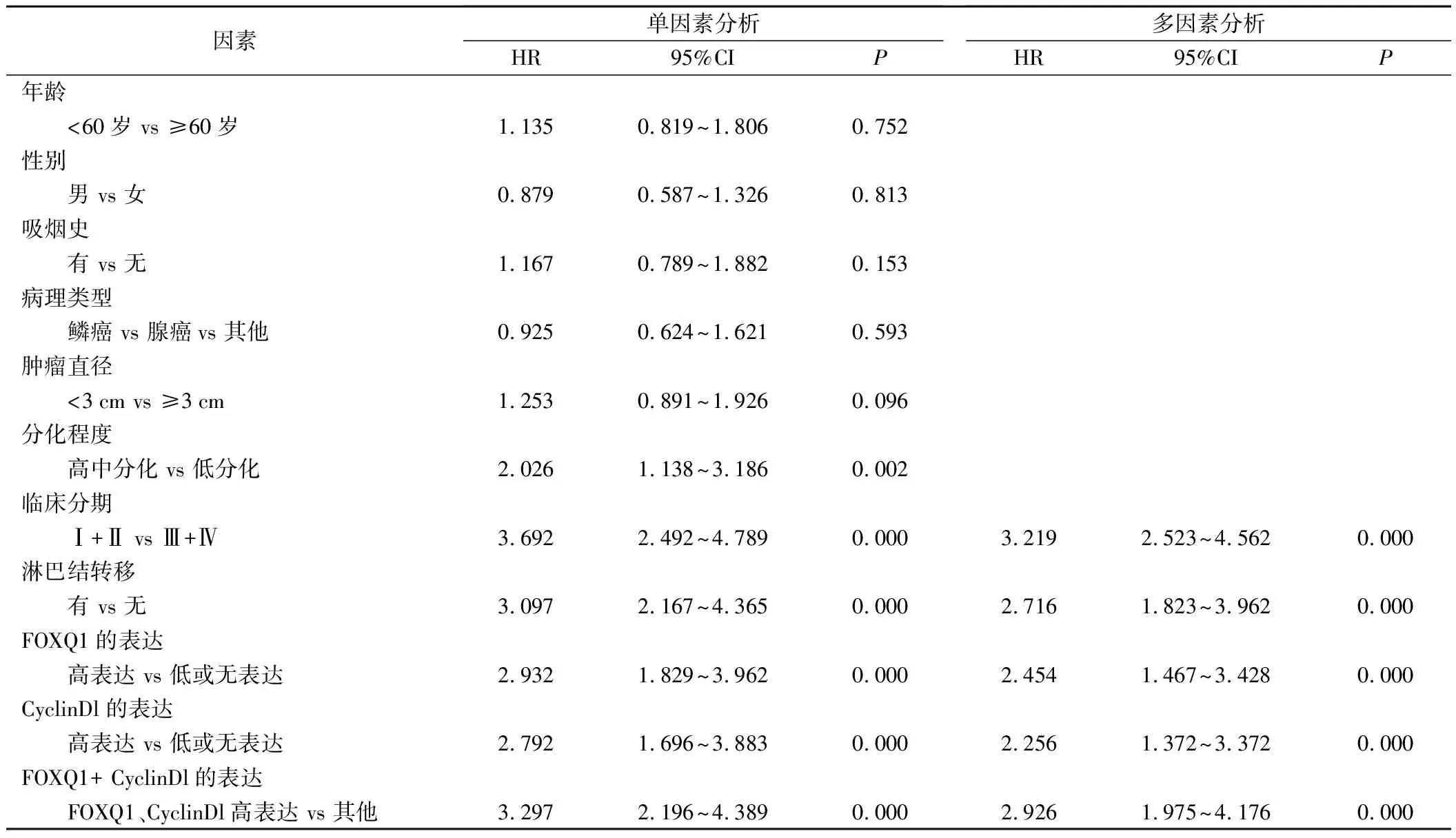
表4 OS的单因素和多因素分析
5.生存分析:196例非小细胞肺癌病人中,死亡94例,生存102例。Kaplan-Meier分析显示,FOXQ1高表达病人PFS、OS短于低或无表达组(χ2=6.328、6.107,P=0.012);CyclinDl高表达病人PFS、OS短于低或无表达组(χ2=4.983、5.550,P=0.026); FOXQ1、CyclinDl两者高表达病人PFS、OS短于其他病人(χ2=145.248、122.599,P=0.006);FOXQ1、CyclinDl两者高表达病人PFS、OS短于FOXQ1、CyclinDl单独高表达病人(χ2=35.269、36.104,P=0.006)。见图2、3。
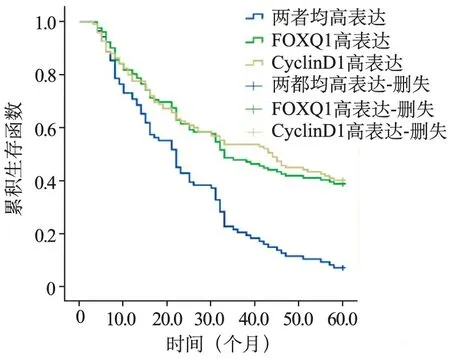
图2 两者高表达病人和FOXQ1、CyclinDl单独高表达病人的PFS生存曲线
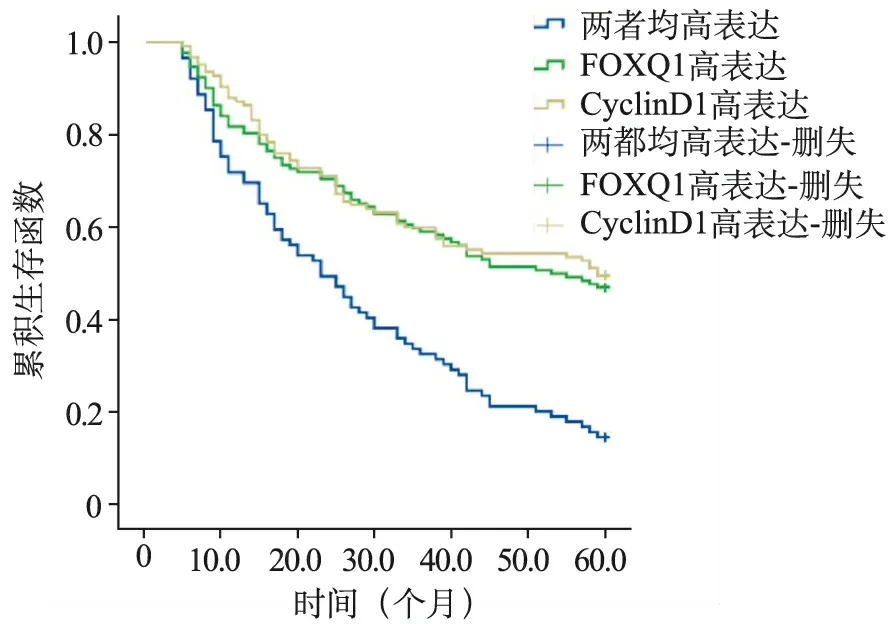
图3 两者高表达病人和FOXQ1、CyclinDl单独高表达病人的OS生存曲线
讨论
FOXQ1是转录因子家族成员之一,在多种组织中广泛表达,可通过识别并结合相关下游靶基因的近端或远端顺式作用元件,实现对众多下游靶基因表达水平的正向或负向调控[6-8]。Fan等[9]研究报道,FOXQ1是恶性肿瘤中wnt信号通路的新的激活标志物。基因共表达分析发现,在肝癌[10]、乳腺癌、结直肠癌、胃癌及胰腺癌等多种恶性肿瘤中,癌细胞中FOXQ1高表达与wnt信号通路活化相关[11-14]。FOXQ1在NSCLC中发挥重要作用,其可通过结合上皮间质转化重要调控分子上皮型E-钙黏蛋白(E-cadherin)的基因启动子区E-box来转录来抑制E-cadherin的表达,从而降低细胞间的黏附力,促进细胞游离及延伸生长,促进肿瘤细胞脱离原发灶,进而发生浸润和转移[15]。大量研究表明,在胃癌、肝癌、乳腺癌及结肠癌组织中FOXQ1蛋白高表达,预示着病人预后不良[13,10-11]。
恶性肿瘤是一种细胞周期疾病,在遗传突变和环境改变的影响下,基因突变及染色体异常分离导致细胞周期异常调控以至于细胞恶性增殖形成肿瘤[16]。Cyclins是一个与细胞周期相关的核蛋白家族,是细胞周期调节的核心分子,其在细胞增殖调节中发挥着重要作用[17-18]。Cyclin D1主要通过激活G1期特有的周期蛋白依赖依赖性激酶CDK4并结合,然后使G1期周期抑制蛋白磷酸化,被磷酸化的周期抑制蛋白会与与其结合的E2F转录因子分离,进而就会推动细胞周期由G1期进入到S期[19]。有研究表明,Cyclin D1在肿瘤组织中表达增强,Cyclin D1是细胞周期G1期中衡量表达的癌基因,其过量表达可引发G1期时间减少、加速细胞分裂,诱发细胞增殖失控而恶化,与肿瘤的发生发展密切相关[20]。有研究表明,Cyclin D1蛋白在鼻咽癌、乳腺癌和胃癌等恶性肿瘤中均呈高表达,在NSCLC细胞中,抑制Cyclin D1的表达后能够使细胞的增殖发生阻碍[21-23]。本研究结果表明,NSCLC组织中CyclinDl蛋白高表达率高于癌旁组织;NSCLC组织中CyclinDl高表达与病理分化程度、临床分期、淋巴结转移相关;Cox回归分析显示,CyclinDl是影响NSCLC病人PFS和OS的独立危险因素;Kaplan-Meier分析显示,CyclinDl高表达组病人PFS和OS低于低或无表达组。结果表明,CyclinD 1高表达与NSCLC的发生、发展和预后密切相关。
Spearman相关性分析显示,在NSCLC组织中,FOXQ1和CyclinDl蛋白的表达情况呈正相关;Cox回归分析显示,FOXQ1和CyclinDl两者均高表达是影响NSCLC病人PFS和OS的独立危险因素;Kaplan-Meier分析显示,FOXQ1、CyclinDl两者高表达病人PFS和OS低于其他病人;FOXQ1、CyclinDl两者高表达病人PFS和OS低于FOXQ1、CyclinDl单独一种高表达病人。结果表明,FOXQ1可能通过调控CyclinDl,参与细胞周期调节,促进肿瘤细胞增殖,在NSCLC的发生发展中起作用。两者联合检测可应用于临床判断NSCLC的转移潜能及病人的预后。
