动态血糖监测系统对老年非糖尿病患者频发低血糖的诊断价值
2022-06-13王丽娜李媛媛屈小伶张炜
王丽娜,李媛媛,屈小伶,张炜
首都医科大学附属北京友谊医院医疗保健中心,北京 100050
低血糖属于代谢性疾病,对于非糖尿病患者而言,其发生风险较低,但发病原因较复杂,可能与药物性低血糖、胰岛素瘤、自身免疫性疾病等疾病有关[1]。低血糖的危害在于可进一步增加老年群体心脑血管疾病患病风险,损害其心脑等器官,同时还会减弱记忆力、智力与反应力,增加痴呆风险。因此,完善老年低血糖诊疗方案十分必要[2]。目前,临床常用饥饿试验、口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)进行血糖代谢检查,但上述检查方式采血操作频繁,且低血糖诊断效能不够理想,仍存在一定局限性[3]。进一步完善老年非糖尿病患者低血糖诊断方案,需获取更多单位时间内血糖波动信息[4]。相关研究[5]提到,动态血糖监测系统(dynamic glucose monitoring system,DGMS)可实时提供更准确的即刻血糖值与血糖变化趋势,进而为患者是否频发低血糖提供临床参考依据,但其在老年非糖尿病患者低血糖诊断中应用不足,仍有待完善。本研究拟借鉴既往经验,在传统血糖监测基础上启动DGMS,同时收集患者的各项资料,旨在明确DGMS 的临床应用与推广价值,为诊断低血糖提供方法。
1 资料与方法
1.1 一般资料
选择2019年3月—2021年3月在首都医科大学附属北京友谊医院接受诊治的101 例老年非糖尿病低血糖患者为研究对象。101 例老年患者根据不同病因分为37 例药物性低血糖、28 例胰岛素瘤、14 例胰岛素自身免疫综合征(insulin autoimmune syndrome,IAS)、12 例胰岛细胞增生、10 例先天性高胰岛素血症(congenital hyperinsulinism,CHI)。其中药物性低血糖患者主要是因服用水杨酸盐类、磺胺类抗生素所致,分别为21 例、16 例;纳入标准:(1)年龄≥60 岁;(2)发作时血糖<2.8 mmol/L,临床可能表现有出汗、饥饿、心慌、颤抖、面色苍白等症状;(3)供糖后低血糖症状出现迅速缓解;(4)其中胰岛素瘤及胰岛细胞增生通过手术病理确诊;(5)临床各项资料记录完整详实;(6)患者对本项研究知情,并签署知情同意书。符合以上所有标准的病例纳入本研究。排除标准:(1)确诊恶性肿瘤疾病;(2)确诊自身免疫性疾病或凝血功能异常;(3)近半年使用激素类药物;(4)确诊神经类精神疾病或认知障碍;(5)研究中途退出者。具备以上任意1 项标准的病例不纳入本研究。
1.2 方法
1.2.1 临床资料 (1)收集与整理包括患者的性别、年龄、体质量指数(body mass index,BMI)、糖化血红蛋白(glycated hemoglobin,HbAlc)指标等资料;(2)患者入院后接受5 h OGTT(口服含75 g 无水葡萄糖的水溶液,于试验开始后2 h、3 h、4 h 和5 h 采血,测其血糖变化)、饥饿试验(禁食48 ~72 h)与DGMS 监测血糖水平,患者在5 h OGTT 试验中服用糖前需完成HbAlc 及其他常规检查指标检测;饥饿试验过程中,定期(次/4 h)监测血糖,当血糖<3.3 mmol/L,抽取2 mL 静脉血,检查血糖、胰岛素、C 肽等指标,静脉血检测结果反馈血糖<3.0 mmol/L 且达到2 次以上,停止饥饿试验及不再进行静脉采血,如饥饿试验24 h后未见低血糖发作,指导患者试验24 h、36 h、48 h 后各完成2 h 的医嘱运动,如饥饿试验72 h 时及加做运动后仍未见低血糖发作,检查血糖、胰岛素、C 肽等指标,并终止试验。
1.2.2 DGMS 监测方法 使用DGMS 对患者进行持续性血糖监测(时间≥72 h),将DGMS 探头置于上臂皮下,每3 min 自动记录血糖数据1 次,每日可获得480 次血糖数据。分析DGMS 所获得的血糖数据,计算血糖总平均值、血糖标准差、血糖谱分布等参数,并以6:00 ~22:00 为日间血糖,以22:00 ~次日6:00为夜间血糖进行日夜血糖谱分析。
1.2.3 观察指标与方法 (1)临床资料收集:包括性别、年龄、BMI、HbAlc;(2)血糖检测:分析不同病因低血糖老年患者5 h OGTT 与饥饿试验血糖检测结果;(3)一般情况:对比不同病因低血糖老年患者的DGMS一般情况;(4)DGMS 血糖谱分布情况:对比不同病因低血糖老年患者的DGMS 血糖谱分布,包括血糖>11.1 mmol/L、7.8 mmol/L <血糖≤11.1 mmol/L、3.9 mmol/L <血糖≤7.8 mmol/L、3.0 mmol/L <血糖≤3.9 mmol/L、血糖≤3.0 mmol/L 等5 个区间的分布构成比,构成比= (DGMS 监测过程中血糖指标达到该分布区间的患者例数/总例数) ×100%;(5)日夜平均血糖检测:对比不同病因低血糖老年患者的日夜平均血糖。
1.3 统计学分析
使用统计学软件SPSS 21.0 分析数据。正态分布且方差齐性的计量资料以均数±标准差(±s)表示,多组比较采用方差分析,组内比较用配对样本t检验;以例数和百分率表示计数资料,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 不同病因低血糖老年患者的临床资料比较
根据不同病因分为药物性低血糖、胰岛素瘤、IAS、胰岛细胞增生、CHI 共5 组。5 组性别、年龄、BMI差异均无统计学差异意义(P>0.05);HbAlc:CHI <药物性低血糖<胰岛素瘤、胰岛细胞增生<IAS(P<0.05),胰岛素瘤、胰岛细胞增生患者HbAlc 对比,差异均无统计学意义(P>0.05)。见表1。
表1 不同病因低血糖老年患者的临床资料比较(±s)

表1 不同病因低血糖老年患者的临床资料比较(±s)
注:与药物性低血糖比较,△P <0.05;与胰岛素瘤比较,▲P <0.05;与IAS 比较,※P <0.05;与胰岛细胞增生比比较,#P <0.05。
组别性别(例)男女年龄(岁) BMI(kg/m2) HbAlc(%)药物性低血糖(n=37) 20 17 61 ~78(70.1 ±7.2) 25.14 ±5.39 4.59 ±0.33胰岛素瘤(n=28) 15 13 61 ~77(69.8 ±6.9) 25.03 ±5.47 5.48 ±0.42△IAS(n=14) 8 6 60 ~78(69.4 ±6.9) 24.96 ±4.81 7.15 ±0.47△▲胰岛细胞增生(n=12) 6 6 60 ~80(70.3 ±7.1) 26.11 ±5.03 5.42 ±0.39△※CHI(n=10) 6 4 60 ~79(69.5 ±7.2) 25.82 ±5.28 3.61 ±0.19△▲※#
2.2 不同病因低血糖老年患者5 h OGTT 与饥饿试验血糖检测结果分析
在OGTT 检查中,胰岛素瘤、胰岛细胞增生患者于试验4 ~5 h 时检出血糖平均浓度<3.0 mmol/L;而CHI 患者试验全程血糖平均浓度<3.0 mmol/L。在72 h 饥饿试验中,仅5 例胰岛素瘤患者被诱发低血糖。见表2。
表2 不同病因低血糖老年患者5 h OGTT 检测结果分析(±s)
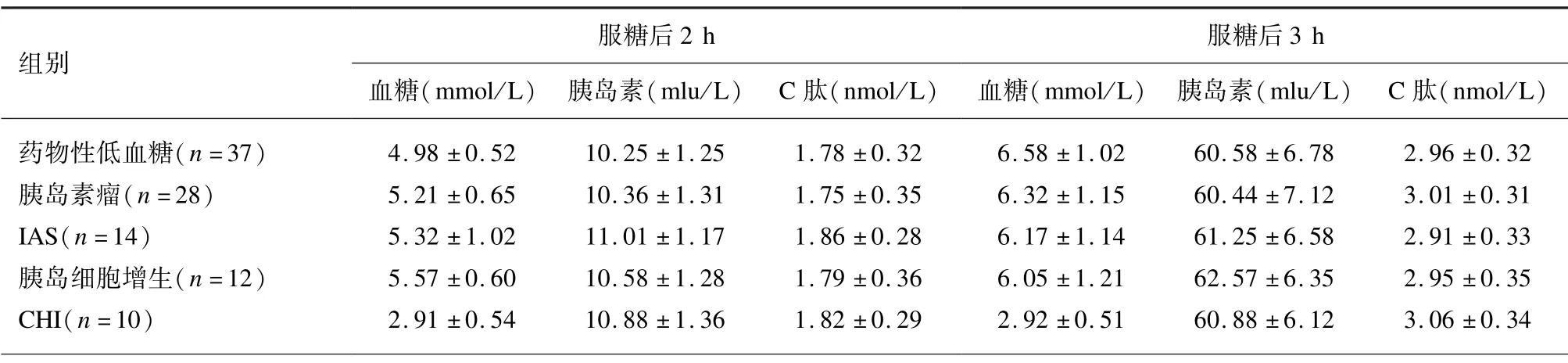
表2 不同病因低血糖老年患者5 h OGTT 检测结果分析(±s)
组别服糖后2 h血糖(mmol/L) 胰岛素(mlu/L) C 肽(nmol/L)服糖后3 h血糖(mmol/L) 胰岛素(mlu/L) C 肽(nmol/L)药物性低血糖(n=37) 4.98 ±0.52 10.25 ±1.25 1.78 ±0.32 6.58 ±1.02 60.58 ±6.78 2.96 ±0.32胰岛素瘤(n=28) 5.21 ±0.65 10.36 ±1.31 1.75 ±0.35 6.32 ±1.15 60.44 ±7.12 3.01 ±0.31 IAS(n=14) 5.32 ±1.02 11.01 ±1.17 1.86 ±0.28 6.17 ±1.14 61.25 ±6.58 2.91 ±0.33胰岛细胞增生(n=12) 5.57 ±0.60 10.58 ±1.28 1.79 ±0.36 6.05 ±1.21 62.57 ±6.35 2.95 ±0.35 CHI(n=10) 2.91 ±0.54 10.88 ±1.36 1.82 ±0.29 2.92 ±0.51 60.88 ±6.12 3.06 ±0.34
2.3 不同病因低血糖老年患者的DGMS 一般情况比较
5 组DGMS 监测时长差异均无统计学差异(P>0.05);平均血糖:CHI <胰岛素瘤、胰岛细胞增生<药物性低血糖<IAS(P<0.05),提示其他4 组低血糖症状优于CHI 患者,胰岛素瘤、胰岛细胞增生之间平均血糖对比差异无统计学意义(P>0.05);IAS 患者最大血糖波动幅度大于其他4 组(P<0.05),其他4 组患者之间最大血糖波动幅度对比差异无统计学意义(P>0.05),提示其他4 组血糖代谢稳定性优于IAS患者。见表3。
表3 不同病因低血糖老年患者的DGMS 一般情况比较(±s)
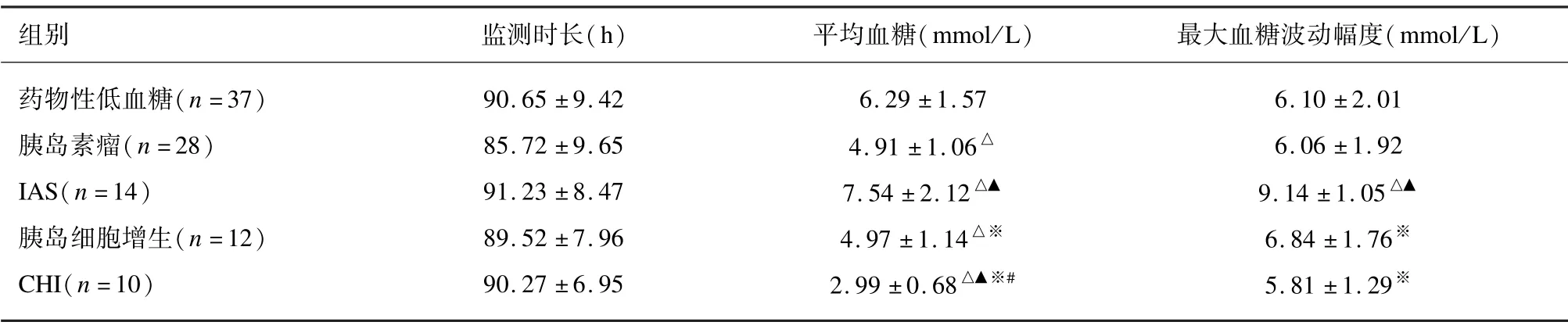
表3 不同病因低血糖老年患者的DGMS 一般情况比较(±s)
注:与药物性低血糖比,△P <0.05;与胰岛素瘤比较,▲P <0.05;与IAS 比较,※P <0.05;与胰岛细胞增生比比较,#P <0.05。
组别 监测时长(h) 平均血糖(mmol/L) 最大血糖波动幅度(mmol/L)药物性低血糖(n=37) 90.65 ±9.42 6.29 ±1.57 6.10 ±2.01胰岛素瘤(n=28) 85.72 ±9.65 4.91 ±1.06△ 6.06 ±1.92 IAS(n=14) 91.23 ±8.47 7.54 ±2.12△▲ 9.14 ±1.05△▲胰岛细胞增生(n=12) 89.52 ±7.96 4.97 ±1.14△※ 6.84 ±1.76※CHI(n=10) 90.27 ±6.95 2.99 ±0.68△▲※# 5.81 ±1.29※
2.4 不同病因低血糖老年患者的DGMS 血糖谱分布比较
IAS 患者血糖>11.1 mmol/L 构成比高于药物性低血糖(P<0.05);7.8 mmol/L <血糖≤11.1 mmol/L构成比:CHI <胰岛细胞增生<胰岛素瘤<药物性低血糖<IAS(P<0.05);3.9 mmol/L <血糖≤7.8 mmol/L构成比:CHI <IAS <胰岛素瘤<药物性低血糖、胰岛细胞增生(P<0.05);3.0 mmol/L <血糖≤3.9 mmol/L构成比:药物性低血糖<IAS <胰岛细胞增生<胰岛素瘤<CHI(P<0.05);血糖≤3.0 mmol/L 构成比:IAS、药物性低血糖<胰岛素瘤、胰岛细胞增生<CHI(P<0.05),提示IAS、药物性低血糖患者低血糖发生率高于其他3 组。见表4。
表4 不同病因低血糖老年患者的DGMS 血糖谱分布比较(±s)

表4 不同病因低血糖老年患者的DGMS 血糖谱分布比较(±s)
注:与药物性低血糖比,△P <0.05;与胰岛素瘤比较,▲P <0.05;与IAS 比较,※P <0.05;与胰岛细胞增生比比较,#P <0.05。
组别 血糖>11.1 mmol/L(%)7.8 mmol/L <血糖≤11.1 mmol/L(%)3.9 mmol/L <血糖≤7.8 mmol/L(%)3.0 mmol/L <血糖≤3.9 mmol/L(%)血糖≤3.0 mmol/L(%)药物性低血糖(n=37) 1.45 ±0.33 15.89 ±4.66 78.14 ±10.32 4.54 ±1.12 1.28 ±0.39胰岛素瘤(n=28) 0 3.08 ±0.54△ 69.98 ±10.56△ 22.71 ±4.26△ 10.54 ±2.72△IAS(n=14) 10.62 ±3.57a 31.47 ±1.28△▲ 53.27 ±3.49△▲ 6.95 ±1.98△▲ 1.06 ±0.15▲胰岛细胞增生(n=12) 0 1.99 ±0.31△▲※ 77.41 ±10.32▲※ 12.37 ±3.11△▲※ 10.97 ±2.99△※CHI(n=10) 0 0.97 ±0.19△▲※# 20.52 ±4.77△▲※# 39.79 ±10.15△▲※# 60.75 ±9.54△▲※#
2.5 不同病因低血糖老年患者的日夜平均血糖比较
5 组患者日间平均血糖高于夜间平均血糖(P<0.05);日间平均血糖:CHI <药物性低血糖、胰岛细胞增生<胰岛素瘤<IAS(P<0.05);夜间平均血糖:CHI <药物性低血糖、胰岛细胞增生<胰岛素瘤<IAS(P<0.05),提示其他4 组日、夜间低血糖症状均优于CHI 患者。见表5。
表5 不同病因低血糖老年患者的日夜平均血糖比较(±s,mmol/L)

表5 不同病因低血糖老年患者的日夜平均血糖比较(±s,mmol/L)
注:与药物性低血糖比,△P <0.05;与胰岛素瘤比较,▲P <0.05;与IAS 比较,※P <0.05;与胰岛细胞增生比比较,#P <0.05。
组别日间平均血糖 夜间平均血糖 t P药物性低血糖(n=37) 5.17 ±1.03 4.42 ±0.95 3.256 0.002胰岛素瘤(n=28) 6.87 ±2.11△ 5.61 ±1.09△ 3.227 0.002 IAS(n=14) 8.12 ±2.17△▲ 6.34 ±1.18△▲ 4.383 0.001胰岛细胞增生(n=12) 5.25 ±1.26▲※ 4.08 ±0.97▲※ 4.476 0.001 CHI(n=10) 3.12 ±0.64△▲※# 2.75 ±0.61△▲※# 2.546 0.013
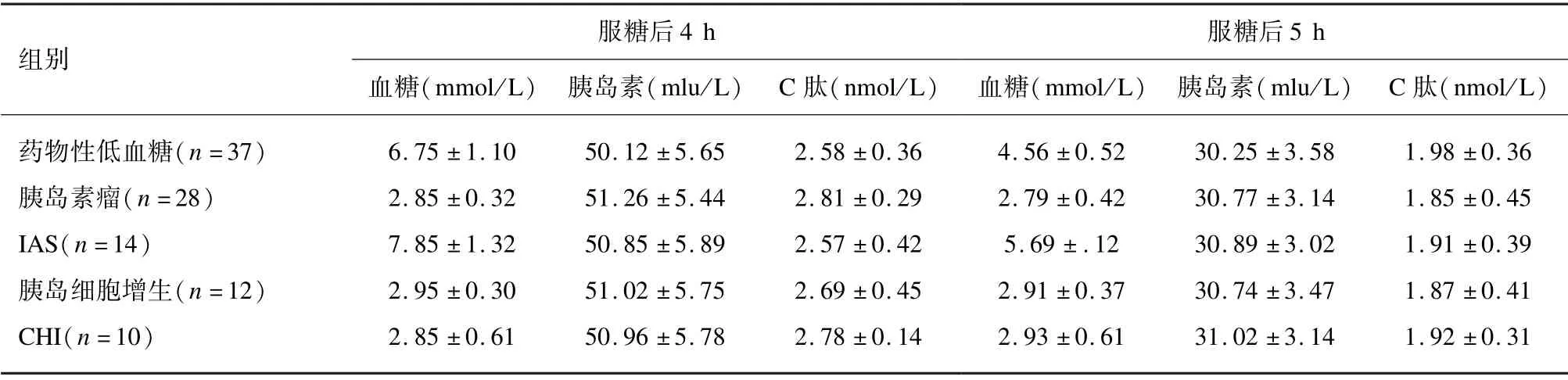
表2(续)
3 讨论
DGMS 可通过置入皮下葡萄糖感应器了解机体内部血糖水平,并能够全面保持持续性的血糖数据处理,分析血糖波动趋势,进而帮助临床工作者了解患者餐前餐后的血糖代谢水平与规律,并有利于后续饮食结构的调整,保证患者获得科学、健康的营养摄入[6-7]。此外,DGMS 每日定时记录患者血糖波动水平,可帮助临床工作者更清晰、客观地认识患者的饮食需求、用药需求与运动需求,并给予适当护理指导[8]。为提高低血糖临床控制效率,有必要加强血糖监测管理工作,既往研究资料表明,DGMS 在糖尿病患者群体的血糖监控中发挥了一定价值,但其在非糖尿病低血糖患者血糖管理中的效果仍有待结合更多患者进行验证[9-10]。本研究拟对101 例源自不同疾病的非糖尿病患者展开DGMS,并观察其72 h 内的血糖变化情况,以期获得不同疾病的低血糖发病风险资料和相应的血糖波动资料,为后续血糖管理方案积累临床经验。
本研究结果显示,在OGTT 检查中,胰岛素瘤、胰岛细胞增生患者在试验4 ~5 h 时检出血糖平均浓度<3.0 mmol/L;而CHI 患者试验全程血糖平均浓度<3.0 mmol/L;在72 h 饥饿试验中,仅5 例胰岛素瘤患者被诱发低血糖。上述结果说明,传统临床常规血糖监测方案仅能检出部分患者的低血糖及相对应的病因,尤其是胰岛素瘤、胰岛细胞增生、CHI 患者,但无法提供其他2 组患者或更全面的低血糖诊断数据,秦亚丽等[11]的研究也指出了这一局限性。而DGMS 结果显示,平均血糖:CHI <胰岛素瘤、胰岛细胞增生<药物性低血糖<IAS,另外IAS 患者最大血糖波动幅度大于其他4 组,表明CHI 患者低血糖发生率最高,而IAS 患者血糖代谢紊乱较为明显,提示在后续血糖控制治疗中,应针对性加强CHI、IAS 两类型患者的血糖监测与管理。胰岛素瘤、胰岛细胞增生患者平均血糖对比差异无统计学意义,这与2 组患者疾病表现机制相似有关,两者均会导致机体过度释放胰岛素,进而引发低血糖。刘义欣等[12]的研究部分支持了该结论。进一步分析5 组患者72 h 内平均血糖不同指标区间的构成比,由于DGMS 对5 组患者进行72 h 的血糖监测包括餐前、餐后血糖水平,因此部分患者餐后血糖可能会异常升高。研究发现,IAS 患者血糖>11.1 mmol/L构成比高于药物性低血糖;7.8 mmol/L <血糖≤11.1 mmol/L 构成比:CHI <胰岛细胞增生<胰岛素瘤<药物性低血糖<IAS,3.9 mmol/L <血糖≤7.8 mmol/L 构成比:CHI <IAS <胰岛素瘤<药物性低血糖、胰岛细胞增生。对IAS 患者而言,其体内C肽、胰岛素原水平不足,空腹时可发生难治性低血糖,同时部分患者还表现为高血糖、低血糖交替发作[13]。Censi 等[14]研究指出,IAS 患者高、低血糖交替发作的原因在于胰岛素与肝脏、外周组织受体结合敏感性降低,胰岛素生理作用无法正常发挥,出现高血糖,此外患者自身抗体又会与胰岛素解离,在短时间内激发其生理作用,导致低血糖。3.0 mmol/L <血糖≤3.9 mmol/L构成比:药物性低血糖<IAS <胰岛细胞增生<胰岛素瘤<CHI,药物性低血糖患者发病原因可能与药物导致的胰岛素敏感、药物导致的胰岛素代谢清除下降等有关,因此在服用某些影响糖代谢的药物过程中需严格监测血糖,尽可能避免药物性低血糖发生[15]。血糖≤3.0 mmol/L 构成比:IAS、药物性低血糖<胰岛素瘤、胰岛细胞增生<CHI,结果提示CHI 患者低血糖发病频率最高,该病属于遗传性障碍,临床治愈率较低,且极易诱发低血糖症[16]。目前该疾病的治疗性药物包括长效奥曲肽、胰高血糖素样肽1 受体拮抗剂、西罗莫司等[17]。CHI 与机体内部谷氨酸脱氢酶中的氨基酸错义突变有关,进而损害酶抑制作用,导致机体过度分泌胰岛素[18]。这与廖静等[19]的研究部分一致。本研究还发现,5 组患者日间平均血糖高于夜间平均血糖;日间平均血糖:CHI <药物性低血糖、胰岛细胞增生<胰岛素瘤<IAS;夜间平均血糖:CHI <药物性低血糖、胰岛细胞增生<胰岛素瘤<IAS,均证明DGMS 可以有效检出5 组患者的低血糖发病率。此外,本研究仍存在一定不足,如样本量较少、样本来源具有区域性偏差且观察时间较短等,导致研究结论存在部分偏倚,后续仍需针对上述问题进行改进。而本研究的创新性成果在于证明了DGMS 在药物性低血糖、胰岛素瘤、IAS、胰岛细胞增生、CHI 等不同病因患者之间的血糖监测与诊断价值,即显示DGMS 可更为全面地记录与分析上述患者血糖谱分布、低血糖构成比、日夜血糖等指标之间的差异,一定程度上为其具体病因诊断提供了具有参考意义的临床信息,且受到既往部分相关研究的支持,但与本研究同类型的参考资料较少,DGMS 检测患者低血糖情况可能存在一定的误差,后期仍有待进一步收集更多相似研究展开横向比较,为DGMS 的应用价值提高更丰富的临床数据的[20-21]。
综上所述,DGMS 能够进一步为诊断老年非糖尿病患者低血糖及相关具体病因提供一定价值的临床参考依据。
