安徽某猪场猪链球菌9型的分离与鉴定
2022-06-13唐正露王嘉珍陈阳露
唐正露,王嘉珍,陈阳露,李 郁
(安徽农业大学动物科技学院,安徽 合肥 230036)
猪链球菌(Streptococcus suis, SS)是世界范围内引起猪链球菌病的最主要病原菌,可导致猪脑膜炎、心内膜炎、多发性浆膜炎、关节炎和败血症,还易与其他病原体造成混合感染[1]。根据荚膜多糖抗原性的不同,SS可分为35个血清型(1~34及1/2型),其中1/2、1、2、7、9和14型SS具有人畜共患性,以2型最为常见、致病力最强。在我国目前尚未见到SS9感染人的报道,但近年来SS9在兽医临床上的分离率逐渐上升且有扩大流行的趋势。
2021年9—10月,安徽某猪场35~40日龄的断奶仔猪临床表现发热、呼吸困难、神经症状,甚至急性死亡。本研究对送检的发病猪病料进行细菌分离与鉴定,确定该场存在SS9感染,应用多位点序列分型(multilocus sequence typing, MLST)和PCR方法测定分离到的6株SS9的ST型和毒力基因型,同时构建系统发育树以明确各分离菌株间的亲缘关系及进化情况,从而为该场有效防控猪链球菌病提供依据。
1 材料与方法
1.1 病料来源
病料为安徽某猪场送检的6份疑似发生猪链球菌病的35~40日龄断奶仔猪脑部。
1.2 主要试剂及培养基
2×Taq Mix Pro(+Dye)、DL 2 000 DNA Marker购自莫纳(武汉)生物科技有限公司;胰酪胨大豆酵母浸膏琼脂(TSA-YE)、胰酪胨大豆酵母浸膏肉汤(TSB-YE)购自杭州微生物试剂有限公司;小牛血清购自上海羽哚生物科技有限公司;无菌脱纤维兔血购自南京茂捷微生物科技有限公司;革兰氏染液购自南京建成生物工程研究所。
1.3 细菌分离培养与形态学观察
无菌采集6份发病猪脑组织分别接种于含5%小牛血清的TSA-YE培养基和含5%兔血的TSA-YE培养基,采用需氧、微需氧、厌氧3种培养方式,置于37 ℃培养12~18 h,观察细菌的生长情况,并挑取单个可疑菌落进行革兰氏染色,镜检,观察其形态特征。
1.4 引物合成
参考文献[2-3]设计SS gdh基因、SS9分型基因cps9J、毒力基因(mrp、epf、sly、orf2、fbps、gapdh)和管家基因(aroA、cpn60、dpr、gki、mutS、recA、thrA)引物,均由通用生物系统(安徽)有限公司合成,引物序列见表1。

表1 SSgdh基因、cps9J基因、毒力基因和管家基因引物信息
1.5 分离菌株的PCR鉴定
煮沸法提取6株分离菌基因组DNA作为模板,扩增SS gdh基因。PCR反应体系(25 μL):2×Taq Mix Pro(+Dye) 12.5 μL,ddH2O 6.5 μL,上、下游引物(10 μmol/L)各0.5 μL,DNA模板5 μL。PCR反应条件:94 ℃、5 min;94 ℃、1 min,55 ℃、1 min,72 ℃、1 min,35个循环;72 ℃、7 min。
1.6 SS血清型的PCR鉴定
煮沸法提取DNA模板,扩增cps9J基因。PCR反应体系(25 μL):2×Taq Mix Pro(+Dye)12.5 μL,ddH2O 5.5 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板5 μL。PCR反应条件:95 ℃、15 min;94 ℃、30 s,58 ℃、90 s,72 ℃、1 min,30个循环;72 ℃、10 min。
1.7 SS毒力基因型PCR鉴定
煮沸法提取DNA模板,扩增6株SS9的毒力基因mrp、epf、sly、orf2、fbps和gapdh。PCR反应体系同1.5。PCR反应条件:95 ℃、5 min;94 ℃、1 min,56 ℃、45 s,72 ℃、1 min,35个循环;72 ℃、10 min。
1.8 SS MLST鉴定及分析
1.8.1 6株SS9的ST型鉴定 参照安徽省地方标准DB 34/T 3488—2019鉴定SS MLST[4],对6株SS9的7个管家基因进行扩增,扩增产物由通用生物系统(安徽)有限公司进行双向测序。将测序结果上传至SS MLST数据库(http://ssuis.mlst.net)进行分析比对,获得菌株相应管家基因等位基因编号,确定相应ST型。PCR反应体系同1.5。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,退火(退火温度见表1)30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。
1.8.2 系统发育树的构建 利用Editseq软件对1.8.1中测序结果进行序列的拼接比对,对齐序列利用MEGA 7软件构建6株SS9分离株和7株SS9参考菌株[5-6]的ST型系统进化树进行聚类分析。7株SS9参考菌株信息见表2。
表2 7株SS9参考菌株信息
2 结果
2.1 细菌分离培养及形态学观察结果
从6份病料中共分离到6株细菌,分别命名为A~F。分离株在含5%小牛血清的TSA-YE均呈灰白色半透明、表面光滑、边缘整齐针尖状菌落;在含5%兔血的TSA-YE培养基均呈灰白色、表面光滑、边缘整齐小菌落,β溶血(厌氧培养时不溶血);且在需氧、厌氧环境中培养时,细菌生长速度较微需氧培养时快;革兰氏染色后镜检,分离株均为革兰氏阳性菌,呈球形或卵圆形,链状排列,符合SS的培养及形态学特性(图1)。

图1 分离株培养特性及形态学特性
2.2 分离菌株PCR鉴定结果
A~F分离株均扩增出SS gdh基因(688 bp),表明A~F分离株均为SS(图2)。
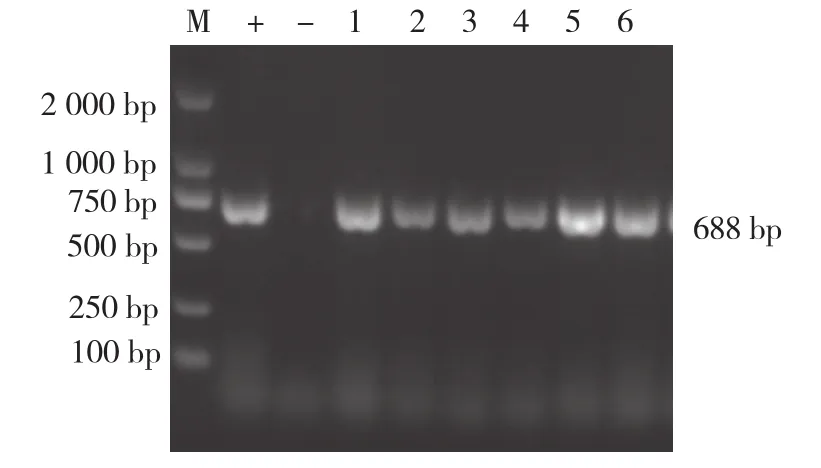
图2 A~F分离株SS的PCR鉴定结果
2.3 SS血清型PCR鉴定结果
A~F SS分离株均扩增出cps9J基因(368 bp),表明A~F SS分离株均为SS9(图3)。
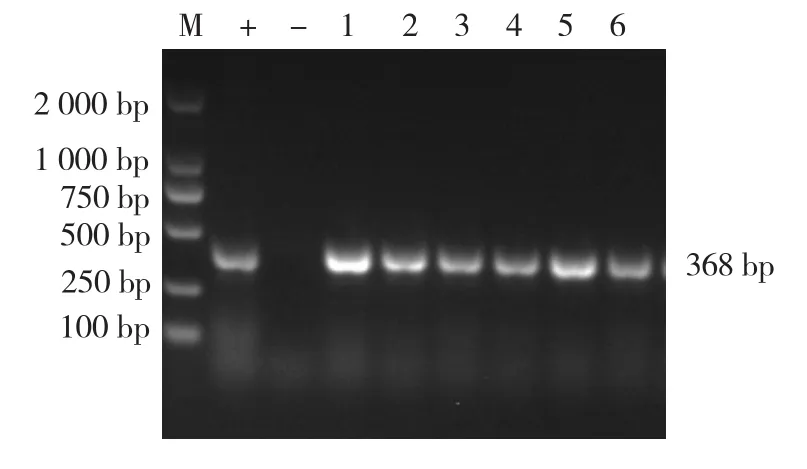
图3 6株SS分离株血清9型的PCR鉴定结果
2.4 SS毒力基因型PCR鉴定结果
6株SS9有3种毒力基因型,其中A、D分离株的毒力基因型相同,为epf-mrp+sly+gapdh+fbps+orf2-;B、C分离株的毒力基因型相同,为epf-mrp+slygapdh+fbps+orf2-;E、F分离株的毒力基因型相同,为epf-mrp+sly+gapdh+fbps+orf2+(图4)。
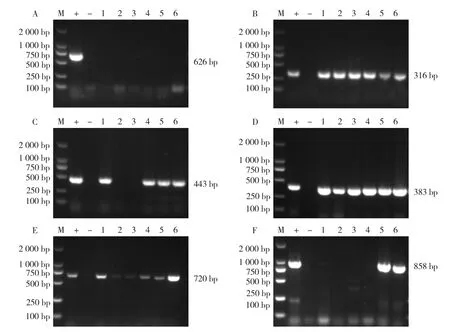
图4 6株SS9毒力基因PCR鉴定结果
2.5 SS MLST鉴定及分析结果
2.5.1 SS MLST鉴定结果 利用特异性引物对6株SS9的7个管家基因进行扩增,将扩增片段的测序结果上传至SS MLST数据库(http://ssuis.mlst.net),得到13个等位基因,经组合共获得两种ST型,其中A、D、E、F分离株ST型相同,为ST1330;B、C分离株ST型相同,为ST243。6株SS9的MLST鉴定结果见表3。
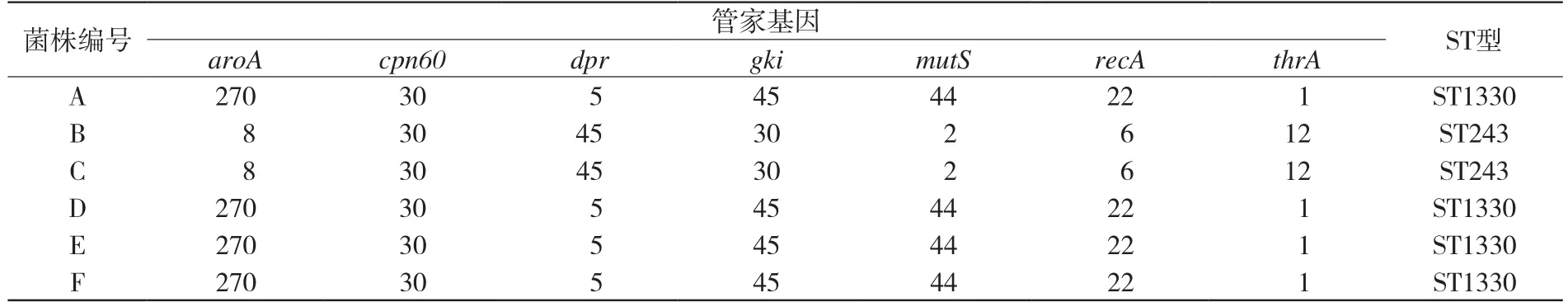
表3 6株SS9的MLST鉴定结果
2.5.2 系统发育树的构建 利用MEGA 7软件对6株SS9分离株和7株SS9参考菌株的ST型构建系统发育树。13株SS9共7种ST型,分为2个大分支,分支1包括ST1330、ST125和ST243,分支2包括ST613、ST790、ST730和ST16。本研究6株SS9分离株同处于分支1上,其中A、D、E、F分离株与B、C分离株分别位于同一进化分支的2个水平;A、D、E、F分离株与参考菌株74602(西班牙)亲缘关系较近,而B、C分离株与参考菌株1454(中国江苏)、65(中国广州)亲缘关系较近(图5)。
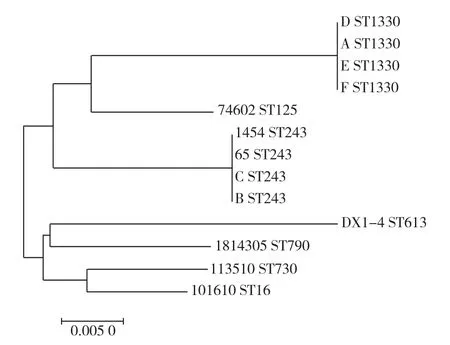
图5 SS9分离株和参考菌株ST型系统发育树
3 讨论
猪链球菌病在我国被划分为二类动物疫病,病猪因年龄、SS血清型的不同临床表现各异,其中超急性和急性感染病例发病急、死亡快,给养猪业造成重大经济损失。自1991年我国首次报道该病以来,SS的分离率逐年递增,以SS2、SS9两种血清型居多,且近年来SS9分布越来越广泛,流行趋势不断扩大。徐引弟等[7]对河南省2016年5月至2017年5月分离的189株SS临床分离株进行血清型鉴定,SS9的分离率为12.7%(24/189);石大丽等[8]从2018年1—6月广西部分地区采集的病料中分离出32株SS,其中SS9 为14株,分离率43.75%。本研究对某猪场送检的疑似SS感染的病猪病料进行细菌分离鉴定,获得的6株SS均为SS9,分离率高达100%。
研究表明,即使是同一血清型的SS分离株,其毒力也在不断变化[9]。目前,已知的SS毒力因子大约有61种,分为4大类:表面因子类、酶类、转录或调节因子类及其他类[8]。本研究测定了溶菌酶释放蛋白(mrp)、胞外因子(epf)、溶血素(sly)、毒力相关序列(orf2)、纤连蛋白原结合蛋白(fbps)、甘油醛-3-磷酸脱氢酶(gapdh)6种毒力因子在6株SS9分离株中的分布情况,结果共呈现3种毒力基因型,A、D分离株为epf-mrp+sly+gapdh+fbps+orf 2-,B、C分离株为epf-mrp+sly-gapdh+fbps+orf 2-,E、F分离株为epf-mrp+sly+gapdh+fbps+orf 2+,其中epf、gapdh、fbps的检出情况(epfgapdh+fbps+)与国内已报道SS9毒力基因检出情况基本一致[2,8,10,11]。Fittipaldi等[12]认为mrp、epf、sly基因与SS的毒力呈正相关,而周俊明等[11]发现部分毒力基因缺失的2株SS9江苏分离株(mrpepf-sly-orf 2+sao-fbps+gdh+)对小鼠致病力明显强于2株SS2江苏分离株(mrp+epf+sly+orf 2+s ao+fbps+gdh+),推测SS9可能存在某些特定的影响致病力强弱的毒力基因尚未被发现,故本研究6株SS9的毒力强弱需结合后续小鼠致病性试验结果进行判断。
SS的多位点序列分型(MLST)方法是基于SS基因组中7个管家基因在菌株中的多态性建立的,可用于区分SS的基因型并跟踪SS潜在流行菌株。SS9菌株具有高度多样化,不仅在整体水平上表现出遗传多样化,而且在进化关系相近的基因型间也表现为毒力基因型的多样化。Dong等[9]研究了30株SS9分离株(24株中国分离株、5株越南分离株和1株丹麦分离株)ST型与毒力的关系,发现系统发育相关性会导致SS9菌株存在相似的毒力基因型,但即使是同一ST型也会表现出毒力多样性,其中ST243被认为是SS9中具有高毒力潜力的ST型。本研究6株SS9共分为2个ST型,A、D、E、F分离株为ST1330,与西班牙分离株74602亲缘关系较近;B、C分离株为ST243,与江苏分离株1454和广州分离株65亲缘关系较近;其中A、D分离株,E、F分离株,B、C分离株毒力基因型分别一致,说明同一ST型的SS9菌株毒力基因型不同,与上述结论一致,同时应注意B、C分离株(均为ST243)可能为高毒力菌株。
