猪链球菌临床分离株对四环素类抗生素的耐药性和耐药基因分析
2022-07-27刘宝玲楚品品李春玲杨冬霞蒋智勇张昆丽勾红潮蔡汝健
刘宝玲,楚品品,李春玲,杨冬霞,蒋智勇,张昆丽,宋 帅,勾红潮,蔡汝健
(1.广东省农业科学院动物卫生研究所,广东省畜禽疫病防治研究重点实验室,农业农村部兽用药物与诊断技术广东科学观测实验站,广州 510640;2.仲恺农业工程学院动物科技学院,广州 510225)
猪链球菌(Streptococcussuis,S.suis)是一种革兰氏阳性细菌,能引起多种疾病,严重时能引起人和猪的死亡,属于危害较大的传染性人兽共患病原[1]。随着规模化养殖的发展及抗生素的不规范使用,猪链球菌的耐药情况日趋严重,对养猪行业及公共卫生造成重大威胁[2]。
四环素类抗生素是常用的广谱抗生素,被广泛应用于预防和治疗革兰氏阴性和阳性细菌的感染,是治疗猪链球菌病最有效的抗生素之一[3],2020年之前畜禽养殖业中,四环素常被用作抗菌促生长剂[4-5]。四环素(tetracycline)、多西环素(doxycycline)和米诺环素(minocycline)都是临床常用四环素类抗生素,长期使用导致细菌对四环素类抗生素的耐药性情况严峻。Hoa等[6]报道1997-2008年间从越南成年人脑脊液中分离的175株猪链球菌对四环素的耐药性达到91%,黄文明等[7]报道了2010-2012年间广东地区分离的猪链球菌对四环素类药物的耐药率高达98.2%。
四环素类抗生素耐药机制主要为药物外排和核糖体保护及灭活或钝化四环素酶[8-9],四环素耐药基因多达四十多种,包括编码外排泵的基因、编码核糖体保护蛋白的基因及编码灭活酶的基因[10-13]。细菌可通过获得编码相关蛋白的耐药基因产生耐药性[4,14],耐药基因的水平传播被认为是细菌对抗生素耐药的重要原因之一[15-16]。四环素类抗生素对猪链球菌耐药机制包括:①由tetL、tetB、tetK或tet(40)基因介导的外排泵机制;②由tetO、tetM、tetS、tetW、tet(O/W/32/O)或tet(O/32/O)基因编码核糖体保护蛋白机制[17]。Chen等[18]分离得到的猪链球菌中携带的耐药基因主要为tetM、tetO、tet(O/W/32/O)、tet(O/32/O)、tetS、tetW、tetL、tet(40);Petrocchi-Rilo等[19]报道西班牙分离的207株猪链球菌中有84.1%的菌株含耐药基因tetO。
因此,了解细菌对四环素类抗生素的耐药性及耐药基因的携带情况对疾病的临床用药具有十分重要的意义。为了解广东地区分离的猪链球菌对部分四环素类抗生素的耐药情况及耐药基因的携带情况,本研究调查了近几年来广东分离的34株猪链球菌对3种临床常用四环素类抗生素的耐药性,并分析了6种四环素耐药基因tetA、tetC、tetD、tetM、tetO和tetX的携带情况,以期对临床用药提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源 2016-2020年从广东不同地区分离的猪链球菌34株,其中9型链球菌19株,2型链球菌15株,保存于广东省农业科学院动物卫生研究所猪病研究室,菌株具体来源信息如表1所示。
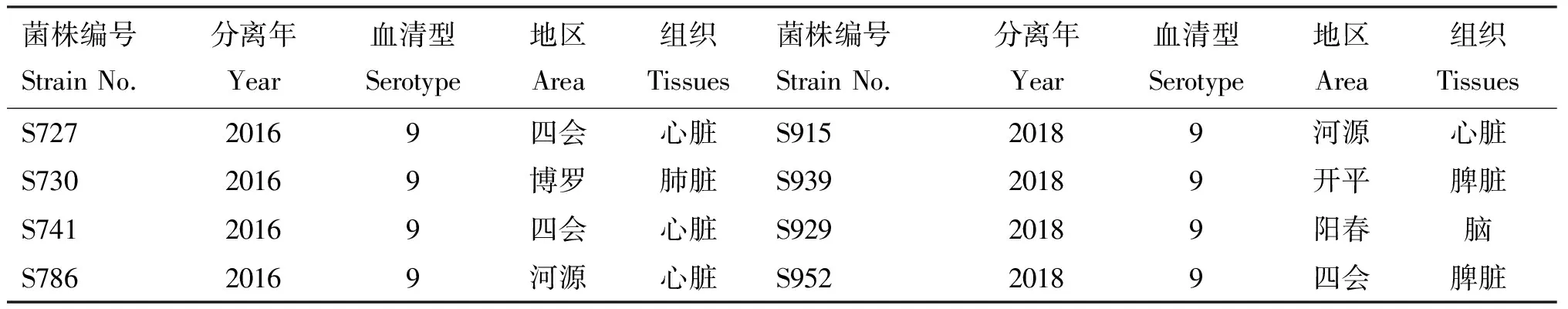
表1 猪链球菌菌株来源信息
1.1.2 主要试剂与仪器 四环素、多西环素、米诺环素药敏纸片(杭州微生物试剂有限公司);大豆酪蛋白琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB)培养基(广东环凯微生物技术有限公司);2×PremixTaq、胶回收试剂盒、DNA提取试剂盒(TaKaRa公司);新生牛血清(广州蕊特生物技术有限公司)。恒温箱(PYX-DHS500,中国上海跃进医疗器械厂);恒温振荡培养箱(ZWYR-2101C,中国上海智城分析仪器制造有限公司)。
1.2 方法
1.2.1 细菌培养 将冻存的细菌划线接种于TSA平板上,于37 ℃恒温箱中培养至长出单菌落,挑取单个菌落接种于TSB,于37 ℃振荡培养6 h(本试验所使用的TSB、TSA均加入了5%已灭活的新生牛血清)。
1.2.2 药敏试验 采用药敏纸片扩散法(K-B法)检测34株猪链球菌对3种四环素类抗生素的敏感性。取200 μL菌液,用无菌棉拭子均匀涂布在TSA平板上,然后用无菌镊子夹取药敏纸片,将其贴在平板表面,将平板放置于37 ℃恒温箱中培养24 h后测定抑菌圈直径,根据抑菌圈直径及所使用的药敏纸片判断标准判定细菌对药物的敏感性,判断标准见表2。
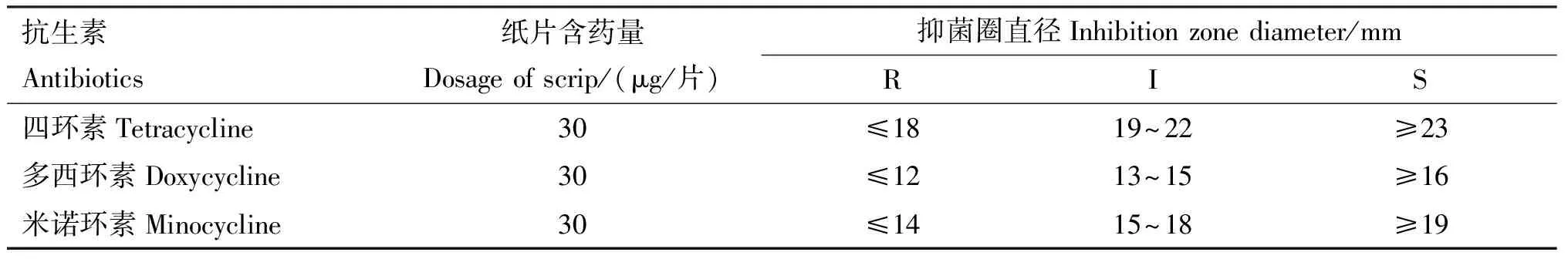
表2 K-B试验判断标准
1.2.3 引物设计及合成 参照黄文明等[7]、王学君等[20]、关琳等[21]设计耐药基因tetA、tetC、tetD、tetM、tetO、tetX引物,并由生工生物工程(上海)股份有限公司合成。引物信息见表3。

表3 引物信息
1.2.4 耐药基因检测 将细菌接种于TSB培养基中,于37 ℃恒温箱中振荡培养12 h,收集细菌,用DNA提取试剂盒提取细菌DNA。用上述6种引物将提取的34株猪链球菌的DNA进行PCR检测,将PCR检测阳性产物送生工生物工程(上海)股份有限公司测序。PCR反应体系25 μL:2×TaqMix 12.5 μL,DNA 1 μL,上、下游引物各0.5 μL,ddH2O 10.5 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,退火(退火温度见表3)30 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min。反应结束后取10 μL反应产物进行1.0%琼脂糖凝胶电泳检测。
2 结 果
2.1 34株猪链球菌对四环素类抗生素的敏感性检测结果
34株猪链球菌对四环素、多西环素、米诺环素的耐药率见表4。由表4可知,34株猪链球菌对四环素的耐药率最高,为100%(34/34),其次为米诺环素82.4%(28/34)、多西环素47.1%(16/34)。
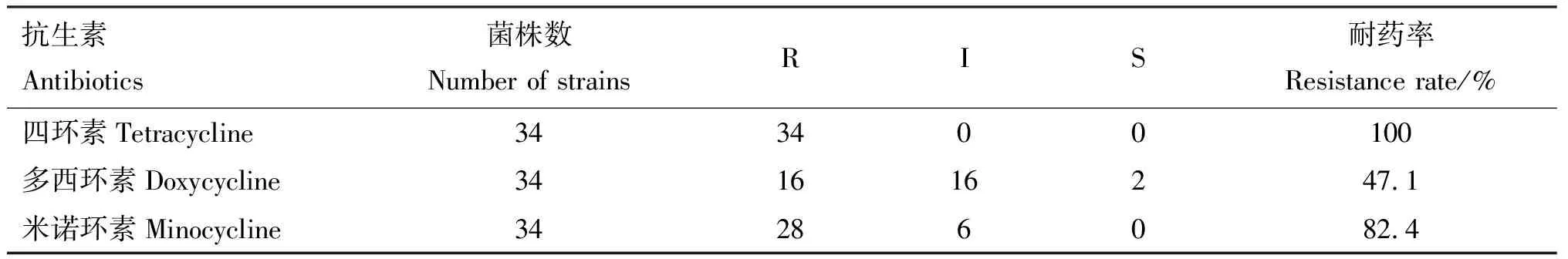
表4 猪链球菌对四环素类抗生素的敏感性
2.2 耐药基因的检测结果
34株猪链球菌中,tetA、tetC、tetD、tetX基因PCR检出率均为0;tetO和tetM基因PCR检出率分别为100%(34/34)和14.7%(5/34),且5株检出tetM基因的菌株均为2型。tetO和tetM基因扩增片段大小分别为515和406 bp(图1、2),与预期结果相符,统计结果见表5。

表5 34株猪链球菌耐药基因的携带情况
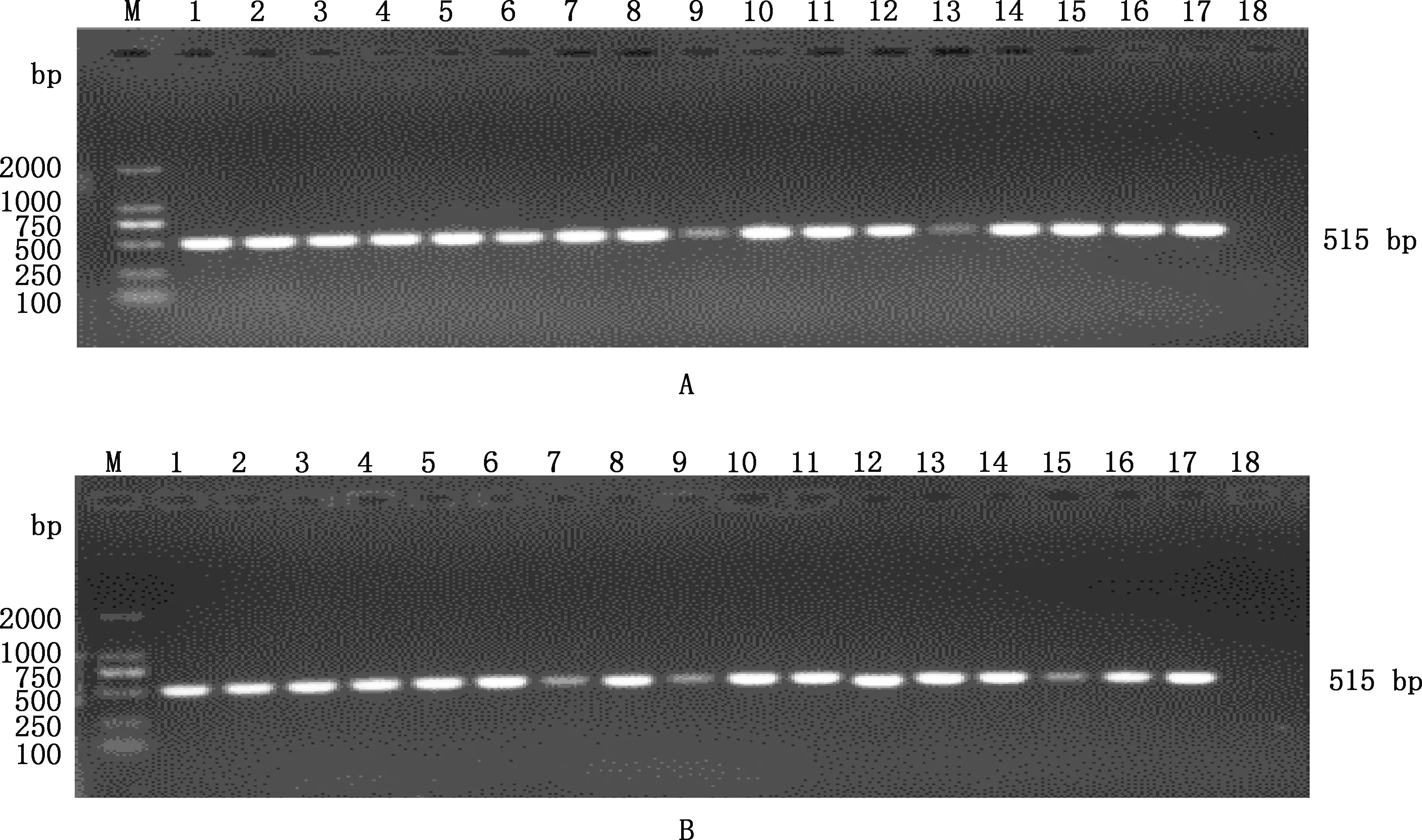
①A,2016-2017年样品;B,2018-2020年样品。②M,DL2000 DNA Marker;1~17,样品;18,阴性对照。图2同
PCR产物测序所得的核苷酸序列在NCBI上在线BLAST,结果显示,与tetO基因核苷酸序列相似性最高的为D16-010262(MT383669.1,99.58%),与基因tetM核苷酸序列相似性最高的为猪链球菌NJ3(CP082203.1,100%)。

图2 tetM基因的PCR结果
2.3 34株猪链球菌对四环素类抗生素的耐药基因和耐药表型分析
各菌株的耐药情况见表6。由表6可知,34株猪链球菌至少对1种四环素类抗生素耐药,3重耐药菌株有15株,占比44.1%(15/34),其中9型猪链球菌10株,占比29.4%(10/34),2型猪链球菌5株,占比14.7%(5/34);2重耐药菌株14株,占比41.1%(14/34),其中9型猪链球菌9株,占比26.5%(9/34),2型猪链球菌5株,占比14.7%(5/34);只耐1种药物的5株,占比14.7%(5/34),5株全部为2型链球菌。2或3重耐药菌株中9型猪链球菌为19株,占比55.9%(19/34),2型猪链球菌10株,占比29.4%(10/34),说明多重耐药菌株中9型猪链球菌比例较高。2重耐药菌株中耐四环素和米诺环素有13株,占比38.2%(13/34),只有1株菌耐四环素和多西环素。
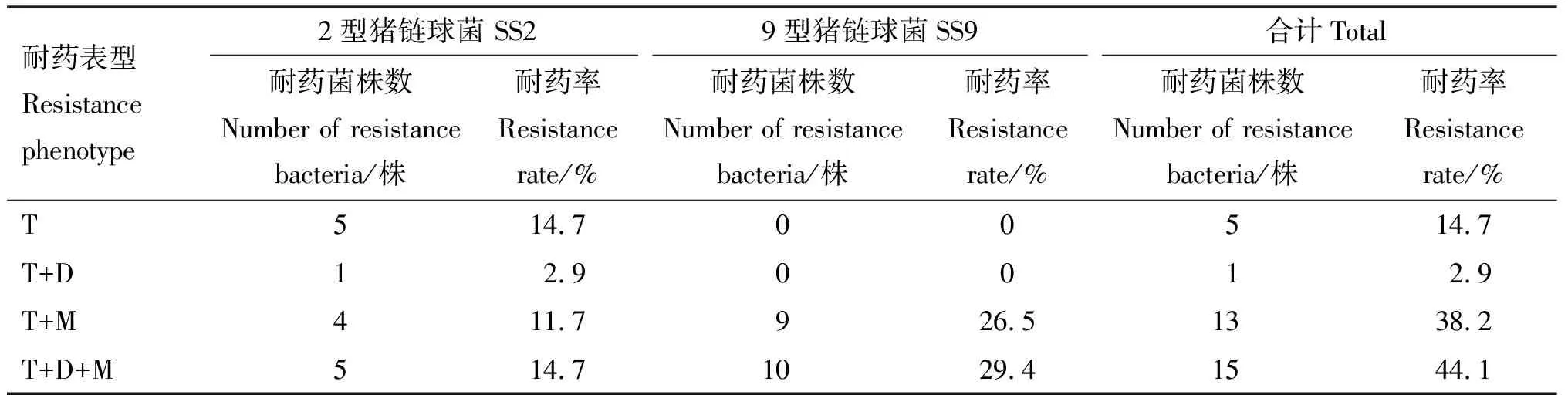
表6 猪链球菌耐药情况统计
各菌株的耐药基因携带情况见表7。由表7可知,同时携带tetO和tetM基因的菌株有5株,占比14.7%(5/34),这5株菌全部为2型猪链球菌;单独携带tetO基因的菌株有29株,占比85.3%(29/34)。
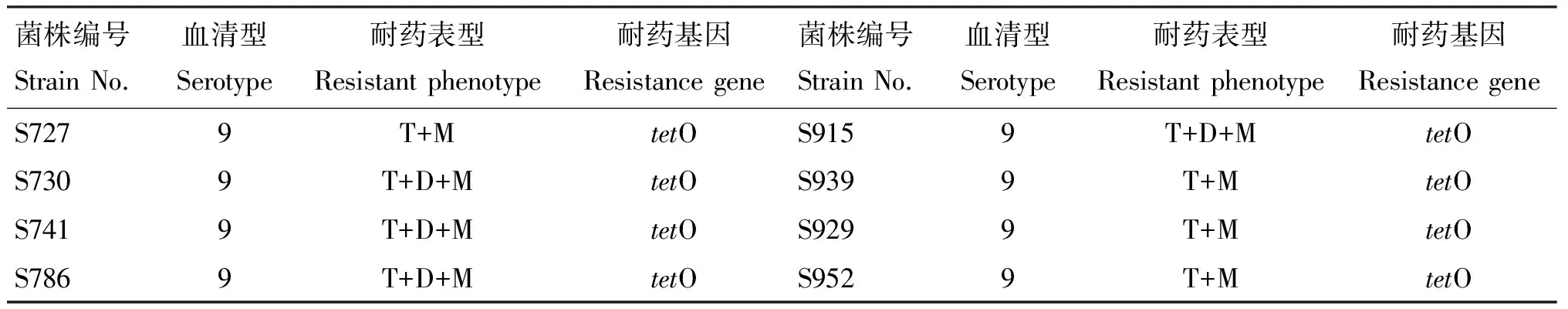
表7 各菌株的耐药基因携带情况
3 讨 论
猪链球菌是一种重要的人畜共患病病原,给养猪业造成重大经济损失,并带来严重的公共卫生安全[22]。抗生素作为治疗猪链球菌的首选方法,常在养殖业中大量使用,但抗生素的广泛应用及不合理使用导致细菌耐药性问题日趋严重,给临床治疗带来了困难。
四环素类抗生素是养殖业最常用的抗生素之一,耐药情况也较为严峻。Arndt等[23]报道了加拿大安大略猪场分离的猪链球菌对四环素的耐药性达84.2%;Ichikawa等[24]研究发现,日本东海地区的猪链球菌对四环素的耐药性为80.7%;Yongkiettrakul等[1]研究报道泰国不同地区猪链球菌对四环素类药物的普遍耐药。本研究发现从广东不同地区分离得到的34株猪链球菌对四环素、米诺环素和多西环素的耐药率分别为100%(34/34)、82.4%(28/34)和47.1%(16/34),说明广东地区的猪链球菌对四环素类耐药情况非常严重,仅有多西环素有较好的治疗效果,但其耐药率也已接近50%,因此临床用药时应尽量减少或谨慎使用该类抗生素。本研究发现四环素类药物2或3重耐药较为常见,34株猪链球菌中3重耐药菌株占比达到44.1%(15/34),2重耐药菌株占比41.1%(14/34),耐1种药物的菌株占比14.7%(5/34)。本研究中多重耐药菌株中9型猪链球菌比例较高,高达58.8%(20/34),说明9型猪链球菌更容易造成耐药,其机理尚未清楚,需进一步验证和研究。
四环素类抗生素耐药机制主要为药物外排、核糖体保护及灭活或钝化四环素酶等机制[5],由不同tet耐药基因决定。国内外对猪链球菌四环素耐药基因的研究表明,tetO是猪链球菌中最常见的耐药基因[17,25]。Aradanas等[26]研究报道了2013-2018年间分离的猪链球菌主要携带的耐药基因为tetO。Tan等[27]研究表明,从江西省分离的猪链球菌对四环素的耐药率较高,且tetO是主要的耐药基因。本研究对外排泵机制相关的基因tetA、tetC和tetD,编码核糖体保护蛋白的基因tetM和tetO,编码灭活酶的基因tetX共6种不同耐药机制相关基因分析发现,tetA、tetC、tetD、tetM、tetO和tetX基因携带率分别为0、0、0、14.7%(5/34)、100%(34/34)和0,说明广东地区的猪链球菌主要携带的耐药基因为tetM和tetO,提示这些猪链球菌分离菌株主要通过主动核糖体保护机制造成耐药。不同血清型猪链球菌携带耐药基因也存在一定的差异,许晓燕等[28]研究结果表明,中国大部分地区的2型猪链球菌对四环素具有很强的耐药性,主要耐药机制是由tetM基因介导的核糖体保护作用。关琳等[21]研究报道了9型猪链球菌对四环素的耐药主要是由tetO基因介导。本研究发现34株链球菌都携带tetO基因,有5株菌同时携带tetO和tetM基因,且发现这5株猪链球菌全部为2型猪链球菌,其中机理有待于进一步研究和探讨。
4 结 论
本研究结果表明,2016-2020年广东不同地区分离的34株猪链球菌对四环素、米诺环素和多西环素的耐药率分别为100%(34/34)、82.4%(28/34)和47.1%(16/34),2重以上耐药菌株占比较高。34株猪链球菌主要携带tetO和tetM基因,其中tetO基因携带率为100%,表明分离菌株对四环素类药物的耐药机制与tetO和tetM基因介导的核糖体保护蛋白有关。
