黄精多糖提取、分离纯化及生物活性研究进展
2022-06-11杨茂会谯政文龚小见邓青芳陈华国
杨茂会,周 欣,谯政文,赵 超,龚小见,邓青芳,陈华国,
(1.贵州师范大学,贵州省山地环境信息系统与生态环境保护重点实验室,贵州贵阳 550001;2.贵州师范大学,贵州省药物质量控制及评价技术工程实验室,贵州贵阳 550001;3.贵阳德昌祥药业有限公司,贵州贵阳 550201)
黄精(Polygonatum)为百合科黄精属(Polygonatum)草本植物,该属的中草药在我国有31种[1]。2020版中国药典收录了3种黄精药材分别为滇黄精(Polygonatum kingianumColl.et Hemsl.,PK)、黄精(Polygonatum sibiricumRed.,PS)、多花黄精(Polygonatum cyrtonemaHua.,PC)[2]。黄精根茎为药食同源的传统药材,其功效始载于晋代《名医别录》“其味甘,平,无毒。主补中益气,除分湿,安五脏,久服轻身、延年、不饥”[3]。药典记载了黄精具有补气养阴、健脾、润肺、益肾的功效[2]。现代研究表明,多糖是黄精主要的天然活性成分之一,且在黄精中含量最高[4]。黄精多糖作为一种药食两用的天然产物资源,具有免疫调节、抗肿瘤、抗炎作用、降血糖、抗氧化等多种生物活性[5-9]。因各实验室研究方法的不同,黄精多糖的获得方法以及结构特点均存在差异。本文对黄精多糖的提取、纯化与结构分析以及生物活性研究现状进行综述,以期为黄精多糖的深入研究提供科学依据。
1 黄精多糖的提取
提取黄精多糖前需要对黄精药材进行预处理,清洗黄精、切片、脱水干燥、粉碎、脱脂。脱脂试剂选用石油醚[10]等非极性溶剂或80%乙醇[11]等半极性溶剂脱脂,脱脂预处理主要脱去脂溶性物质,还可以脱除部分脂溶性色素[12]。黄精多糖提取基本流程:黄精粉(脱脂)→提取→浓缩→乙醇沉淀→除蛋白、色素→乙醇沉淀→有机溶剂洗涤→冷冻干燥。多糖提取率受到料液比、提取次数、提取温度、提取时间、pH等提取因素的影响,多糖的种类取决于结构类型,并与生物活性密切相关[13]。目前,黄精多糖提取方法已有较全面的研究,传统的黄精多糖提取方法有水提法[10,14-15]、稀碱提取法[16],物理强化提取方法包含超高压提取法[17]、减压提取法[18]、闪式提取法[19]。同时,微波辅取法[20]、超声波提取法[21]等新型辅助提取方法在黄精多糖提取中得到应用。相对于以上提取方法,酶解法通过酶解反应使细胞壁解离,从而加速植物细胞中有效成分的溶出,提高多糖的提取率[22]。在实际应用中,为了获得提取率及活性较高的多糖成分,会将两种及以上的提取方法进行协同使用,充分发挥每种提取方法的优点。具体方法及结果见表1。

表1 黄精多糖提取方法与结果Table 1 Methods and results of extraction of polysaccharides from Polygonatum
1.1 溶剂提取法
目前,黄精多糖溶剂提取方法主要采用水提法、稀碱提取法。水提法是黄精多糖常用且简单的提取方法,粗黄精多糖提取率一般在10%以上[14]。王毅等[10]采用热水提取法,料液比1:20、温度:80 ℃、提取时间:2 h、提取次数:3次,黄精多糖的提取率为19.87%。
水提法具有安全环保、操作简单、应用范围广的优点,但也存在耗时长、浸出率低、提取液用量大的缺点。
碱性条件有利于酸性多糖浸出,提高酸性多糖得率。但多糖在碱性溶液下糖苷键发生部分水解,造成多糖的损失。赵瑞萌等[16]采用3% NaOH溶液提取黄精多糖,在此条件下黄精多糖的提取率为11.89%。由于稀碱易使部分多糖发生水解,因此,稀碱液提取结束后要迅速将提取液pH调至中性,以免造成多糖大量损失。碱提法具有缩短提取时间、获得酸性多糖的优点,但也具有造成多糖损失、引入离子等小分子杂质、增加纯化难度的缺点。
1.2 物理强化提取法
物理强化提取方法有超高压提取法、减压提取法、闪式提取法[17-19]。物理强化提取方法不会破坏热敏性活性物质,是一种快速高效制备黄精多糖的方法。超高压提取方法通过升压,使系统内部的压力处于超高压状态,不会破坏热敏性活性物质。魏炜等[17]优化提取工艺:压力255 MPa、保压时间9.5 min、常温,黄精多糖提取率为25.01%。黄精多糖提取率明显高于其他提取方法得到的多糖提取率。超高压提取方法具有提取率高、杂质少、提取速度快的优点,但设备承受压力要求较高。减压提取法采用少量解吸剂(40%及以上乙醇溶液)润湿物料,然后加入温度高于解吸剂沸点的热溶剂(热水),同时降低操作压强,使解吸剂沸腾,产生对流,强化有效成分的扩散。杨军宣等[18]通过优化相应的工艺参数:60%乙醇解吸液,75 ℃热水溶剂,解吸30 min,提取压力-
0.074 MPa,提取时间8 min,黄精多糖提取率达到20%。减压内部沸腾提取法具有提取速度快、杂质少的优点,但存在设备、操作条件要求较高的缺点。闪式提取技术应用高速机器剪切力和分子渗滤原理,使提取剂浓度可以迅速达到平衡,数秒内完成提取过程,很大程度地保存黄精中的有效成分。陈艳等[19]通过闪式提取法,使得多糖提取率达到14.99%。相较于传统的提取方法,该系列提取方法具有较好的提取率;但实际操作中,对于设备、操作条件要求较高,在黄精多糖研究中较为少见。
1.3 辅助提取法
微波辅助提取法是通过微波具有较强的穿透能力,使得溶剂分子进入植物细胞后,使细胞内温度上升、压力变大。当压力超过细胞壁最大承受能力时,细胞壁发生破裂,从而释放出细胞内的有效成分。胡芳等[20]采用微波辅助制取黄精粗多糖,在料液比为1:50,浸泡时间:60 min,微波功率:450 W,提取时间为5 min,提取率仅为11.82%;而Zhang等[22]用微波提取黄精多糖,提取率高达21.5%。两者都同是采用微波法,但二者提取率却相差甚大,究其原因可能与提取温度、提取时间、微波功率、料液比、黄精种类不同有关。微波辅助提取法具有时间短、提取率高的优点,但也存在温度分布不均,提取料液比高的缺点。
超声波辅助提取法是由于超声波的机械效应、热效应和空化效应作用,增大固体颗粒与萃取溶剂之间的接触面积,加快目的物从固相转移到液相的传质速率,从而缩短了提取时间。通过超声辅助提取法获得的多花黄精多糖提取率为24.61%[23]。黄精种类也对粗多糖的提取率产生影响。杜泽飞等[21]以滇黄精为原料,采用超声波提取法制取粗多糖,所得提取率为14.09%。超声提取方法具有提取率较高、提取温度低的优点。但其所需设备复杂,超声波功率控制不当,会对粗多糖的提取率产生影响。
1.4 酶解提取法
酶具有选择性、专一性的特点。酶解法通过酶解反应解离植物细胞壁,从而加速植物细胞中有效成分的溶出。不会对多糖结构造成破坏,提高多糖提取率。酶解法可采取单一酶解法和复合酶解法提取黄精多糖。酶解法常用的酶主要有纤维素酶、木瓜蛋白酶。杨德等[24]采用纤维素酶提取黄精多糖,黄精多糖提取率为11.22%。单一酶解法虽然具有选择性、专一性的特点,但多糖的提取率相对较低。复合酶的种类、配比对黄精多糖的提取产生影响,苑璐等[25]采用复合酶解法,通过优化纤维素酶、木瓜蛋白酶配比用量,使得黄精多糖提取率可达21.55%,是水提法得率的2.75倍,比单一酶提取还高出12.06%。酶解法具有提取温度温和、效率高、酶的用量较少、专一性强、不易破坏黄精多糖的空间结构、黄精多糖产率高的优点。但为了维持酶的活性,酶解提取法对操作条件要求高。
1.5 协同提取法
超声波提取可以提高有效成分提取率,缩短提取时间,并且还可避免高温对提取成分的影响。现在的协同提取方法较多是基于超声波提取为基础,再结合其他的提取方法。充分利用超声波振动效应和其他提取方法的优点,使得协同提取速度快、能耗小,有利于极性和热不稳定性组分的提取。刘日斌等[26]采用超声波辅助酶法,可以充分加速酶解反应,促进有效成分的溶出。超声波辅助酶法的多糖提取率明显要比常规酶法、超声波辅助提取法高,产率达到25.63%。周桃英等[27]将超声波和微波提取方法结合,利用超声波振动效应及微波的高能作用,黄精多糖提取率达到11.19%。
2 黄精多糖的分离纯化
经过提取的黄精粗多糖,其中会存在蛋白质、色素等杂质,需要进一步分离纯化得到高纯度的黄精多糖。黄精粗多糖中常用脱除蛋白方法有Seveg法(氯仿-正丁醇的配比)、三氯乙酸法、酶法。Sevag法是最为常用的一种脱蛋白方法,具有适用范围广、成本低、检测速率快的优点,却也存在多糖损失量大、多糖生物活性破坏大以及色素干扰多糖含量测定等缺点[28]。三氯乙酸脱蛋白过程需要多次进行,直到黄精多糖溶液没有沉淀析出为止。三氯乙酸法具有脱蛋白效果好、三氯乙酸用量少的优点,但也会引起黄精多糖损失[28-29]。木瓜蛋白酶法脱蛋白,然后乙醇醇沉浓缩液形成沉淀,分子质量相对较小的多肽和氨基酸则保留于溶液中,因此,酶法是黄精多糖脱蛋白较好的方法[28]。黄精粗多糖干燥后颜色会加深,黄精多糖的脱色方法含有树脂吸附法、活性炭吸附法、氧化法。采用树脂对黄精多糖中的色素进行脱除,主要考虑到其较强的吸附能力,同时可以减少吸附黄精成分造成的损失[30]。活性炭对大分子物质具有较强的吸附性,在吸附色素的同时会吸附大量的黄精多糖;采用H2O2法脱色,脱色效果与活性炭无差异不显著,而黄精多糖损失率显著低于活性炭[31]。
为进一步研究黄精多糖的单糖组成、平均分子量、糖苷键构型及特征,需要在脱蛋白、脱色素基础上,对黄精多糖进一步分离纯化。纯化多糖目的是获得相对分子量均一的多糖。黄精多糖常用的分离纯化方法是离子交换层析法和凝胶层析分离法[22,32-35]。离子交换层析以离子交换剂(DEAE-52、DEAESepharose、DEAE-cellulose)为固定相,以不同浓度的NaCl溶液或者pH缓冲溶液为流动相进行洗脱,使不同浓度的流动相的离子与离子交换剂上的离子进行交换,从而将黄精多糖溶液中残存的蛋白、核酸与多糖进行分离,获得纯度较高的多糖。凝胶层析以三维网状结构的凝胶颗粒(Sepharose CL-6B、Sephadex G-200、Sephadex G-100)为固定相。在洗脱过程中,黄精多糖等大分子流经凝胶柱,由于直径大于凝胶网孔,只能沿着空隙随流动相流出。无机盐等小分子进入凝胶颗粒内部,流程长而移动速度慢。从而将黄精多糖与小分子进行分离,获得纯度更高的多糖。Wang等[6]采用水提醇沉获得黄精粗多糖,用去离子水、0.05、0.2和0.5 mol/L氯化钠溶液洗脱,经DEAE-Sepharose Fast Flow (2.6×30 cm)分离纯化后,获得四种黄精多糖组分为PSP1、PSP2、PSP3和PSP4。Zhang等[22]采用微波辅助提取法以提取多糖,经DEAE-52分离纯化,也获得四种多糖组分分别为P-1、P-2、P-3、P-4。王艳等[32]采用碱提法,通过Sevag法脱蛋白得水溶性粗多糖(PSP),经DEAE-52纤维素层析柱洗脱,再经Sepharose CL-6B色谱柱进行纯化得黄精多糖组分PSP-1a。张庭廷等[33]采用水提醇沉法,经DEAE-52进行分离纯化,再经Sephadex G-100纯化,得到黄精多糖组分PCP。Li等[34]采用水提法提取滇黄精多糖,经过DEAE-Sepharose-FF进行分离纯化,然后再经Sephadex G100进行纯化,获得纯化的PKPs-1级分。
3 黄精多糖的结构分析
多糖具有分子质量大、结构复杂、化学活性不明显,因而对多糖结构分析的研究难度较大。黄精多糖的结构特征研究主要集中在单糖组成、糖链构型、链接方式、支链结构的一级结构。多糖的结构分析方法有仪器分析方法和化学方法,现代常用的仪器分析方法为高效空间排阻色谱 ( high performance size exclusion chromatography,HPSEC)[6,33]、高效液相凝胶色谱法(high performance gel filtration chromatography,HPGPC)[22,34-35]进行平均分子量的测定;气-质联用(gas chromatography-mass spectrometry,GCMS)、高效液相色谱法(high performance liquid chromatography,HPLC)高效阴离子交换色谱法(high performance anion exchange chromatography-pulsed amperometric detector,HPAEC-PAD)进行纯度、单糖组成测定;红外光谱(infrared spectroscopy,IR)、核磁共振(nuclear magnetic resonance,NMR)对主链构型、糖链分支的结构进行分析[6,22,32-35]。但黄精多糖结构分析的主要化学方法为甲基化反应,可以识别多糖中连接类型及其比例[34]。不同提取、分离纯化方法及不同种类的黄精多糖平均分子量、化学特征呈现出不同的结果(表2)。
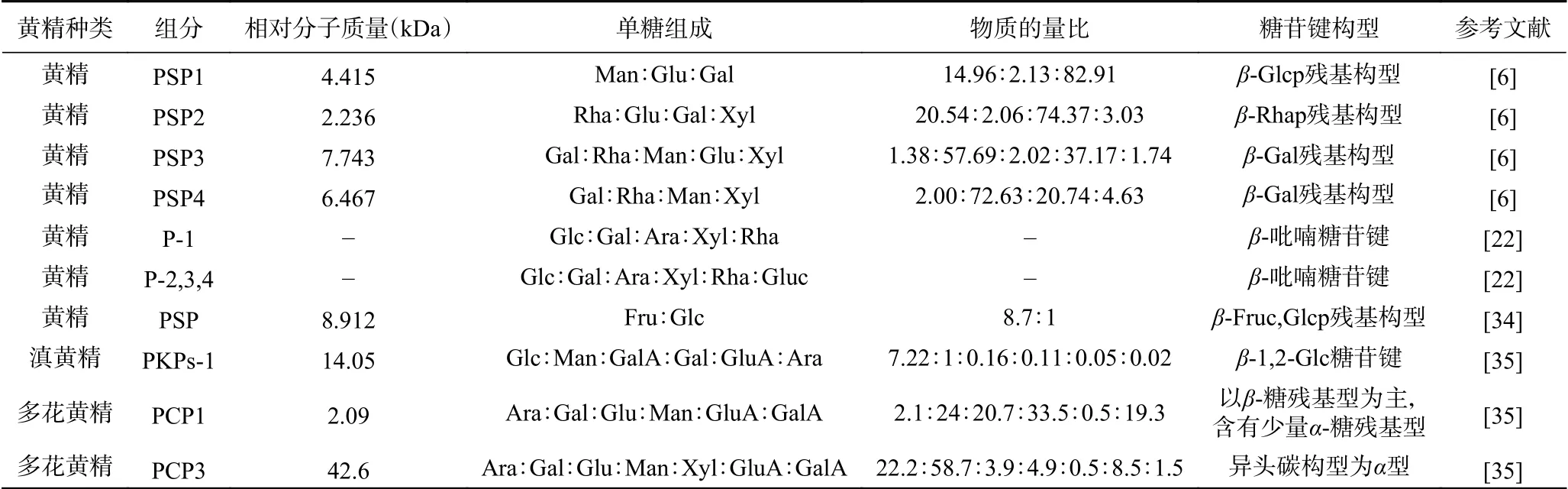
表2 黄精多糖的结构特征Table 2 Structural characteristics of Polygonatum polysaccharides
3.1 平均分子量
要测定黄精多糖的平均分子量,首先要对黄精多糖的纯度进行鉴定。目前,黄精多糖纯度鉴定与平均分子量测定普遍使用HPSEC[6]和HPGPC[22]。Wang等[6]测得4个不同的黄精多糖级分PSP1、PSP2、PSP3、PSP4,平均分子量分别为4.415、2.236、7.743和6.467 kDa。Zhang等[22]采用微波提取方法,通过分离纯化后,获得4个黄精多糖级分P-1、P-2、P-3、P-4的纯度都在70%以上;用HPGPC研究4个不同组分的均匀性,所测定的平均分子量大致在1~500 kDa。此外,Li等[34]提取滇黄精中的多糖,通过DEAE-Sepharose-FF与Sephadex G100进行两次分离纯化,得到一种多糖组分PKPs-1,PKPs-1纯度达到80%。通过HPGPC测定PKPs-1平均分子量大小为14.05 kDa。王坤等[35]对多花黄精多糖的分级提取中,通过分离纯化后,获得5个不同的级分PCP1、PCP2、PCP3、PCP4和PCP5,5个多糖纯度在60%~80%,平均分子量为2.09、38.6、42.6、34.3和24.1 kDa。在黄精多糖平均分子量的测定中,黄精多糖的种类、提取方法、测定方法的不同对黄精多糖平均分子量的测定都有影响。
3.2 结构特征
多糖的结构特征包括单糖组成、糖链构型、链接方式、支链构成。目前,黄精多糖结构分析主要在单糖组成、糖链构型方面。Wang等[6]分离纯化出4个PSPs组分,4个PSPs组分是由半乳糖、鼠李糖、甘露糖、葡萄糖和木糖按照不同比例组成,经IR、NMR仪器分析PSPs以β-吡喃糖残基构型存在。王艳等[32]在碱提PSP基础上,分离纯化得1个组分PSP-1a。PSP-1a主要是由鼠李糖组成的杂多糖,其中含有半乳糖、葡萄糖、甘露糖。同时,PSP-1a也存在阿拉伯糖。经IR、NMR仪器分析PSP-1a以β-糖苷键为主链相连的杂多糖。张庭廷等[33]对黄精多糖进行纯化后,通过外标法测得组成单糖的物质量比为果糖:葡萄糖=8.7:1。IR分析表明,PCP2存在β-吡喃糖苷键结构。王坤等[35]采用热水和不同浓度NaOH溶液分步提取多花黄精多糖,用80%乙醇沉淀多糖得到5个不同组分PCP,5个样品都含有阿拉伯糖、半乳糖、葡萄糖、甘露糖和半乳糖醛酸,以及少量的木糖和葡萄糖醛酸,虽单糖组成相同但含量不同。IR分析表明,5个不同组分的单糖是以吡喃糖环多糖的形式存在。13C NMR分析表明,PCP1糖残基构型主要是β-糖残基构型,有少量α-糖残基构型。碱提得到PCP3和PCP5糖残基构型主要是α-糖残基构型。
除对黄精多糖单糖组成、糖链构型研究外,关于黄精多糖的链接方式、支链构成进入初步研究阶段。目前,主要采用甲基化分析黄精多糖链接方式、支链构成的主要位点。Li等[34]经2次纯化后获得滇黄精多糖PKPs-1。PKPs-1经酸水解后用HPAECPAD法测定单糖组成。PKPs-1主要由葡萄糖、甘露糖、半乳糖醛酸、半乳糖、葡萄糖醛酸和阿拉伯糖组成,摩尔比为7.22:1.0:0.16:0.11:0.05:0.02。其中PSP-1a主要是由葡萄糖组成的杂多糖。IR光谱分析表明,PKPs-1存在β-糖残基构型。通过甲基化分析表明滇黄精多糖是以葡萄糖为主链链接,支链结构以(1→2)、(1→4)和(1→6)连接葡萄糖以及(1→2)连接甘露糖形成的链接方式且具有一定的重复分支结构。其次,经(1→3,4,6)糖苷键结合方式,还连接少量半乳糖、阿拉伯糖。
4 黄精多糖的生物活性
目前,国内外学者研究黄精多糖的生物活性主要在免疫调节、抗氧化、降血糖、抗炎、抗肿瘤等方面。黄精多糖纯度存在差异,导致黄精多糖的使用剂量不尽相同。同时,黄精多糖内存在少量杂质。这类杂质是否具有增强黄精多糖的生物活性尚不明确,给研究黄精多糖生物活性的分子机制带来很大困难。因此,研究者通过不同提取、分离纯化方法提高黄精多糖纯度,从而更好地阐述黄精多糖的生物活性及其作用机制。
4.1 免疫调节
黄精多糖对免疫调节具有较好的作用,通过多种免疫调节途径来调控生物机体的免疫系统。Liu等[36]研究黄精多糖激活RAW264.7巨噬细胞免疫调节功能,促进溶血素的形成,增强机体的免疫调节作用;同时,研究黄精多糖(PSP)对环磷酰胺(cyclophosphamide,Cy)所诱导体内免疫调节的影响;结果表明PSP3可以恢复Cy诱导的免疫低下小鼠的脾和胸腺指标以及T、B淋巴细胞免疫反应。此外,Chen等[37]研究发现PSP不仅增加胸腺和脾脏指数、单核巨噬细胞的吞噬功能,而且还能增强Cy处理小鼠的脾淋巴细胞中白介素-2(interleukin-2,IL-2)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达;表明黄精多糖参与Cy诱导小鼠的免疫抑制保护。Shu等[38]研究PSP对Cy诱导鸡的免疫抑制作用,PSP能显著刺激血清免疫球蛋白,促进外周血T淋巴细胞增殖;PSP能促进免疫器官细胞进入S期和G2/M期,恢复脾脏、胸腺指标;同时,PSP上调IL-2、IL-6和IFN-γ的表达。因此,PSP对Cy诱导鸡免疫系统具有较好的调节作用。
通过建立力竭训练运动模型,研究黄精多糖对于机体的免疫指标的影响。叶绍凡[39]研究发现低(50 g/kg)、中(100 g/kg)剂量组可以提高胸腺指数、脾脏指数,提高巨噬细胞的吞噬能力,高(150 g/kg)剂量黄精多糖还能提高血液中T淋巴细胞亚群CD3+、CD4+的含量、以及CD4+/CD8+比例。华岩等[40]研究表明,黄精多糖可以提升机体体液免疫功能,同时,提高机体中免疫球蛋白IgG、IgA、IgM的含量,增强机体免疫调节能力。
4.2 抗氧化作用
目前,多数疾病的病理过程都涉及自由基代谢失衡和脂质过氧化[41]。自由基是人体氧化反应中产生的有害物质,具有很强的氧化性,能损伤人体组织和细胞[42]。黄精多糖能减轻自由基、抑制脂质过氧化物产生的危害,提高抗氧化活性。原丽容等[43]通过实验研究证明黄精多糖具有清除羟自由基(·OH)、抑制脂质过氧化物产生的能力,且在一定剂量范围内成剂量依赖性。Li等[9]研究表明多花黄精多糖具有清除羟自由基、ABTS+自由基、DPPH自由基以及螯合Fe2+的能力和还原力,显示出一定的抗氧化活性;分离纯化出4种多花黄精组分HBSS、CHSS、DASS、CASS,4个纯化多糖组分均表现出与浓度正相关的体外抗氧化活性;DASS抗氧化能力最优,可能因为属于酸性β-构型多糖。Trishna等[44]通过H2O2诱导肝细胞,研究表明黄精多糖显著降低肝细胞中总活性氧水平,并显示出对羟基自由基的剂量依赖性活性。宫江宁等[45]研究表明,黄精多糖具有一定的抗氧化活性,并且对自由基的清除率均呈现浓度依赖性。黄精多糖对自由基的清除能力顺序为ABTS+·>·OH>DPPH·>O2-·。
4.3 降血糖
糖尿病是一种以高血糖为特征的代谢性疾病[46],表现为胰岛素抵抗,胰岛素分泌不足,糖脂代谢紊乱,最终导致体内血糖含量升高。黄精多糖能够调节胰岛素分泌,改善糖脂代谢紊乱,降低血糖水平。因此,黄精多糖可作为治疗糖尿病的辅助方法[47]。王艺等[48]研究发现黄精多糖改善链脲佐菌素(streptozotocin,STZ)诱导的大鼠糖尿病,通过降低血糖、血清糖化血红蛋白浓度,提高组织胰岛素及C-肽表达量、增强胰岛素敏感性,从而改善糖尿病大鼠胰岛素抵抗。王秋丽等[49]研究多花黄精多糖对Ⅰ型糖尿病小鼠的影响,多花黄精多糖可以升高胰岛素受体底物-1(IRS-1)mRNA水平,降低糖尿病肝脏中免疫因子IL-6、IL-1β的水平。
Gu等[50]研究发现,滇黄精多糖通过调节肠道微生物群组成,增加短链脂肪酸(shortchain fatty acid,SCFA)水平,改善糖脂代谢紊乱;肝脏组织中磷脂酰肌醇3-激酶(phosphoinositide-3-kinase, PI3K)、蛋白激酶B(protein kinase B,AKT)与胰岛素抵抗以及体内脂质代谢具有密切联系。汪光军等[51]研究发现,对高脂饮食联合STZ诱导C57小鼠的糖脂代谢紊乱,PSP可以增强小鼠肝脏PI3K、AKT的表达,发挥其保护肝脏组织正常的糖脂代谢机能的作用。贾璐等[52]对高脂饮食诱导小鼠,PSP可以改善血糖与胰岛素水平,并提高肝脏胰岛素受体-2(IRS-2)的表达量;同时,其能够抑制NF-κB-iNOS-NO氧化应激通路,对高血糖环境下的高氧化应激状态有一定的抑制作用。孔瑕等[53]发现黄精多糖调节肝脏中PPARα、PPAR-β、PPAR-γ、SREBP-1c、IL-6、TNF-α脂类代谢相关基因和蛋白表达,起到防治糖脂代谢紊乱的作用。
4.4 抗炎作用
炎症是身体对刺激的防御反应,通过激活Toll样受体4-核转录因子-κB(TLR4-NF-κB)信号通路,诱导炎性细胞释放炎症因子,使机体产生炎症反应。同时,也可以促进巨噬细胞释放的细胞因子,使机体产生炎症反应[44]。黄精多糖在心肌炎症、肠炎、肾损伤模型中均有抗炎作用。黄精多糖对STZ诱导糖尿病大鼠心肌炎症损伤具有较好的生物活性,通过抑制TLR4表达进而下调NF-κB信号通路,从而抑制巨噬细胞抑制因子(Macrophage inhibitory factor,MIF)释放[44]。黄精多糖能够缓解炎症反应的能力。一方面,通过抑制NF-κB通路,减少MDA、MPO产生,增加SOD含量,减少结肠氧化损伤,减轻肠道炎症反应。另一方面,黄精多糖通过降低结肠炎小鼠血清中的促炎细胞因子水平,提高抗炎细胞因子水平,对肠炎小鼠起到保护作用[54]。此外,黄精多糖对转基因大鼠急性肾损伤有很强的保护作用,它能降低肾组织中NGAL或KIM-1基因的表达,抑制p38 MAPK/ATF2信号通路和炎症因子肿瘤坏死因子-α(TNFα)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)的产生[55]。
4.5 抗肿瘤
黄精多糖具有较好的抗肿瘤活性。吕品田等[56]发现黄精多糖对胃癌荷瘤小鼠的增殖具有抑制作用,通过抑制TLR4/NF-κB信号通路,增加TNF-α、IL-2、IL-6的免疫调节水平,发挥抑瘤作用。黄精多糖抑制TNBC肿瘤诱导的脾造血细胞增殖,增加TNBC肿瘤抑制的骨髓中的HSPCs和普通淋巴细胞,黄精多糖显示出持久的抗肿瘤作用[57]。李超彦等[58]发现,黄精多糖对H22肝癌移植瘤增殖和侵袭能力具有抑制作用,并能减轻顺铂引发的肝脏氧化损伤。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路经过p38 MAPK和MAPK磷酸酶-1(MKP-1)信号可以传导,调控肿瘤细胞的生长、分化[59]。研究表明,黄精多糖通过调节TLR4表达来抑制人食管鳞状细胞(Eca109细胞)中的NF-κB信号通路[60],促进细胞凋亡。
此外,黄精多糖通过影响肿瘤细胞周期,阻碍肿瘤细胞基因转录,干扰肿瘤细胞分裂增殖,从而抑制肿瘤细胞转移。研究表明,黄精多糖通过影响细胞周期分布,将肝癌H22移植瘤细胞阻滞于G0/G1期,使肿瘤细胞不能进入S期进行DNA复制,从而抑制肝癌H22细胞增殖。此外,黄精多糖抑制肿瘤细胞下游CDK1和CyclinB1基因的表达,从而阻断Hela细胞周期G2/M期[61]。
4.6 其他生物活性
黄精多糖除具有免疫调节、抗氧化、降血糖、抗炎、抗肿瘤的生物活性外,还具有抑菌、抗病毒、抗衰老、保护神经系统、调节心肌活性等生物活性。黄精多糖的其他生物活性详细见表3。
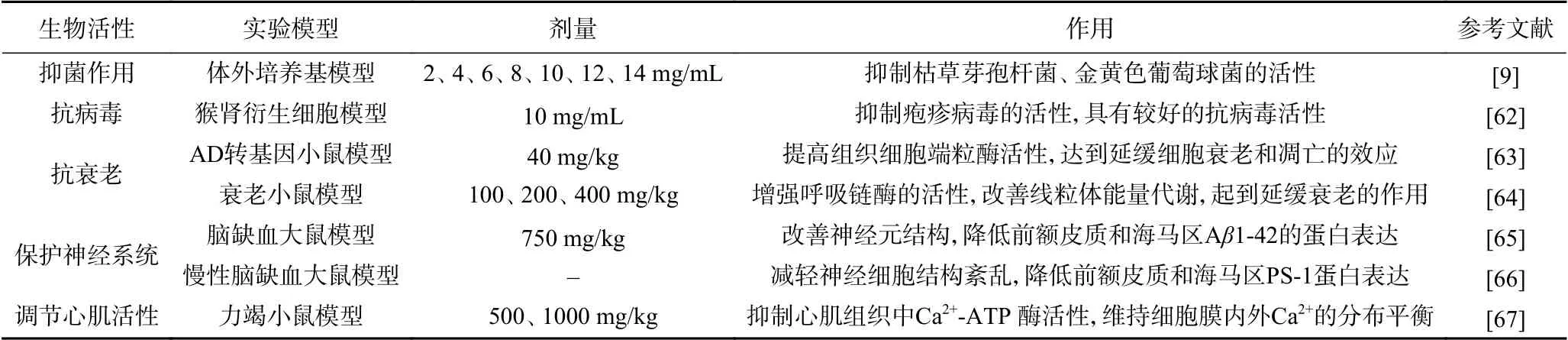
表3 黄精多糖的其他生物活性Table 3 Other biological activities of Polygonatum polysaccharides
5 结语
目前,黄精多糖提取分离、纯化以及生物活性的研究取得了一定进展,但也存在局限性。如:黄精种类不同造成多糖提取、分离纯化方法存在差异性,部分方法提取效率低,时间长,黄精多糖纯化困难且损失较大;黄精多糖结构研究主要在初级结构方面,对黄精多糖空间构象、主次链的高级结构研究较少;黄精多糖结构修饰的研究相对较少,主要取决于化学结构的复杂性;黄精多糖质量测定标准不易控制,对生物活性作用机理及其构效关系尚不明确;黄精多糖的生物活性以体外实验为主,缺乏体内实验以及临床应用,这限制黄精多糖的深入研究。因此,我们对黄精多糖的研究可从以下几点出发:a.黄精多糖采用协同提取方法提取,并将膜分离与柱层析技术有效结合,提高分离纯化效果,以获得纯度较高的黄精多糖;b.在对黄精多糖初级结构研究的基础上,采用原子力显微镜法、X-射线衍射法等方法分析黄精多糖晶型、分子构型和空间构象;同时,利用计算机模拟黄精多糖的空间构象,构建黄精多糖的立体结构,为探究黄精多糖高级结构提供新的思路;c.黄精多糖单体化合物的生物活性及其作用机制研究仍相对较少;研究时应注意分析其提取、纯化活性部位,阐明其药效团的基础,为其进一步开发利用提供科学依据;d.在多种信号通路分析的基础上,从基因调控、蛋白表达、代谢组学角度去探究黄精多糖对疾病的防御机制,为深入研究黄精多糖在动物及人体的生物学作用提供科学依据。总之,黄精多糖的研究仍处于发展阶段,仍需要科研工作者从不同角度对黄精多糖进行探索研究。
