植物油基鱼罐头中矿物油污染物高灵敏检测方法的建立
2022-06-11杨梦奇刘玲玲李冰宁武彦文
杨梦奇,刘玲玲,李冰宁,武彦文
(北京市科学技术研究院分析测试研究所(北京市理化分析测试中心),北京市食品安全测试工程技术研究中心,北京 100094)
矿物油是碳数范围C10~C50的各种烃类化合物的总称,可分为饱和烃矿物油(mineral oil saturated hydrocarbons, MOSH)和芳香烃矿物油(mineral oil aromatic hydrocarbons, MOAH)两类[1];其中MOSH容易在人体中蓄积,引发炎症,MOAH则有潜在的致癌和致畸毒性[1-2]。矿物油来源于石油、合成油及其各类精炼产品,能通过多种途径迁移至食品导致污染[1]。研究发现,食品中普遍存在矿物油,其中以植物油的污染最为严重[3-7],目前出台的相关标准和规范均与植物油相关[8-10]。此外,由于水质污染,鱼类容易在养殖过程中富集矿物油(石油烃)[11-14];同时,几乎所有食品会通过生产过程接触到污染的容器或生产线而产生矿物油迁移[15-17]。因此,植物油基的鱼类罐头中很可能存在比较严重的矿物油污染。然而,由于矿物油组成复杂且易受基质干扰严重,高灵敏分析困难[18]。
本文借鉴标准方法DIN EN16995:2017[9]建立了植物油基鱼罐头中矿物油的高灵敏度测定方法,该方法推荐使用在线联用高效液相色谱-气相色谱(HPLC-GC)技术。该技术的核心是通过Y形件、保留间隙柱(retention gap, RG)和溶剂挥发出口(solvent vapor exit, SVE)组成HPLC-GC接口,该接口可以将HPLC分离的MOSH和MOAH全部转移至GC,然后GC以大体积进样方式实现矿物油的高灵敏度测定[18-19]。不过,该技术也存在缺点,即HPLCGC接口限定了HPLC馏分的体积不能高于450 μL,因而HPLC硅胶柱的规格仅为25 cm×2.1 mm i.d.,只能吸附20 mg甘油三酯[18-19],过量油脂将导致色谱柱过载,严重干扰矿物油的测定。因此,对于油脂含量高的植物油基鱼罐头,需要事先去除油脂才能达到矿物油的高灵敏度测定[9]。
目前,去除油脂的方法有DIN EN16995:2017推荐的硅胶柱吸附法[9]和皂化法两种[9,20]。然而,硅胶柱法存在吸附容量有限、溶剂消耗大、浓缩倍数高等缺点,因此,本文采用皂化法去除油脂。方法建立流程是:首先确定皂化反应条件,经液液萃取得到矿物油提取液;接着采用环氧化反应去除样品基质中的天然烯烃干扰物,然后吸取净化液注入HPLC-GC分析,从而建立了植物油基鱼罐头中的MOSH和MOAH的高灵敏测定方法;应用该方法本文调查了北京地区10个市售产品的矿物油污染情况,并且结合谱图和数据,分析了矿物油与植物油种类、鱼的品种、脂肪含量、包装材料以及产品来源的关联性,探讨了这类产品的污染来源。
1 材料和方法
1.1 材料与仪器
植物油基鱼罐头产品 10个,购于北京地区,其中5个国产品牌、5个进口产品。表1给出了这些产品的信息,包括鱼的种类、脂肪含量、包装材料。所有产品(表1)均在其标示的保质期内完成了分析测试;正己烷(色谱纯)、无水乙醇(色谱纯)、硅胶0.063~0.200 mm 德国Merck公司;氢氧化钾 分析纯,美国Aladdin公司;硫代硫酸钠、无水硫酸钠(分析纯)、碱性氧化铝0.075~0.150 mm(100~200目) 国药集团化学试剂有限公司;3-氯过氧苯甲酸(m-CPBA) 分析纯,赛默飞世尔科技(中国)有限公司;硅胶和氧化铝使用前均在马弗炉中于400 ℃烘烤6h,冷却后置于干燥器,一周内使用。两种混合标准溶液:①含有9个化合物的MOSH/MOAH混合标准溶液 北京坛墨质检科技有限公司,其中正十一烷(n-undecane,n-C11)、环己基环己烷(bicyclohexyl,Cycy)、戊基苯(amylbenzene,5B)、1-甲基萘(1-methylnaphthalene,1-MN)、2-甲基萘(2-methylnaphthalene,2-MN)、1,3,5-三叔丁基苯(1,3,5-tri-tert-butylbenzene,TBB)的浓度均为300 mg/L,正十三烷(ntridecane,n-C13)的浓度为150 mg/L,胆甾烷(5-alphacholestane,Cho)和苝(perylene,Per)的浓度为600 mg/L。②配制n-C10~ n-C50碳数保留时间混合标准溶液 正构烷烃标准品购自美国Restek公司。
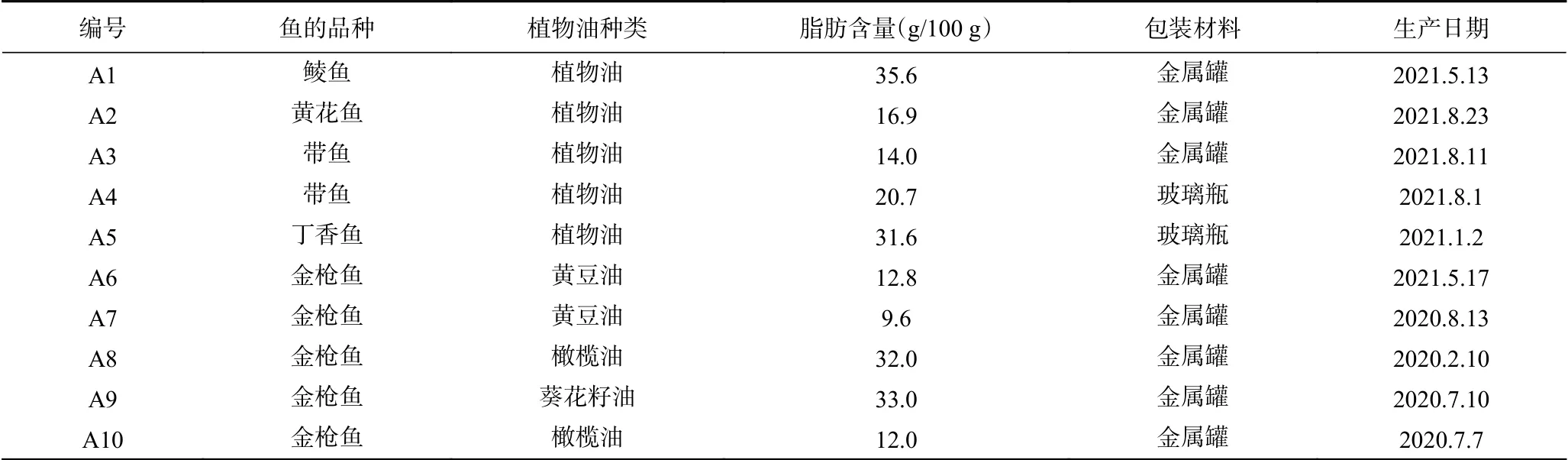
表1 植物油基鱼罐头产品标签上的信息Table 1 Information on the labels of the vegetable oil-based canned fish products
LC 20AD液相色谱仪(配备紫外检测器)、2010 plus气相色谱仪(配备FID检测器) 日本岛津公司; LC-GC接口 德国Axel Semrau公司;SHZ-B水浴恒温振荡器 上海博迅医疗生物仪器股份有限公司;Biofuge primo R低温高速离心机 赛默飞世尔科技公司;R-100旋转蒸发仪 瑞士步琦有限公司;TUS-200P振荡型恒温金属浴 上海一恒科技有限公司。
1.2 实验方法
1.2.1 两种混合标准溶液的配制及其应用 两种混合标准溶液:①含有9个化合物的MOSH/MOAH混合标准溶液:9个化合物用作考察提取、分离的性能与定量,其中n-C11和5B分别用于监测MOSH和MOAH的挥发损失情况,Cho是HPLC洗脱MOSH部分的末端标记物、TBB和Per则分别是MOAH部分的前端和末端标记物;MOSH和MOAH的定量内标分别为Cycy和2-MN,n-C13和1-MN用于考察定量内标物的含量是否准确。②配制n-C10~ n-C50碳数保留时间混合标准溶液:溶液中含有n-C10、n-C11、n-C13、n-C16、n-C20、n-C24、n-C25、n-C35、n-C40、n-C50各100 mg/L,用于考察仪器性能并划分碳数范围。
1.2.2 皂化反应 将整罐样品全部倒出、捣碎并均质;准确称取均质样品5 g(精确至0.0001 g)于100 mL离心瓶中,加入10 μL的MOSH/MOAH混合标准溶液,再加入20 mL的氢氧化钾-乙醇水溶液(25 g氢氧化钾溶于50 mL去离子水中,冷却后加入90 mL无水乙醇),振荡混匀;放入水浴恒温振荡器,于60 ℃下皂化反应[20]30 min。反应结束后取下,冷却至室温。加入15 mL正己烷,萃取、离心,取上层液体置于鸡心瓶中;再加入10 mL正己烷重复上述步骤;将两次提取液合并,用旋转蒸发仪减压浓缩至约1 mL。
1.2.3 环氧化反应 取1.2.2浓缩液,加入500 μL的m-CPBA乙醇溶液(200 mg/mL),以40 ℃振荡反应20 min;然后加入500 μL乙醇、2 mL硫代硫酸钠溶液(0.1 g/mL)终止反应,取正己烷层用于HPLCGC分析[21]。
1.2.4 氧化铝净化 将10 g活化氧化铝和3 g硅胶依次装入玻璃管(内径为28 mm),制备成上层为硅胶、下层为氧化铝的净化小柱,轻轻敲实,用于净化1.2.2得到的浓缩液。首先用20 mL正己烷淋洗净化柱,当淋洗液接近柱床时将1.2.2制备的全部浓缩液上样,当液体流至接近柱床时,加入25 mL正己烷洗脱,弃去先行流出的5 mL洗脱液,收集后续的25 mL,减压浓缩至近1 mL用于HPLC-GC分析[9]。
1.2.5 HPLC-GC分析 HPLC色谱柱为Restek Allure Si(250 mm×2.1 mm,5 μm),流动相为正己烷(A),二氯甲烷(B);采用梯度洗脱程序:0~0.1 min,100%A(流速为0.3 mL/min);0.1~6.2 min,70%A(流速为0.3 mL/min);6.2~15.2 min,100% B(反冲,流速为0.5mL/min);15.2~25.2 min,100% A(流速为0.5 mL/min);25.2~30 min,100% A(流速为0.3 mL/min)。进样量为100 μL;以紫外检测器(230 nm)监测HPLC的流动相与MOAH的流出情况。在此条件下,MOSH部分于2.0~3.5 min、MOAH于4.5~6.0 min流出,通过阀切换全部导入GC,GC的柱温箱中配备RG、三通和SVE[9]。
GC仪器配置两套完全相同的通道,每个通道均采用Restek MXT(10 m×0.53 mm)无涂层RG柱和Restek MXT-1(15 m×0.25 mm×0.25 μm)分析柱,RG柱与分析柱之间通过三通与SVE连接;程序升温为初始温度60 ℃,保持6 min,以15 ℃/min升温至120 ℃,再以25 ℃/min升温至370 ℃,保持6 min;FID温度为380 ℃;载气为氢气(纯度≥99.995%),MOSH和MOAH通道的初始压力分别为80和79 kPa;辅助气、燃烧气和助燃气分别为氮气、氢气和空气,流速分别为30、40和400 mL/min。
1.2.6 数据处理 MOSH和MOAH的GC谱图呈跨越一定沸程范围的驼峰,定量计算时,MOSH或MOAH的含量通过积分计算基线与驼峰上轮廓线之间的面积得到,基线通过空白实验得到[9],驼峰上方的尖峰需要扣除。本文采用Lab solution 软件进行数据处理。基于内标中的Cycy 和2-MN 定量计算MOSH 和MOAH 的含量,采用Excel 2016、Origin 8.5进行数据分析。所有实验均重复做两次平行,计算平均值给出测定结果。
2 结果与分析
2.1 样品前处理
2.1.1 皂化反应 由表1可知,植物油基鱼罐头中含有大量油脂(脂肪含量为9.6%~35.6%)。由于油脂与矿物油互溶,提取矿物油的同时油脂也被一并提取;如果不除去油脂,将干扰后续矿物油的测定。联用仪器的HPLC硅胶柱虽然可以吸附油脂,但其吸附量仅有20 mg[18],如果直接将含有油脂的矿物油提取液注入HPLC-GC分析,则方法定量限只能达到10 mg/kg[9]。为了降低定量限、提高灵敏度,必须除去油脂,让更多的矿物油进入HPLC-GC分析,从而实现高油脂食品中微量矿物油的测定[9]。
皂化反应是很好的油脂去除方法,其原理是将甘油三酯被强碱分解为极性更高的脂肪酸和甘油,这些反应产物溶于强极性溶剂,如水和乙醇;而矿物油为非皂化物,不参与反应,其极性不变,仍然为弱极性物质。因此,皂化反应的作用是增大了矿物油与油脂的极性差异,从而可通过溶剂萃取达到去除油脂的目的。
通常,皂化反应需要考虑样品(底物)与氢氧化钾碱液的浓度、溶剂体系、反应温度和时间等条件。考虑到矿物油涉及的碳数范围(C10~C50)较宽,为了避免低沸点目标物的损失,皂化反应的温度和时间被限定为60 ℃和30 min[20]。因此,本文仅需要考察以下三个条件,即样品用量、强碱浓度与反应溶剂。
样品取样量与分析灵敏度直接相关。矿物油检测采用具有等碳响应的氢火焰离子化检测器(FID),原因是只有FID才能反映矿物油的全貌,并且不需要标准参照定量。因此,GC-FID成为分析矿物油的理想方法[8-9,18]。由于矿物油化学结构复杂、数量巨大,其GC谱图呈无法分离的鼓包峰形状(hump),而鼓包峰的灵敏度仅为常规尖峰的1/100[18],一般只有进入FID的矿物油达到50~100 ng才能满足分析不确定度要求[18]。2019年欧洲联合中心(JRC)出台指导意见,规定高油脂食品中矿物油的分析方法定量限不得高于0.5 mg/kg[21],由此推算,植物油基鱼罐头的取样量须达到5 g左右才能满足其灵敏度要求。
强碱浓度需要根据取样量确定。理论上,皂化反应的甘油三酯与碱的摩尔比为1:3。为了反应完全,碱的浓度通常是过量的。实验表明:氢氧化钾浓度达到3 mol/L以上油脂才能反应完全;此外,由于水-油两相分离,本文加入乙醇以促进化学反应。实验发现:当反应体系的水:醇的比例接近于1:2时,反应效果最优。因此,确定皂化反应条件为:称取5 g罐头样品,加入20 mL的3~4 mol/L的氢氧化钾溶液(其中水:乙醇≈1:2),于60 ℃下反应30 min。反应后采用正己烷提取两次,低于40 ℃减压浓缩至1 mL左右,供后续净化。
2.1.2 环氧化反应 植物油中含有大量天然烯烃,如角鲨烯、胡萝卜素和甾烯等[22],这些烯烃的极性与MOAH相似,在HPLC硅胶柱的吸附行为几乎完全一致,即天然烯烃与MOAH流经HPLC色谱柱时产生共流出,一起进入GC分析[18,22]。由于矿物油的GC谱图呈宽沸程的鼓包峰,天然烯烃的存在会严重覆盖或干扰MOAH分析。
目前,环氧化反应是去除烯烃干扰的最可行方法[9,21]。该方法由Biedermann等首先提出,其原理是采用过氧化物m-CPBA将烯烃氧化为极性较大的环氧化物,从而被硅胶吸附、除去[22]。Biedermann等采用二氯甲烷作溶剂,反应方法需要控制低温、转换溶剂等操作[22];Nestola等则改进了方法,将溶剂替换为乙醇,不仅减缓了反应速率,将反应温度升至常温,而且无需转换溶剂,简化了操作步骤[23-24]。本文采用改进后的环氧化方法(1.2.3)进行样品净化。
2.1.3 氧化铝净化 一些植物油中含有大量碳数高于C21的奇数碳正构烷烃,其GC谱图呈位于MOSH驼峰上方的一系列尖峰[18]。通常,如果这些尖峰不影响矿物油驼峰轮廓的辨认与积分计算,则无需净化去除。本课题组对植物油中正构烷烃的干扰情况进行了前期研究[25-26],发现并非所有样品都需要去除正构烷烃,只要MOSH的轮廓不受影响或可以辨认就无需增加这个实验步骤。原因是正构烷烃的去除方法采用氧化铝吸附,而氧化铝的吸附能力很弱,一方面会成倍地增加溶剂用量,另一方面氧化铝对MOSH约有20%的吸附,降低了结果的可靠性[18,25-26]。
因此,本文选取MOSH鼓包峰上方尖峰干扰较明显的样品(如A1)进行了氧化铝净化考察,比较了净化前后的谱图特征与积分结果(图1)。结果发现:净化后MOSH鼓包峰上方的沸点高于n-C25以上的尖峰几乎全部去除。但是净化前后的MOSH鼓包峰的积分面积却没有显著差异。说明天然烷烃形成的尖峰不影响MOSH积分,因而可以省略氧化铝净化步骤。本文建立了植物油基鱼罐头的提取净化步骤:首先按照1.2.2提取矿物油并去除油脂,然后去除烯烃干扰物,取上层净化液注入HPLC-GC分析,观察MOSH轮廓干扰情况,如果没有受到严重影响,则无需进行氧化铝净化操作(1.2.4),否则需采用1.2.4步骤进行净化。
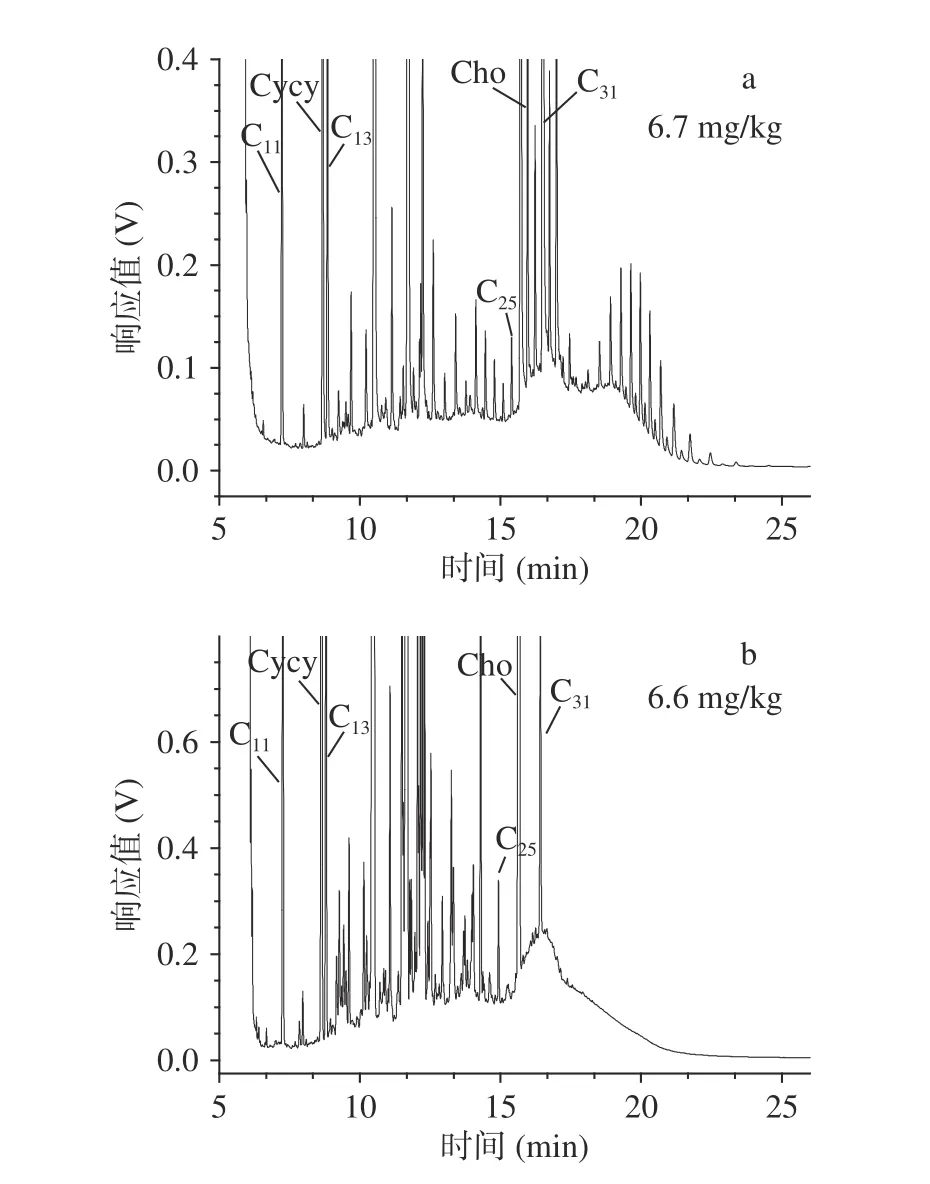
图 1 氧化铝净化前后的MOSH谱图Fig.1 Chromatograms of MOSH before and after alumina oxide purification
2.2 方法学考察
2.2.1 定量限 矿物油的实验步骤包括提取、净化、浓缩、最后注入HPLC-GC进行测定。由于HPLCGC技术的接口和HPLC处理量的限制,不可能有大量矿物油进入GC,而FID的线性范围非常宽,最高可达到7个数量级。因此,矿物油测定方法往往无需考虑其上限,只需考虑其下限(即定量限),因此,相关标准和JRC指导意见仅规定了方法的定量限,而没有规定考察方法的线性范围[9,21]。
由于矿物油是数以万计化合物的集合,其谱图呈驼峰形状,为了满足分析不确定度要求,驼峰必须距基线有足够高度。然而,驼峰高度受到碳数范围影响较大,即同样面积的驼峰,碳数范围越宽,其高度越低,即与基线越靠近;此外,基线波动与样品处理步骤和溶剂纯度等密切相关。因此,矿物油驼峰的定量限计算方法与常规尖峰的有很大差异,目前公认采用Biedermann和Grob提出的经验方法计算,即以进入GC的矿物油质量达到50~100 ng来计算定量限[18]。为了保证结果的准确可靠,本文方法定量限以进样量为100 ng计算。计算方法如下:5 g样品经过皂化、提取、浓缩、环氧化后得到约1 mL试液,其中100 μL注入HPLC-GC分析,相当于0.5 g的样品进入FID检测,以100 ng为最低的矿物油进样量,对应的定量限为0.2 mg/kg;考虑到基线波动因素:①实验过程中溶剂浓缩、微量杂质富集导致的基线波动;②不同碳数范围目标物带来的鼓包峰高度差异;③不同实验室间的重现性。本方法的定量限定为是0.5 mg/kg。
2.2.2 加标回收率和重复性 回收率的添加依据定量限添加,本文按照定量限的1倍、2倍(近似)和4倍添加(表2)。具体方法是任意选取一个样品(A6),分别添加含有0.5和2.0 mg/kg的MOSH和0.5、0.9 mg/kg的MOAH矿物油溶液,每个试样及空白分别平行测定6次(重复性),计算平均加标回收率和相对标准偏差(RSD)。由表2可知,加标回收率在90.0%~106.0%之间,RSD在1.6%~12.7%之间,均符合JRC指导意见的分析检测要求[21]。
2.3 样品分析
应用上述方法分别测定了市售的10个植物油基鱼罐头产品中MOSH和MOAH的含量,并且按照JRC要求[21]分别计算了不同碳段的相应含量,结果见表3。
尽管此次调查的样品为随机购买,但结果发现植物油基鱼罐头存在较为严重的矿物油污染。由表3发现:所有样品均检出含有MOSH,其所有碳段(C10~C50)的总含量为2.6~53.7 mg/kg,即污染最高的MOSH含量为53.7 mg/kg,并且污染主要集中在C20~C25、C25~C35、C35~C40三个碳段。毒理学研究表明C16~C35的MOSH最容易在人体蓄积[1,27-29];同时,本次调查的5个样品,即一半样品检出含有MOAH,含量为0.7~5.5 mg/kg,主要集中在C16~C25、C25~C35两个碳段。
进一步分析发现:表3中以A5、A8和A9的MOSH含量最高,分别为33.9、53.7、32.3 mg/kg,其中A5和A8中的MOAH含量高达5.5、3.0 mg/kg;而其他产品中的MOSH均低于10 mg/kg,其含量范围集中在2.6~6.7 mg/kg;这些样品相应的MOAH含量也普遍低于1.0 mg/kg,即样品的污染情况呈现出“两级分化”情况。
结合表1和表3的数据,我们可以粗略推测样品的污染来源。由于矿物油与植物油的溶解度相似,油脂含量高的食品往往容易受到矿物油污染。表1中A1、A5、A8和A9的脂肪含量均高于30%,其中有3个(A5、A8和A9)的MOSH含量最高。说明脂肪含量高的样品容易受到污染。
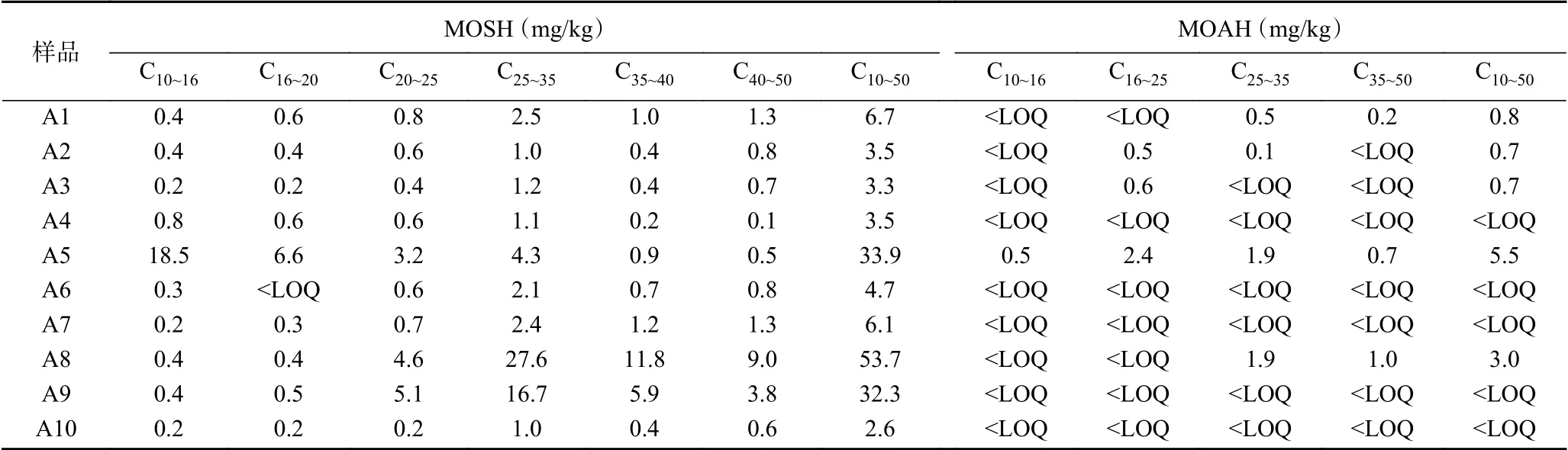
表3 植物油基鱼罐头中的矿物油含量*Table 3 Contents of MOSH and MOAH in the canned fish products
植物油中矿物油的污染与其生产加工过程密切相关,同时加工工艺又与植物油品种有关。前期的调查发现,特级初榨橄榄油、葵花籽油、大豆油等的污染较低,而橄榄果渣油、芝麻油。花生油和油茶籽油的污染普遍较高[2,25,30]。然而,此次收集的一些鱼罐头产品并没有标明其植物油种类,仅凭几个标明种类的样品,也难以找到其与矿物油污染之间的规律,例如同为橄榄油基的金枪鱼罐头(A8和A10)的污染差别很大,而橄榄油基与葵花籽油基的金枪鱼罐头(A8和A9)的污染则几乎同样严重。类似地,我们也没有发现鱼的种类、包装材质与矿物油污染的关联性。
结合表1和表3发现,来自相同厂家的A2和A3(图2)、A6和A7(图3)、A8和A9(图4)的MOSH和MOAH污染程度几乎相同,这一点也可以通过对比它们的谱图发现。通常认为,相同的谱峰形状意味着污染来源相同。由图2可知:A2和A3的MOSH均呈双驼峰,中心位置也基本一致,MOSH的中心位置在n-C27和n-C43,MOAH的中心位置在n-C18;同时它们的MOAH的形状和位置也完全相同,说明这两个样品的污染来源完全相同。由于这两个产品的鱼的品种不同,因而其污染很可能来源于植物油。

图 2 植物油基鱼罐头的矿物油分析谱图Fig.2 Chromatograms of MOSH and MOAH in two canned vegetable oil-based fish products
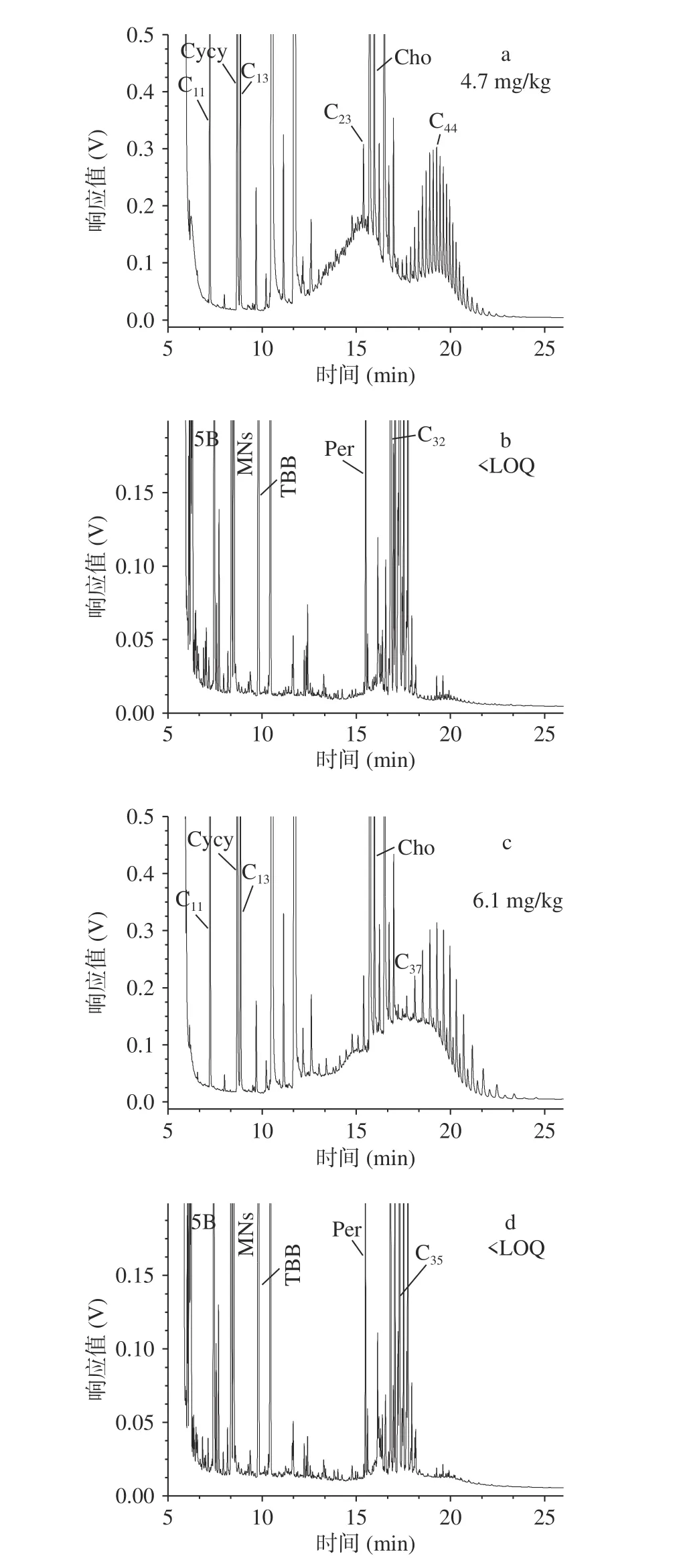
图 3 植物油基鱼罐头的矿物油分析谱图Fig.3 Chromatograms of MOSH and MOAH in the canned vegetable oil-based fish products
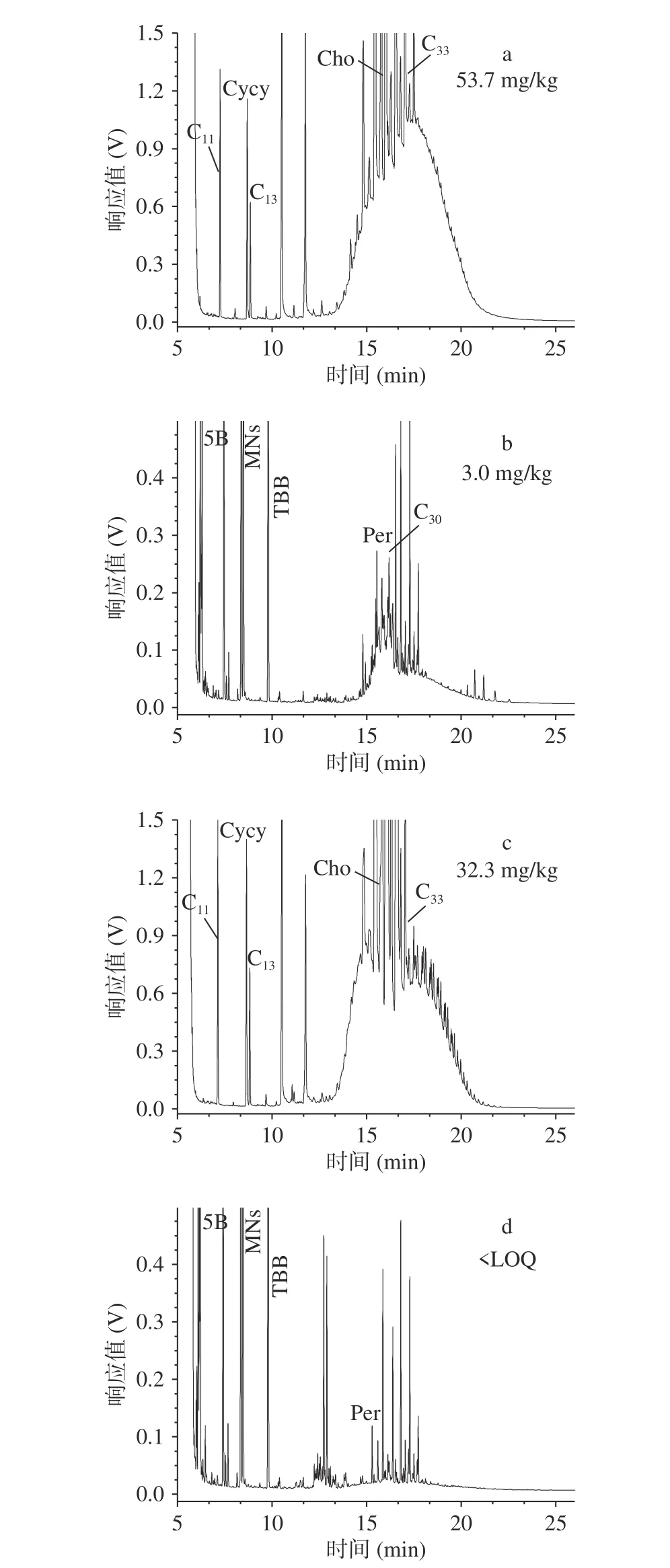
图 4 植物油基鱼罐头的矿物油分析谱图Fig.4 Chromatograms of MOSH and MOAH in the canned vegetable oil-based fish products
A6和A7(图3)为同一厂家的两个样品,他们除了脂肪含量不同,鱼类、植物油种类和包装材料相同;但其谱图表明:这两种样品MOSH的驼峰形状不一样,MOAH谱图基本一致。对照这两个产品的标签,A7样品中添加了浓缩大豆蛋白,而A6没有。因此,这两个产品的矿物油污染来源可能是鱼肉和添加的浓缩大豆蛋白。
样品A8和A9也来自同一个生产厂家,但其污染情况与上述两个厂家略有不同。由表3可知,A8和A9的矿物油污染含量差别较大。由图4也可看出两个样品的MOSH的驼峰形状类似,但MOAH谱图不完全一致。因此,这两个产品的矿物油来源可能不止一个,这两个样品均为金枪鱼罐头,只是植物油种类不同,因而,其矿物油污染很可能来自鱼肉和植物油,并且鱼肉的污染来源占比更大一些。
综上,我国市售的植物油基鱼罐头存在较为严重的矿物油污染,有一半的收集样品含有毒性较大的MOAH,其污染与生产厂家高度相关,污染来源主要是植物油和鱼肉原料。
3 结论
本文基于国际标准DIN EN16995:2017的环氧化反应和HPLC-GC技术,通过实验确定了植物油基鱼罐头的皂化反应条件,达到高效、便捷提取矿物油和去除油脂的目的,从而建立了市售植物油基鱼罐头中MOSH和MOAH的高灵敏度分析方法,方法定量限达到0.5 mg/kg,回收率为90.0%~106.0%,满足了JRC指导意见中的分析要求。本文应用该方法调查分析了北京地区市售的10个植物油基鱼罐头产品,结果发现所有样品均含有MOSH,范围2.6~53.7 mg/kg,其中一半样品含MOAH,范围为0.7~5.5 mg/kg。由于矿物油对人体健康有危害,特别是MOAH有潜在的致癌致畸毒性,因此希望相关部门加强监管,以保障鱼罐头等产品的质量安全。
