超声-微波辅助酶法提取糜子麸皮可溶性膳食纤维及其抗氧化活性分析
2022-06-11颜飞翔朱立斌苗欣月牛广财魏文毅
颜飞翔,朱立斌,朱 丹 ,苗欣月,牛广财, ,魏文毅
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.黑龙江省农产品加工工程技术研究中心,黑龙江大庆 163319;3.黑龙江八一农垦大学生命科学技术学院,黑龙江大庆 163319)
糜子(Panicum miliaceumL.)又叫稷、黍和糜,属禾本科黍属,耐旱且生长期短,在我国华北、东北和西北等地均有栽培[1-2]。糜子麸皮是糜子加工中的副产品,在加工制米之后,糜子麸皮基本属于废弃物,没有得到充分利用,造成了资源浪费。糜子麸皮中含有丰富的天然活性成分,如酚类化合物[3]、膳食纤维、矿物质和维生素等。但是,目前国内对于糜子在食品方面的利用,主要通过与小麦粉等复配改善其加工特性,以及作为酿酒原料和地方小吃为主,相关产物的开发应用还不够,尤其缺乏对糜子副产物的深入研究[4]。膳食纤维(Dietary fiber,DF)是食物中不被人体胃肠消化酶所分解、不可消化植物成分的总称,包括水溶性膳食纤维(Soluble dietary fiber,SDF)和不溶性膳食纤维(Insoluble dietary fiber,IDF)[5]。膳食纤维因具有预防肥胖症[6]、心脑血管疾病[7]、改善肠道微环境[8]以及调节血糖及血脂水平[9-10]等诸多生理功能,成为了近年来营养学研究的热点。而可溶性膳食纤维(soluble dietary fiber,SDF)含量的多少对于评价膳食纤维生理功能具有重要意义,因此,对膳食纤维中SDF的研究有助于进一步探索膳食纤维的品质及生理功能。
关于麸皮和果渣类可溶性膳食纤维的提取方法,有酶法、化学法、发酵法、膜分离法及物理法等方法。其中,新发展出一些辅助的方法,如微波、超声、加压、超临界等物理技术[11],将多种方法协同使用是一种高效环保的提取方式,可以结合每种方法的优点,在提高得率的同时保证其生物活性。其中,超声-微波协同提取技术日趋成熟,该技术充分利用微波的高能作用和超声波的空化作用,实现对有效成分在常压下进行充分提取[12],在可溶性膳食纤维的提取方面得到了很好的应用。例如,董玉玮等[13]分别采用超声法和超声结合酶法对红薯渣中SDF进行提取,结果表明,超声水提取红薯渣中SDF提取率为5.64%;而采用超声结合酶法提取最佳工艺条件为加酶量1.5%、料液比1:30(g/mL)、时间20 min、功率100 W,此时,红薯渣中SDF提取率为7.29%,其对羟基和超氧自由清除率的IC50值分别为3.94和0.35 mg/mL。唐小闲等[14]采用超声-微波辅助酶法对莲藕中膳食纤维进行提取,得到最佳工艺为:料液比 1:13(g/mL)、超声功率300 W、超声时间15 min、纤维素酶添加量0.6%、酶解温度60 ℃,该条件下膳食纤维提取率为36.83%。吴俊男等[15]采用微波-酶法对小麦麸皮中可溶性膳食纤维进行处理并测定其抗氧化活性,在微波功率280 W,微波时间90 s,酶添加量1.5%,酶解时间20 min的条件下处理的小麦麸皮SDF,其DPPH自由基清除率约为70%。由此可见,采用超声、微波和酶法相结合的方法对膳食纤维进行提取,是一种高效简洁的方法,且提取的样品具有较好的生物活性。
目前,尚未有采用超声-微波辅助酶法对糜子麸皮中可溶性膳食纤维进行研究。本研究以糜子麸皮为原料,采用超声-微波辅助酶法提取糜子麸皮可溶性膳食纤维,并且对其抗氧化活性进行分析,以期为糜子麸皮膳食纤维的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
糜子麸皮 黑龙江省肇源县产龙黍23品种,砻米后的副产物,其中总膳食纤维含量36.44%,蛋白含量10.1%,灰分含量15.4%;纤维素酶Celluclast 1.5L(酶活117.4 U/mL)、木聚糖酶shearzyme 500L(酶活500 FXU (S)/g)、高温α淀粉酶Termamyl SC(酶活120 KNU/g)、碱性蛋白酶Alcalase 2.4FG(酶活2.4 AU/g) 诺维信(中国)生物技术有限公司;1,1-二苯基-2-苦肼基自由基(DPPH) 梯希爱(上海)化成工业发展有限公司;2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS) 上海源叶生物科技有限公司;无水乙醇、维生素C、过硫酸钾、过氧化氢、无水碳酸钠、硫酸亚铁等 均为国产分析纯。
GY-FS-02多功能高速粉碎机 江西赣云食品机械有限公司;EX324电子分析天平 奥豪斯仪器(上海)有限公司;XH-300A型电脑微波超声波合成/萃取仪 北京祥鹄科技发展有限公司;L420台式低速离心机 湖南湘仪实验室仪器开发有限公司;ALPHA冷冻干燥机 德国Christ公司;RE 3000 A旋转蒸发仪 上海亚荣生化仪器厂;UV-1100紫外可见分光光度计 上海凌析达仪器;TECAN-sunrise酶标仪 奥地利Tecan公司;SX2-8-13NP马弗炉上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 复合酶法提取糜子麸皮SDF
1.2.1.1 制备工艺 糜子麸皮经粉碎,正己烷脱脂,采用1%的耐高温α-淀粉酶,调节pH为6.5,在95 ℃反应30 min脱除淀粉,采用2%碱性蛋白酶,调节pH为8.0,在50 ℃反应30 min脱除蛋白,100 ℃沸水浴10 min灭酶,55 ℃烘干后,备用。固定液料比30:1 mL/g,复合酶(纤维素酶:木聚糖酶为1:1)添加量1.4%,调节酶解温度、酶解时间、酶解pH、复合酶比例进行酶解,结束后4000 r/min离心15 min收集上清液,用旋转蒸发仪浓缩至原体积的1/3;用4倍体积的无水乙醇醇沉12 h;收集沉淀,冷冻干燥后,加适量水复溶后配成5%的溶液,4 ℃下蒸馏水透析(3500 Da)48 h,每8 h换一次水,冷冻干燥后,得到糜子麸皮可溶性膳食纤维。
1.2.1.2 单因素实验 以液料比为30:1 mL/g,酶解时间4 h,酶解温度55 ℃,酶解pH为5.0,复合酶添加量为1.4%,纤维素酶:木聚糖酶比例为1:1为固定条件,考察复合酶(纤维素酶:木聚糖酶)比例(2:1、1.5:1、1:1、1:1.5、1:2)、酶解pH(4.0、4.5、5.0、5.5、6.0)、酶解时间(1、2、3、4、5 h)、酶解温度(45、50、55、60、65 ℃)对糜子麸皮SDF得率的影响。
1.2.2 超声-微波辅助酶法提取糜子麸皮SDF
1.2.2.1 提取工艺 调节不同液料比、提取温度、协同时间、超声功率和微波功率进行超声-微波协同提取,在超声波和微波的共同作用结束后,调节pH为5.0,然后调节复合酶(纤维素酶:木聚糖酶为1:1)添加量,于55 ℃下酶解4 h。结束后4000 r/min离心15 min收集上清液,之后步骤同1.2.1.1制备工艺中的方法。
1.2.2.2 单因素实验 以液料比30:1 mL/g,超声功率250 W,微波功率200 W,提取温度50 ℃,复合酶添加量1.2%,协同时间20 min为固定条件,考察液料比(15:1、20:1、25:1、30:1、35:1 mL/g)、协同时间(10、20、30、40、50 min)、提取温度(40、45、50、55、60 ℃)、超声功率(150、200、250 、300、350 W)、微波功率(100、200、300、400、500 W)、复合酶添加量(0.8%、1.0%、1.2%、1.4%、1.6%)对糜子麸皮中SDF得率的影响。
1.2.3 超声-微波辅助酶法提取糜子麸皮SDF响应面试验设计 在单因素实验的基础上,以糜子麸皮SDF得率(Y)为响应值,根据 Box-Behnken试验设计原理,选取A液料比、B协同时间、C提取温度、D复合酶添加量4个因素,优化超声-微波辅助酶法提取糜子麸皮SDF的工艺参数。响应面试验设计见表1。
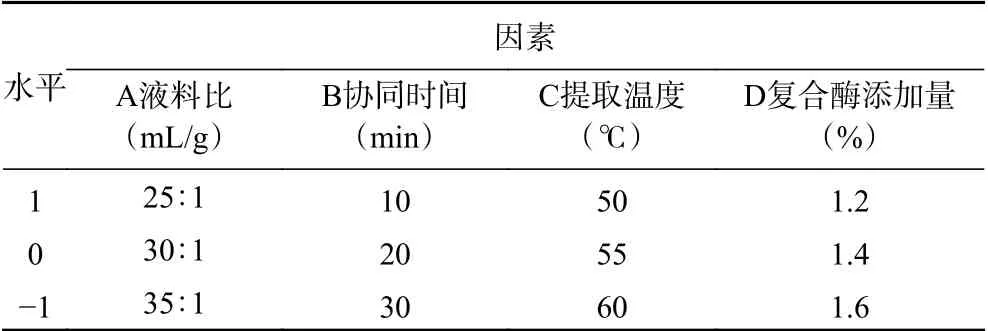
表1 响应面试验因素与水平表Table 1 Response surface experimental factors and levels
1.2.4 计算方法 糜子麸皮SDF得率的计算,按照公式(1)进行计算。
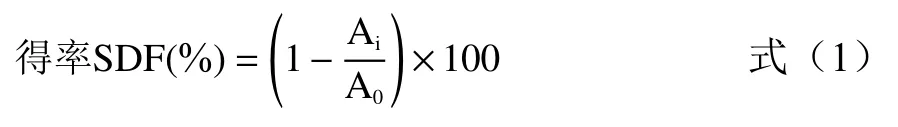
1.2.5 糜子麸皮中总膳食纤维及灰分的测定 总膳食纤维的测定参照国标GB 5009.88-2014《食品中膳食纤维的测定》;灰分的测定参照国标GB 5009.4-2016《食品中灰分的测定》。
1.2.6 糜子麸皮SDF中蛋白含量的测定 参照杨静等[16]的方法,采用考马斯亮蓝法测定糜子麸皮SDF中蛋白含量,以牛血清白蛋白为标准蛋白溶液,绘制得标准曲线:y=0.0057x+0.0207,R2=0.9979。
1.2.7 糜子麸皮SDF体外抗氧化性实验
1.2.7.1 DPPH自由基清除率的测定 采用李治龙等[17]的方法略有改动。配制0.5 mmol/mL的DPPH溶液100 mL。取2 mL稀释10倍后的样液,加入0.5 mL的DPPH溶液,混合均匀后于37 ℃下避光20 min,用无水乙醇调零,在517 nm条件下测定其吸光度Ai;用同体积的无水乙醇代替样品溶液,测其吸光值为Ac,用同体积的无水乙醇代替DPPH溶液,测其吸光值为Aj。按照(2)式计算DPPH自由基清除率。

1.2.7.2 ABTS+自由基清除率的测定 参照宋艺君等[18]的方法,略有修改。分别配制50 mL的7 mmol/L的ABTS溶液和2.45 mmol/L的K2S2O8溶液,之后将两种溶液1:1混合后于室温下暗处静置一夜,即得储备液。然后用无水乙醇稀释到其吸光值在0.7±0.2,得到ABTS工作液。取20 μL不同浓度的糜子麸皮SDF于试管中,加入2 mL的ABTS工作液,混匀,室温下静置10 min,用蒸馏水调零,在734 nm处测其吸光度值为Ai,用同体积的蒸馏水代替样品,测定吸光值为A0。按照式(3)计算ABTS自由基清除率。
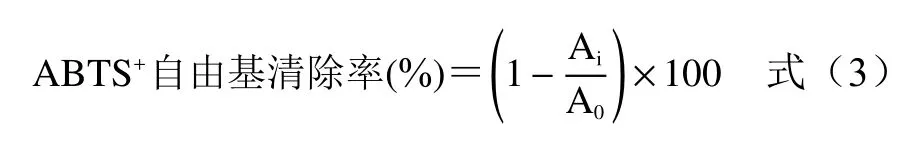
1.2.7.3 羟自由基清除率的测定 按照董佳萍等[19]的方法进行测定。取0.1 mL样品,加入2 mL 6 mmoL/L的过氧化氢溶液以及FeSO4溶液,摇匀静置10 min后,加入2 mL 6 mmoL/L的水杨酸溶液,摇匀,放置37 ℃恒温水浴中1 h,在波长510 nm下测定吸光度A1。以去离子水为参比溶液,测定吸光度A0,以同体积的蒸馏水代替水杨酸溶液,测定吸光度A2。按式(4)计算羟自由基清除能力。
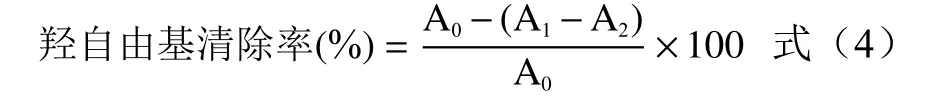
1.2.7.4 还原力的测定 按照程宏桢等[20]的方法进行测定。精确吸取不同浓度2.0 mL的糜子麸皮SDF溶液,分别加入0.2 mo L/L pH=6.6的磷酸盐缓冲液2.5 mL和1%的铁氰化钾溶液2.5 mL,振荡混匀,50 ℃水浴30 min,之后迅速冷却,加入10%三氯乙酸溶液2.5 mL,然后在4000 r/min条件下离心10 min,取2.5 mL上清液,加入2.5 mL蒸馏水和0.5 mL的0.1%三氯化铁溶液,振荡混匀,以蒸馏水为参比,在在波长700 nm处测定吸光度值。
1.3 数据处理
2 结果与分析
2.1 复合酶法提取糜子麸皮SDF单因素实验结果
2.1.1 复合酶比例对糜子麸皮SDF得率的影响 由图1可知,当木聚糖酶添加量逐渐大于纤维素酶添加量时,SDF得率明显升高,当木聚糖酶:纤维素酶为1:1时,得率最大,而当木聚糖酶比例超过纤维素酶时,又呈下降趋势。这可能是由于两种酶的作用机制的差异而导致的。由于纤维素酶可以把纤维素水解为半纤维素,而木聚糖酶则作用于半纤维素。因此,当木聚糖酶量升高时,把更多的半纤维素转化为可溶性的,从而使SDF得率升高[21],但当木聚糖酶含量过高时,可溶性半纤维素降解为小分子低聚糖的速度超过了其生成速度,从而导致SDF得率下降[22],因此选择纤维素酶:木聚糖酶为1:1时最宜,此时糜子麸皮SDF得率为2.60%。
2.1.2 酶解pH对糜子麸皮SDF得率的影响 从图2中结果可知,SDF得率随着pH的升高而不断增加,在pH5.0时达到最高值2.74%,但pH大于5.0时,SDF得率逐渐减小。原因是酶与底物的结合受反应体系pH值影响,先随着pH的增大,逐渐达到酶的最适pH[23],酶促反应速率也达到最大值。超过其最适pH后,酶的活性降低,从而影响酶与底物的结合,使酶解反应速率变慢,SDF得率随之下降,因此pH 5.0是最适宜的酶解pH,此时糜子麸皮SDF得率为2.74%。
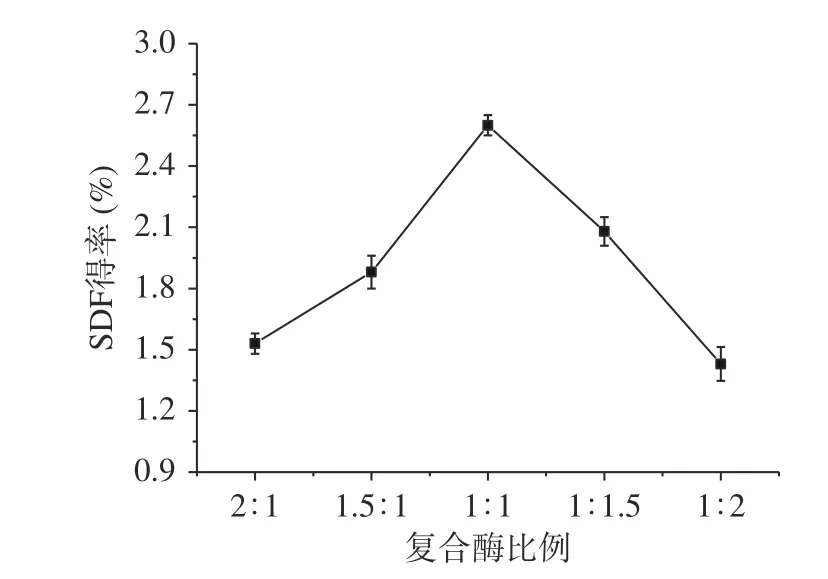
图 1 复合酶比例对糜子麸皮SDF得率的影响Fig.1 Effect of compound enzyme ratio on SDF yield in millet bran
2.1.3 酶解时间对糜子麸皮SDF得率的影响 从图3中结果可知,SDF得率随着时间的延长而明显增加,在4 h时达到最高值2.58%,但超过4 h时SDF得率逐渐降低。原因是SDF主要成分是果胶,而果胶中的原果胶是不溶于水的物质,随着延长酶解时间,利于糜子麸皮中果胶质充分酶解,但酶解时间过长,果胶被分解成-1,4-D聚半乳糖醛酸,不能被乙醇沉淀出来[23-24],从而其得率降低。因此确定最适酶解时间是4 h,此时糜子麸皮SDF得率为2.58%。
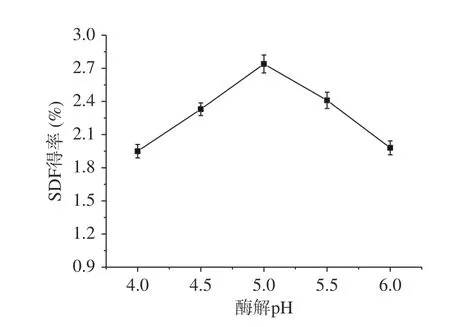
图 2 酶解pH对糜子麸皮SDF得率的影响Fig.2 Effect of enzymatic hydrolysis pH on SDF yield in millet bran
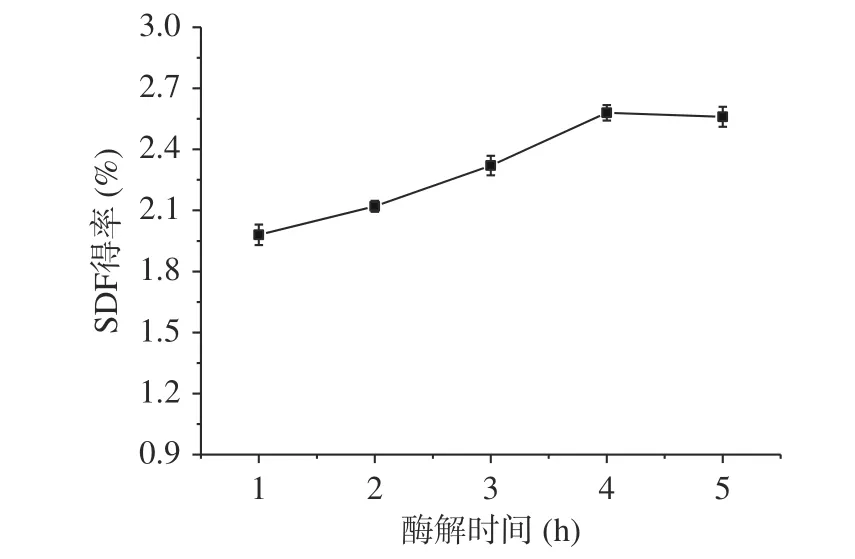
图 3 酶解时间对糜子麸皮SDF得率的影响Fig.3 Effect of enzymatic hydrolysis time on SDF yield in millet bran
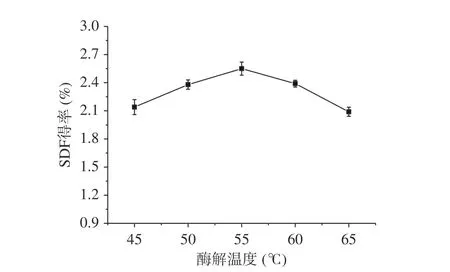
图 4 酶解温度对糜子麸皮SDF得率的影响Fig.4 Effect of enzymatic hydrolysis temperature on SDF yield in millet bran
2.1.4 酶解温度对糜子麸皮SDF得率的影响 从图4中结果可知,SDF得率先随着温度的升高而明显增加,在温度55 ℃时达到最大值2.55%,但温度继续升高,SDF得率逐渐下降。原因是适宜的温度使纤维的结构松散,暴露出更多的侧链基团,增大了底物与酶的接触面积,促进酶解反应。温度过高时,会破坏SDF的主要成分果胶和β-葡聚糖的分子结构[25],从而降低SDF得率。也可能由于温度过高使酶的活性降低,反应速率也会随之减慢。因此确定最适酶解温度为55 ℃,此时糜子麸皮SDF得率为2.55%。
2.2 超声-微波辅助酶法提取糜子麸皮SDF单因素实验结果
2.2.1 液料比对糜子麸皮SDF得率的影响 由图5中液料比的变化对糜子麸皮SDF得率的影响可知,随着液料比的增大,糜子麸皮SDF的得率也随之增加,当液料比为30:1 mL/g时,得率达到最大(6.02%)。这是因为在一定浓度范围内,溶剂可以有效地吸收微波,使物料适度膨胀,有利于增加接触物料和溶剂之间的表面积,从而提高可溶性膳食纤维的溶出[26]。当液料比高于30:1 mL/g时,得率开始下降。这可能是因为,随着溶剂用量的持续增加,微波能对物料的作用力减弱,使得溶出的SDF开始减少[27]。Ying等[28]研究认为,可能是高比例的溶剂与溶质比,延长了溶质向内部组织的扩散距离,致使SDF含量降低。因此,选择液料比为30:1 mL/g,此时糜子麸皮SDF得率为6.02%。
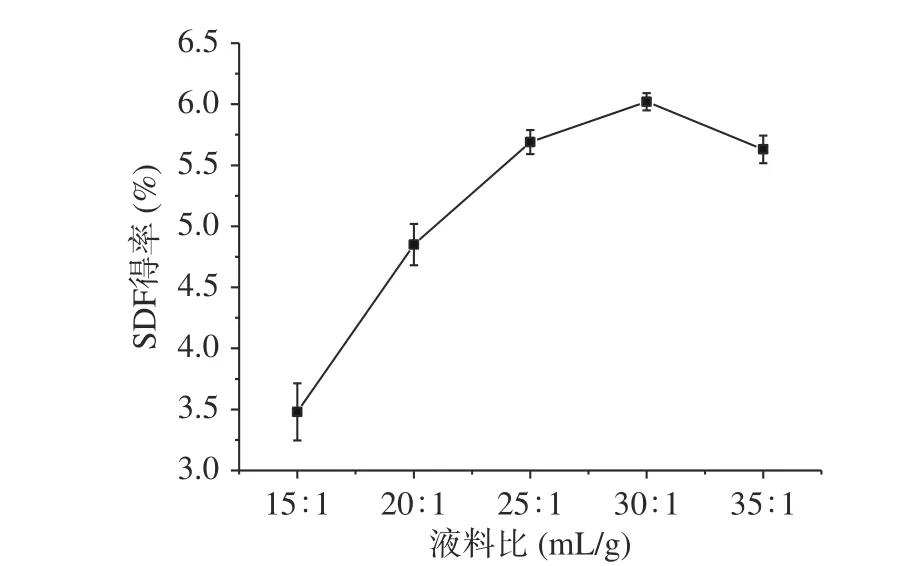
图 5 液料比对糜子麸皮SDF得率的影响Fig.5 Effect of liquid-solid ratio on SDF yield in millet bran
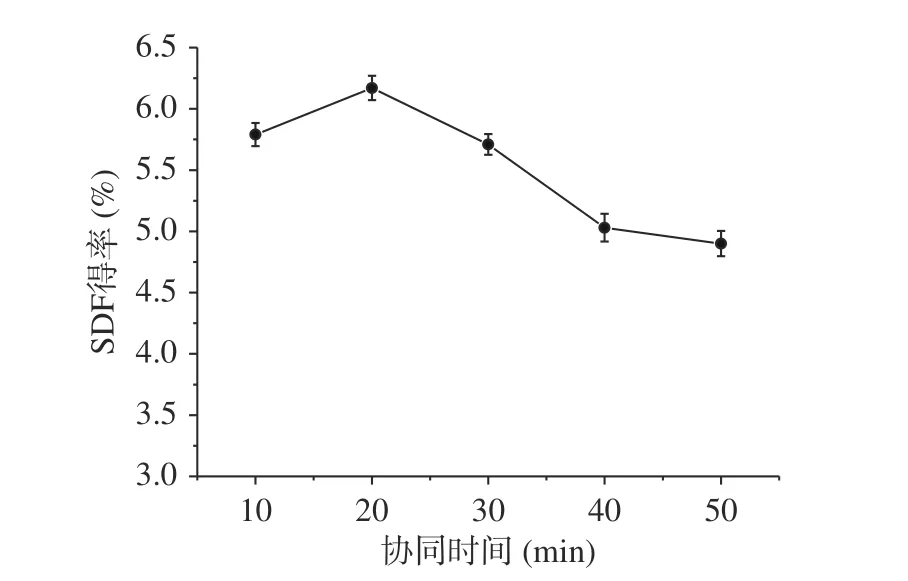
图 6 协同时间对糜子麸皮中SDF得率的影响Fig.6 Effect of synergistic time on SDF yield in millet bran
2.2.2 协同时间对糜子麸皮SDF得率的影响 由图6中协同时间对糜子麸皮SDF得率的影响曲线可知,糜子麸皮SDF得率在20 min时候达到最大值6.17%,之后随着提取时间的延长,则呈下降趋势。超声波增强传质的作用使SDF更容易释放和扩散到水中,同时在微波的作用下,糜子麸皮可以吸收微波的能量,热量的积累进一步促进SDF溶解到溶液中,但是时间过长可能导致SDF降解,导致提取率降低[29]。因此,选择协同时间为20 min,此时糜子麸皮SDF得率为6.17%。
2.2.3 提取温度对糜子麸皮SDF得率的影响 图7反映了提取温度对糜子麸皮SDF得率的影响,随着提取温度的升高,糜子麸皮SDF得率呈现先增加后降低的趋势。这可能是因为随着温度的升高,SDF在水中的溶解度增大,从而使 SDF得率增大。升温导致SDF在水中的溶解度增大,但过高的温度会使其发生降解,故当温度超过50 ℃时,得率降低[30]。也有研究表明,可能是高温和超声的双重作用导致SDF的结构破坏,进而造成得率的下降[31]。因此,选择提取温度为50 ℃,此时糜子麸皮SDF得率为5.73%。
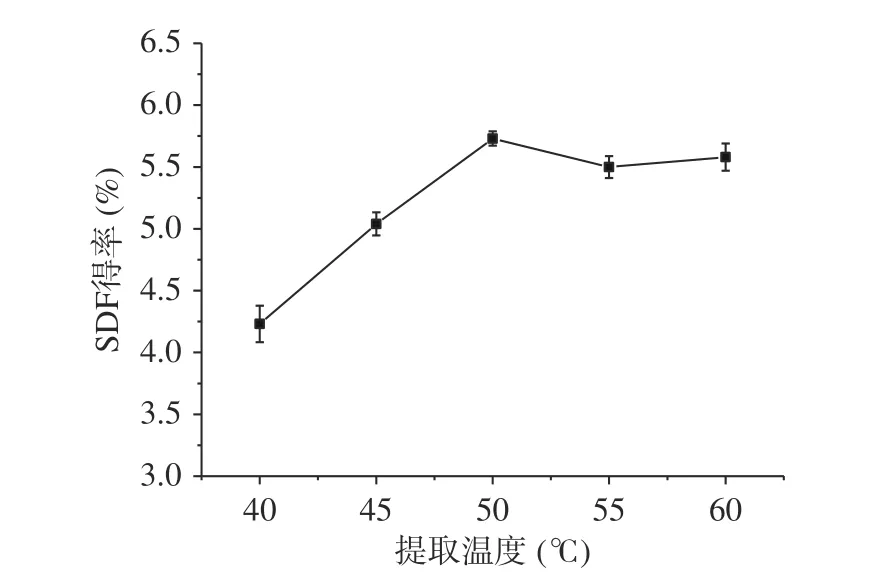
图 7 提取温度对糜子麸皮中SDF得率的影响Fig.7 Effect of extraction temperature on SDF yield in millet bran
2.2.4 超声功率对糜子麸皮SDF得率的影响 由图8可知,随着超声功率增加,膳食纤维提取率先快速升高后又快速降低。在超声功率250 W时,膳食纤维提取率最大,为5.71%。主要是超声波能在物料内部产生振动,超声功率较小时对植物细胞和分子间的作用较小,超声功率增大时,空化效应更强烈[32],膳食纤维的提取率增大,但功率过大时致使膳食纤维结构破坏,提取率下降。由于超声功率在250 W时已经达到较高的得率,因此,选择250 W为固定的超声功率条件,进行后续响应面试验。
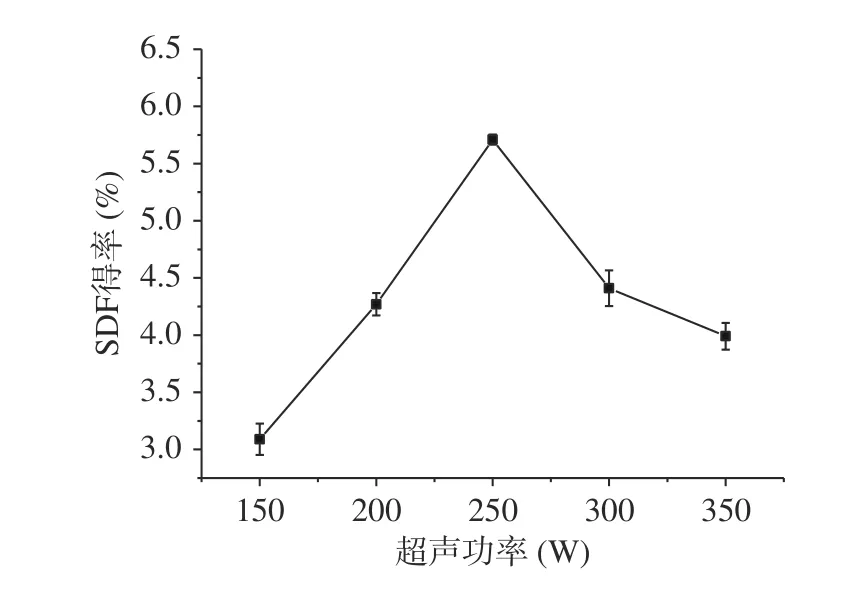
图 8 超声功率对糜子麸皮中SDF得率的影响Fig.8 Effect of ultrasonic power on SDF yield in millet bran
2.2.5 微波功率对糜子麸皮SDF得率的影响 由图9可知,随着微波功率的增加,糜子麸皮SDF的得率增加,当微波功率为200 W时,得率为最高值6.04%,这可能是由于微波的热效应导致细胞破裂,有利于SDF进入溶剂中[26],同时,纤维素、半纤维素等粗纤维成分被选择性加热,水解成低聚寡糖[33],从而使糜子麸皮SDF增加,但是过高的微波功率会导致膳食纤维发生降解,从而导致产率降低。本实验中微波功率变化不大,因此,选择200 W为微波固定的功率条件。
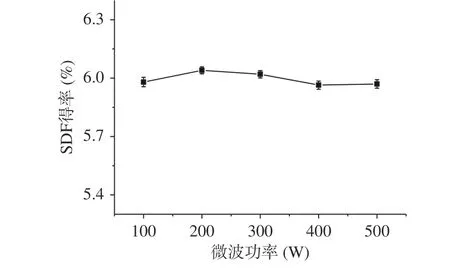
图 9 微波功率对糜子麸皮中SDF得率的影响Fig.9 Effect of microwave power on SDF yield in millet bran
2.2.6 复合酶添加量对糜子麸皮SDF得率的影响在图10所示的复合酶添加量对糜子麸皮SDF得率的曲线中,随着复合酶添加量的增加,糜子麸皮SDF得率呈现先增加后下降的趋势。当酶促反应中酶的浓度过低,会导致酶解不完全,从而使得可溶性膳食纤维含量较低[34]。在加酶量为1.4%时,可溶性膳食纤维得率最高,为5.47%。当复合酶添加量低于1.4%的时候,复合酶能将不溶性膳食纤维转化成可溶性膳食纤维。但当酶的浓度过高时,会使得部分膳食纤维被水解成不能被乙醇沉淀的低聚糖,反而降低其得率[13]。因此,选择复合酶添加量为1.4%,此时糜子麸皮SDF得率为5.47%。
2.3 超声-微波辅助酶法提取糜子麸皮SDF响应面优化
2.3.1 响应面试验结果 按照选取的A液料比、B协同时间、C提取温度、D复合酶添加量,进行四因素三水平中心组合实验,结果见表2。
2.3.2 回归方程的建立及方差分析 利用Design-Expert 8.0.6数据分析软件对表3中数据进行处理,经回归拟合后得到二次回归方程:Y=6.33+0.30A+0.24B+0.20C+0.096D-0.10AB-0.060AC-0.10AD-0.097BC+2.500E-003BD-0.048CD-0.66A2-0.75B2-0.73 C2-1.05 D2。
对模型方程进行方差分析,分析结果见表3。
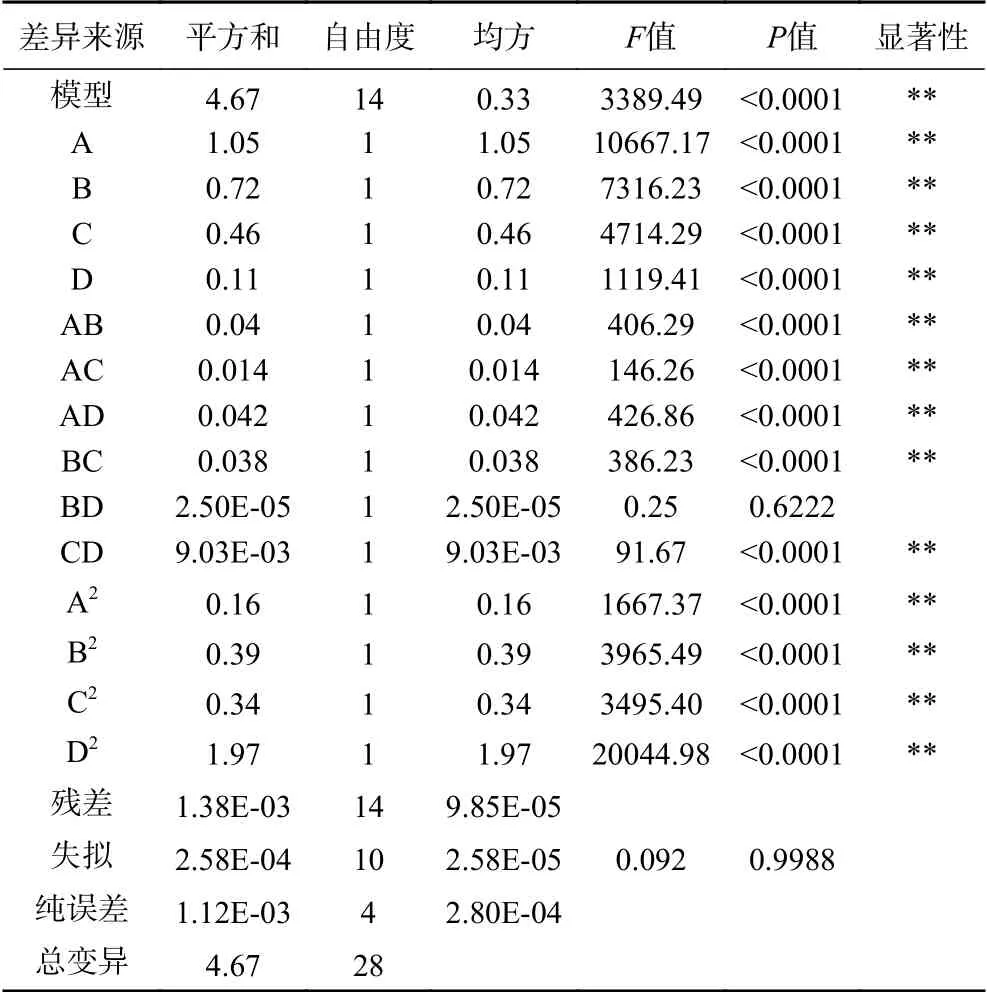
表3 回归模型的方差分析Table 3 Analysis of variance of regression model
由表3可知,模型P<0.0001,极显著;失拟项P=0.9988>0.05,不显著,说明本实验的二次回归方程的结果可靠,可以对响应值进行预测;决定系数R2=0.9999,校正系数RAdj2=0.9998,能够解释实验99.98%的响应值变异,表明理论值与实际值拟合良好,可用于糜子麸皮SDF提取工艺的分析和优化。由F值可知,各因素对糜子麸皮SDF得率的影响大小顺序为液料比(A)>协同时间(B)>提取温度(C)>复合酶添加量(D)。
2.3.3 响应面分析 响应曲面反映了当液料比、协同时间、提取温度以及复合酶添加量等四个因素的任意两个变量取零点水平时,其他两个因素的交互作用对糜子麸皮SDF得率的影响。其相应曲面坡度越陡峭,等高线越接近于椭圆形,说明各因素之间交互作用越显著[35]。
通过响应面图11,同时结合表3可知,在所有交互项中,除BD之间交互作用对响应值的影响不显著之外,其它因素之间的交互作用对响应值的影响均极显著(P<0.01)。其中,AD交互作用对响应值的影响最强,表明液料比和复合酶添加量对糜子麸皮SDF得率的影响最为明显。随着液料比和复合酶添加量的增加,糜子麸皮SDF得率先增加后减少,且液料比相应曲面较陡,其影响程度大于复合酶添加量;当液料比为30:1 mL/g,复合酶添加量为1.4%时,为临界最佳参数;当提取温度和协同时间同时增加时,糜子麸皮SDF得率先增加后减少,协同时间曲面陡于提取温度,表明协同时间比超声功率影响大。因此,在实际操作中,应充分考虑各因素的交互影响,慎重控制各因素的用量,以保证糜子麸皮SDF的得率。
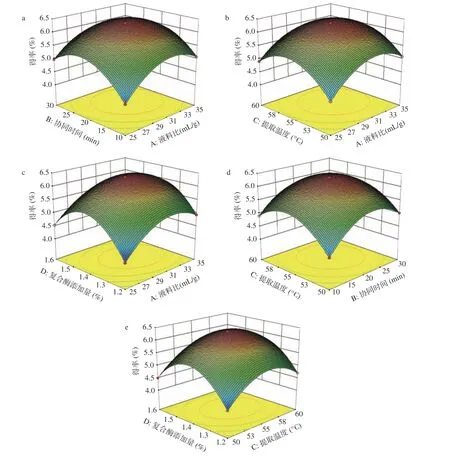
图 11 各因素对糜子麸皮SDF得率的交互作用Fig.11 Interaction of various factors on SDF yield of millet bran
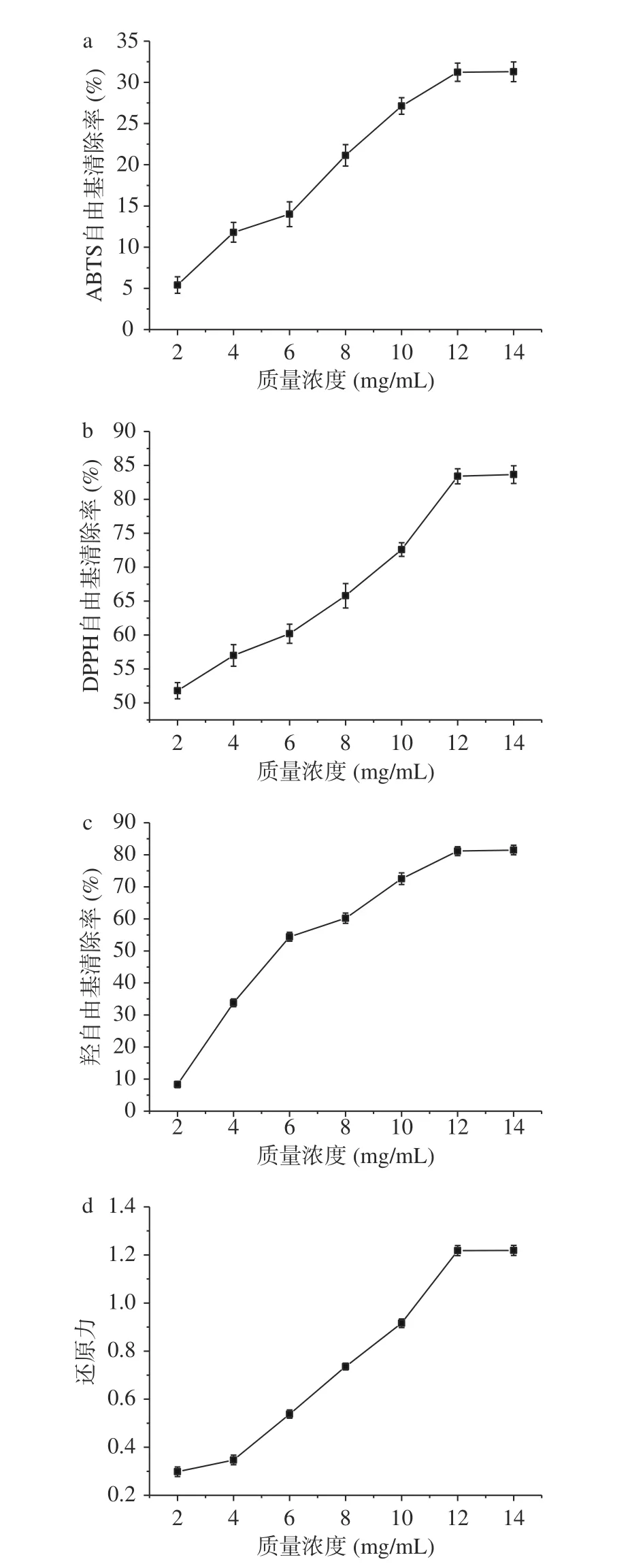
图 12 糜子麸皮SDF的体外抗氧化能力Fig.12 Anti-oxidant capacity of millet bran SDF from millet in vitro
2.3.4 验证性实验 由二次回归方程预测糜子麸皮SDF的最佳提取条件为:液料比31:1 mL/g,协同时间21 min,提取温度56 ℃,复合酶添加量1.4%,此条件下其SDF得率的理论预测值为6.39%。为验证上述结果的可靠性和稳定性,采用液料比31:1 mL/g,协同时间21 min,提取温度56 ℃,复合酶(纤维素酶:木聚糖酶为1:1)的添加量1.4%,pH5.0,于55 ℃下酶解4 h。经过3次实验证实,在上述条件下糜子麸皮SDF得率为6.35%±0.05%,与预测的理论值误差较小。说明实验结果与模型符合良好,可以用该模型对糜子麸皮中SDF的得率进行预测。同时,对醇沉后的样品进行透析和冷冻干燥,计算得到样品中所含的SDF含量为91.27%,纯度较高。
2.4 糜子麸皮SDF体外清除自由基的能力
由图12可以看出,在实验浓度范围内,糜子麸皮SDF抗氧化能力和浓度呈现一定的量效关系,即随着糜子麸皮SDF浓度的增大,其抗氧化效果也而逐步增强,特别是对于DPPH自由基和羟自由基有较好的清除能力。当糜子麸皮SDF样品质量浓度达14 mg/mL时,对DPPH自由基清除率为83.65%,低于1 mg/mL的VC清除率(95.40%),通过SPSS25.0分析,其IC50值为2.45 mg/mL。对于羟自由基清除能力来说,当样品质量浓度小于6 mg/mL时,其清除能力随样品浓度升高而明显加强;当样品质量浓度达14 mg/mL时,对羟自由基清除率达到最大,为81.48%,低于1 mg/mL的VC清除率(92.97%),其IC50值为5.98 mg/mL。糜子麸皮SDF的还原力以及对于ABTS+自由基的清除能力较弱,当样品浓度达14 mg/mL时,其还原力和对于ABTS+自由基的清除率分别为1.219和31.29%,均远远低于1 mg/mL的Vc抗氧化能力(1.422和94.12%),ABTS+自由基的IC50值为26.15 mg/mL。由此可以看出,糜子麸皮SDF对DPPH自由基和羟自由基的清除能力较强。
3 结论
将超声-微波辅助酶法应用到糜子麸皮可溶性膳食纤维的提取中,利用响应面法优化得出其最佳提取工艺条件为:液料比为31:1 mL/g、协同时间21 min、提取温度56 ℃、复合酶添加量1.4%,该条件下糜子麸皮SDF得率为6.35%。抗氧化活性表明,当样品浓度为14 mg/mL时,糜子麸皮SDF的还原力为1.219,其对于DPPH自由基清除率、ABTS+自由基清除率和羟自由基清除率的IC50值分别为2.45、26.15和5.98 mg/mL,说明糜子麸皮SDF有一定的抗氧化活性。该研究结果为糜子麸皮可溶性膳食纤维的提取提供依据,为后续应用提供了理论依据。
