响应面法优化弗托氏葡糖酸杆菌产羟基乙酸工艺条件
2022-06-11郭秋爽刘宇鹏
蔡 帅,郭秋爽,刘 炎,孙 杨,李 华,刘宇鹏,
(1.河南大学生命科学学院微生物工程研究所,河南开封 475004;2.河南省应用微生物工程研究中心,河南开封 475004)
羟基乙酸别名乙醇酸或甘醇酸,是最简单的脂肪族羟基酸。是一种无色、无味、半透明的固体。分子量为76.05,熔点为75 ℃,加热至沸点时分解,溶于水、甲醇、乙醇、乙酸乙酯等有机溶剂,微溶于乙醚,不溶于烃类。兼有醇与酸的双重性,羟基乙酸毒性低、腐蚀性小、气味低、不易燃、可生物降解、有高水溶性[1-4]。羟基乙酸作为医药中间体,它广泛应用于薄荷脑与奎宁(金鸡纳碱)的酯类制备及其他医药品的合成[5-6];利用羟基乙酸的低聚物/衍生物加入到食品中,并通过该低聚物/衍生物的自发水解以控制的方式酸化该食品,保护食品免受有害微生物繁殖[7-8];羟基乙酸还可作为一种有机化工原料,用于化学清洗、日用化工、生物降解新材料及杀菌剂等领域[9-10]。
羟基乙酸在自然界中主要存在于甘蔗、甜菜及未成熟的葡萄中,但含量很少。目前羟基乙酸的制备方法主要有化学合成法以及生物催化法,1848年杜邦公司首次利用甘氨酸氧化法合成羟基乙酸,但此方法中原料甘氨酸价格昂贵,而且得到的产物较为复杂,较难分离[11];氯乙酸水解法,氯乙酸在强碱作用下水解生成羟基乙酸,但此法在后续产物分离部分过程复杂,而且造成环境污染严重,实现工业化生产较为困难[12];草酸电解还原法,草酸电解还原法的原理是首先电解生成乙醛酸,然后再被还原成羟基乙酸,20世纪90年代在部分发达国家实现了工业化生产,但该法耗能高、产物复杂、生产成本较高[13];羟基乙腈酸水解法,用羟基乙腈作原料,在酸性条件下直接水解制得,经萃取、脱盐、反萃取、脱水等过程得到产品[14];此外还有甲醛法[15]、乙二醛合成法[16]、草酸二甲酯催化加氢法[17-18]、乙二醇选择性氧化法等化学合成法[19-20]。生物法因其反应条件温和,选择特异性高,得到的产品纯度较高,环境友好性较强等优点,近年来一直为人们所青睐,日本科研人员首次展开生物法合成羟基乙酸的研究并且取得较好的结果,专利JP 09028390曾报道利用Rhodococcusrhodochr ousATCC 33025菌株和Gordona terraeMA-1菌株腈水解酶催化羟基乙腈水解合成羟基乙酸;Zhou等[21]以氧化葡萄糖酸杆菌G.oxydansNL71为研究对象,通过分批补料添加底物和细胞回收策略,建立了一种高效的发酵模型,该模型可以进行连续的生物反应来生产羟基乙酸;Kataoka等[22]用Pichia naganishii对乙二醇进行的氧化催化得到羟基乙酸;Wei等[23]以氧化葡萄糖酸杆菌G.oxydansDSM 2003为研究对象,通过高密度培养得到菌体对乙二醇进行催化氧化生成羟基乙酸。本文采用生物法对乙二醇进行催化生产羟基乙酸。
弗托氏葡萄糖酸杆菌(Gluconobacter frateurii)是一种专性好氧的的革兰氏阴性菌,属于醋酸杆菌科,因其具有多种膜结合脱氢酶(葡萄糖脱氢酶、乙醇脱氢酶、甘油脱氢酶等),而被应用于微生物催化。最早被李华等应用于二羟基丙酮的生产[24],本文首次将Gluconobacter frateurii应用于羟基乙酸的生产中,通过弗托氏葡萄酸杆菌的膜结合乙醇脱氢酶对乙二醇进行不完全氧化生产羟基乙酸,如图1所示。并对其进行单因素实验、Plackett-Burman试验、最陡爬坡试验以及响应面优化发酵培养基及发酵条件,提高羟基乙酸产量。
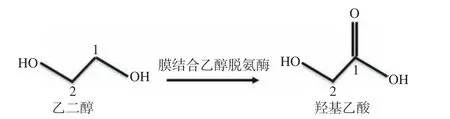
图 1 乙二醇不完全氧化生成羟基乙酸Fig.1 Incomplete oxidation of ethylene glycol to glycolic acid
1 材料与方法
1.1 材料与仪器
羟基乙酸标品(纯度99%)、乙二醇标品(纯度99%) 国药集团化学试剂有限公司;其他试剂 均为市售分析纯;弗托氏葡萄糖酸杆菌(Gluconobacter frateurii)HD924 由河南省应用微生物工程研究中心保存。
SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;Scout SE电子天平 奥豪斯仪器(常州)有限公司;PH计FE28 梅特勒-托利多仪器上海有限公司;UPT-I-20 L超纯水系统 成都优越科技有限公司;TOMYSX-700立式压力蒸汽灭菌器 日本TOMY公司;ZQZY-88CV全温度振荡培养箱 上海知楚仪器有限公司;高速离心机 艾本德国际贸易有限公司;Aminex HPX-87H色谱柱(300 mm×7.8 mm,9 μm) Bio-Rad公司;Waters HPLC-1515高效液相色谱仪 沃特世科技(上海)有限公司。
1.2 实验方法
1.2.1 菌株的活化与培养 一级和二级种子培养基(g/L):山梨醇10、酵母粉15、碳酸钙1.5、pH7.0、121 ℃灭菌20 min。
初始发酵培养基(g/L):蛋白胨10、酵母粉5、NaCl 10、乙二醇10、pH7.0、121 ℃灭菌20 min。
一级种子培养:在超净台中,将保藏有弗托氏葡萄糖酸杆菌(Gluconobacter frateurii)HD924的甘油管接种到装液量为50 mL/250 mL的种子培养基里,然后放入30 ℃、200 r/min恒温摇床振荡培养24 h;二级种子培养,按10%(v/v)接种量接入二级种子,和一级种子相同的装液量,30 ℃、200 r/min恒温摇床振荡培养12 h至对数生长期。
1.2.2 HD924催化氧化乙二醇产羟基乙酸 在超净台中,取出培养至对数生长期的二级种子培养基,按10%(v/v)接种量接入装液量为50 mL/250 mL的初始发酵培养基中培养,30 ℃、200 r/min恒温摇床振荡培养48 h。
1.2.3 羟基乙酸产量的测定 取培养48 h的发酵液,进行4 ℃,8000 r/min,离心10 min处理,经离心除去菌体和沉淀物,然后将上清液稀释100倍,经0.22 μm的微孔滤膜过滤得到滤液加入进样瓶中备用。
检测条件[25]:本试验使用高效液相色谱仪进行羟基乙酸检测。试验中建立了一个利用示差折光检测器和紫外检测器检测发酵液中乙二醇和羟基乙酸等代谢产物的方法。利用磺化的苯乙烯-二乙烯共聚物作为固定相的离子色谱柱为分析柱,对发酵液中的产物羟基乙酸、底物乙二醇进行了成功的检测。经过色谱条件优化后选择了柱温30 ℃,流速0.6 mL/min,2 mmol/L H2SO4为流动相,紫外检测波长210 nm,进样量20 μL。羟基乙酸含量计算公式如下:

式中:A0表示1 g/L羟基乙酸标准品峰面积;A1表示发酵液中羟基乙酸峰面积;n表示样品稀释倍数。
1.2.4 单因素实验 通过对初始发酵培养基成分以及培养条件的改变来探究HD924催化乙二醇产羟基乙酸的最适发酵培养基成分以及最佳发酵培养条件。
发酵培养基成分筛选:以发酵培养基初始pH为7.0,发酵温度28 ℃,摇床转速220 r/min为基本条件,在其他组分(酵母粉、NaCl、乙二醇)保持不变的情况下,分别添加10 g/L甘油、山梨醇、葡萄糖、蔗糖、可溶性淀粉;保持单一变量,其他组分(NaCl、乙二醇)不变,在最适碳源的基础上通过分别添加10 g/L不同的氮源,蛋白胨、玉米浆、豆粉、酵母粉、(NH4)2SO4;在上述2个因素条件最佳的基础上,保证单一变量的同时加入1 g/L的无机盐,Fe(NO3)3、CaCO3、KH2PO4、MgSO4、MnSO4。每组试验三个平行样,以羟基乙酸产量作为衡量指标进行单因素实验。
发酵培养条件优化:将最适培养基成分中的各个因素按一定的浓度梯度进行优化:碳源浓度为10、15、20、25、30、35、40、45、50 g/L;氮源浓度为10、15、20、25、30、35、40、45、50 g/L;无机盐浓度为0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 g/L;培养温度为24、26、28、30、32、34、36 ℃;初始pH为4.0、5.0、6.0、7.0、8.0、9.0、10.0;接种量为2%、4%、6%、8%、10%、12%;乙二醇浓度为10、15、20、25、30、35 g/L。每组试验三个平行样,以羟基乙酸产量作为衡量指标进行单因素实验。
1.2.5 Plackett-Burman因素筛选试验 Plackett-Burman(PB)试验是响应面试验设计的一种,通过对每个因素取高低两个水平,来比较各个因素两水平之间的差异和整体的差异来确定因子的显著性[26-28]。基于单因素实验,为筛选出影响菌株HD924产羟基乙酸的主要参数,采用PB试验筛选出可能对菌株HD924产羟基乙酸能力造成影响的7个独立变量的高、低水平值进行评估,发酵48 h后测定羟基乙酸浓度,每组试验三个平行样,并将浓度换算为羟基乙酸产量作为响应值,选出影响菌株HD924产羟基乙酸的显著试验因素。依据PB试验得到各因子的显著性排序和回归方程设计最陡爬坡试验,快速逼近响应最佳值区域[29]。
1.2.6 最陡爬坡试验设计 最陡爬坡试验,是一种多因素试验的设计方法,基于PB试验结果,将显著影响因子根据正负效应往最优方向进行调整,可以快速逼近最佳值区域[30-31]。
1.2.7 响应面分析 响应面分析法是通过对响应面等值线的分析寻求最优工艺参数,采用多元二次回归方程来拟合因素与响应值之间函数关系的一种统计方法[32-34]。通过最陡爬坡试验确定羟基乙酸产量最高区域后,选用Box-Benhnken中心组合试验设计3因素3水平对数据进行统计分析。
1.3 数据处理
本次试验中每组试验数据均由3次重复试验得到,试验获得的数据用平均值±标准差(SD)表示。采用Design Expert 10.0.7、Minitab 18、SAS 8.0进行数据处理,采用Origin 2019进行图表绘制。
2 结果与分析
2.1 单因素实验结果
碳源是培养基的主要成分之一,其作为微生物生长所需的营养以及代谢产物的能量基础。不同的微生物所含酶系不同,所以不同碳源利用情况也有所不同。以山梨醇作为碳源时,羟基乙酸产量达到最高(5.56 g/L),所以选择山梨醇作为菌株HD924发酵培养基的碳源(图2A);以酵母粉作为氮源时,羟基乙酸产量达到最高(5.67 g/L),故选择酵母粉作为该菌株发酵培养基的氮源(图2B);适量的无机盐含有的金属离子是微生物生长和进行代谢活动所必需的,实验结果表明,发酵培养基中添加不同的无机盐类,以CaCO3为无机盐添加剂时羟基乙酸产量达到最高(5.87 g/L),因此选择CaCO3作为菌株HD924发酵培养基的无机盐(图2C)。
由进一步单因素实验确定了较优发酵条件:山梨醇作为碳源,其浓度较低时,菌体正常的生长代谢难以维持;其浓度较高时,可能会导致菌体代谢酶系有所变化,致使pH降低,不利于菌体生长。山梨醇浓度为30 g/L时效果最好(图3A),此时羟基乙酸产量为6.76 g/L,产率为67.6%;酵母粉作为氮源,其浓度较低时,菌体生长受到抑制,难以进行催化反应。过高时,由于菌体营养过剩,进而影响底物的利用。酵母粉浓度25 g/L时效果最好(图3B),此时羟基乙酸产量为6.73 g/L,产率为67.3%;弗托氏葡糖酸杆菌所含的乙醇脱氢酶是Ca2+、Mg2+依赖型酶系,Ca2+含量过高或者过低时,产物的合成往往会受到不同程度的抑制。CaCO3浓度2.5 g/L时效果最好(图3C),此时羟基乙酸产量为6.30 g/L,产率为63.0%;微生物的生长以及其一系列代谢反应均需要合适的温度,来调节关键酶系的活性,由此来控制酶促反应速率、菌体生长以及产物合成速率。温度30 ℃时效果最好(图3D),此时羟基乙酸产量为6.56 g/L,产率为65.6%;不同类型的微生物生长都有其最适pH或范围,由此来调节反应相关的酶活性,进而影响微生物一系列代谢活动。pH7时效果最好(图3E),此时羟基乙酸产量为6.44 g/L,产率为64.4%;接种量是影响微生物在培养基中生长的关键因素,接种量过少,菌体生长较缓。接种量过多,会造成培养基中溶氧的不足。接种量10%时效果最好(图3F),此时羟基乙酸产量为6.53 g/L,产率为65.3%;乙二醇浓度的多少,决定了酶促反应速率以及产物产量的多少。乙二醇浓度过低时将直接决定羟基乙酸产量过低。乙二醇浓度过高时,会造成底物抑制,并且过量的乙二醇对菌体细胞有毒性。乙二醇浓度20 g/L时效果最好(图3G),此时羟基乙酸产量为12.87 g/L,产率为64.4%。
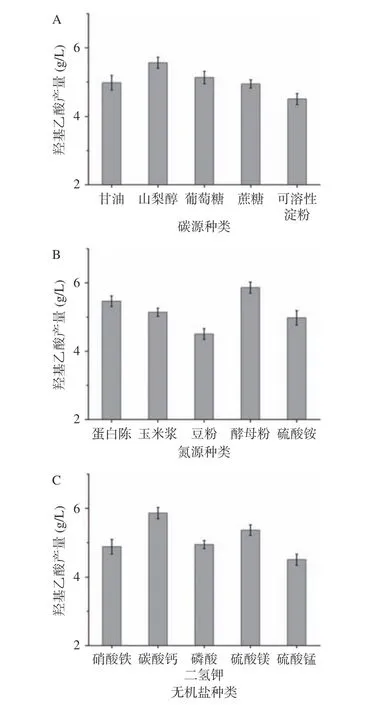
图 2 不同培养基成分对羟基乙酸产量的影响Fig.2 Effect of different media components on the production of glycolic acid
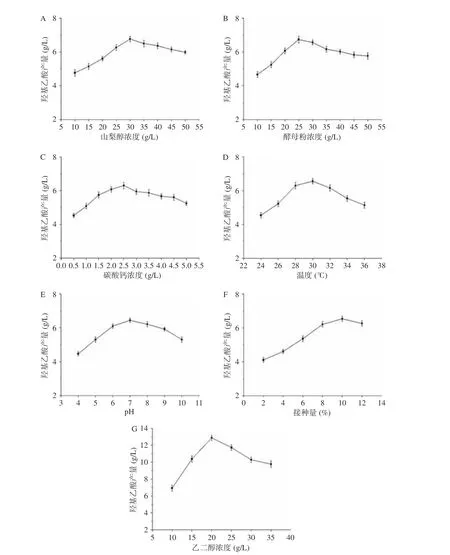
图 3 不同发酵条件对羟基乙酸产量的影响Fig.3 Effect of different fermentation conditions on the production of glycolic acid
2.2 Plackett-Burman试验显著因素筛选结果
根据前期的单因素实验,本试验考察7个影响因素,以X1、X2、X3、X4、X5、X6、X7分别代表山梨醇浓度(g/L)、酵母粉浓度(g/L)、CaCO3浓度(g/L)、温度(℃)、pH、接种量(%)、乙二醇浓度(g/L),每个因素取-1和+1两个水平,如表1。

表1 Plackett-Burman试验设计因素与水平Table 1 Plackett-Burman trial design factors and levels
Plackett-Burman试验结果见表2,采用Minitab 18软件对各试验因素做主效应分析,由方差分析变量的显著性P值的大小,确定对羟基乙酸产量影响的大小。以羟基乙酸产量为响应值进行评估,得到一次拟合方程:产量(g/L)=12.572+0.415X1+0.561X2+0.032X3-0.237X4+0.086X5+0.207X6+1.124X7。由表3可知对羟基乙酸产量影响显著从大到小的排序分别为X7(乙二醇浓度)、X2(酵母粉浓度)、X1(山梨醇浓度)(PX7=0.001,PX2=0.01,PX1=0.027),其他因素对羟基乙酸产量影响不显著(P>0.05),同时决定系数R2为0.9689,表明该试验设计可靠,回归有效。
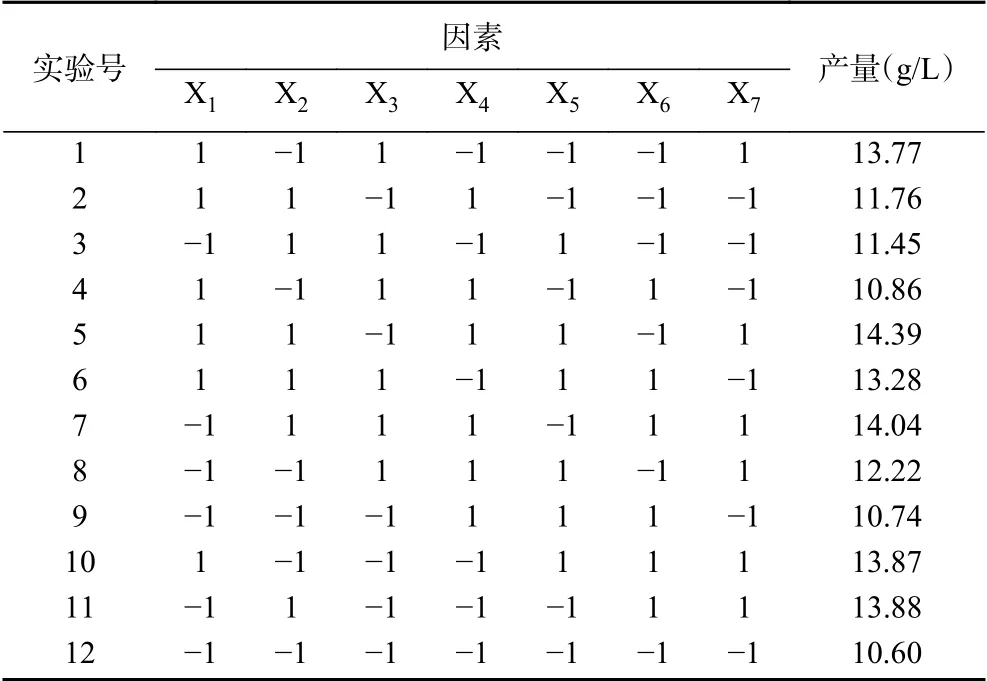
表2 Plackett-Burman试验设计与响应值Table 2 Plackett-Burman experimental design and response value
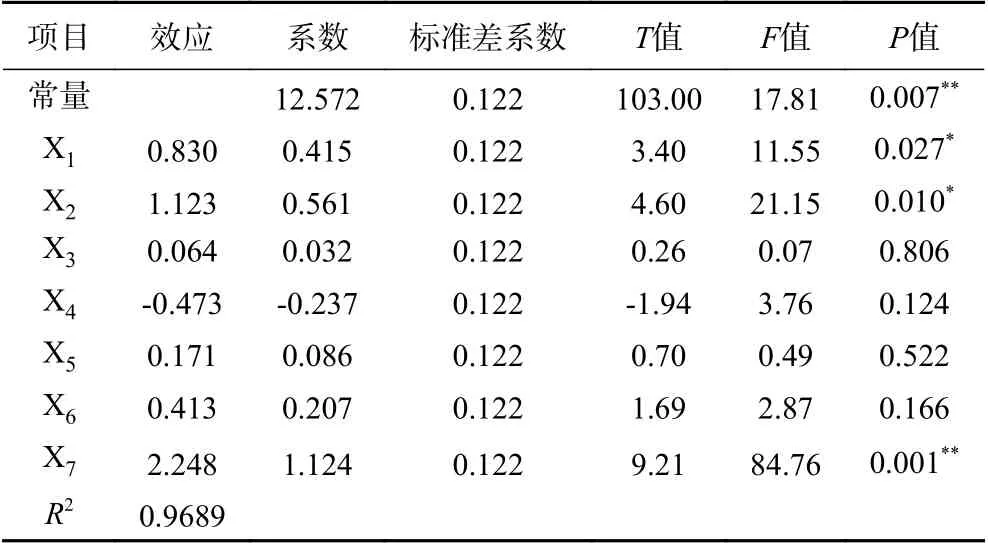
表3 Plackett-Burman试验设计方差分析结果Table 3 Plackett-Burman test design analysis of variance results
2.3 最陡爬坡试验结果
根据Plackett-Burman试验结果中X1(山梨醇浓度)、X2(酵母粉浓度)、X7(乙二醇浓度)这三个因素的T值为正(3.40、4.60、9.21),应该将山梨醇浓度、酵母粉浓度、乙二醇浓度增大。如表4所示,在试验2条件下,羟基乙酸产量最大,这说明最优发酵条件在试验2条件附近,所以以试验2的条件作为响应面试验因素的中心点。
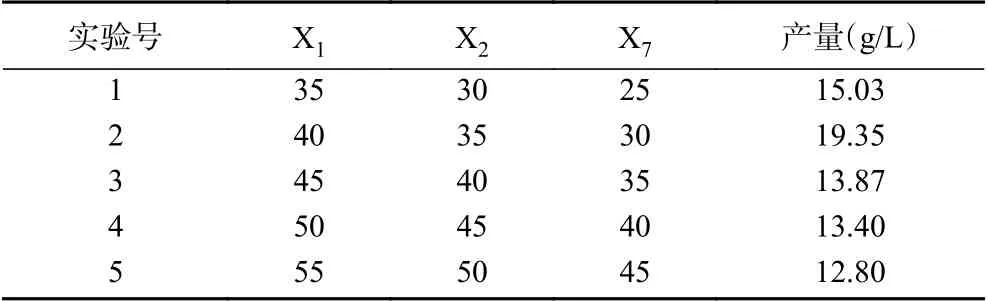
表4 最陡爬坡试验结果Table 4 Results of the steepest climbing test
2.4 响应面分析法优化
根据最陡爬坡试验得到中心点试验2:X1山梨醇40 g/L、X2酵母粉35 g/L、X7乙二醇30 g/L,应用Design Expert 10.0.7软件,采用Box-Benhnken方法对弗托氏葡萄糖酸杆菌HD924菌株产羟基乙酸发酵工艺进行三因素三水平的响应面分析试验,以山梨醇浓度X1、酵母粉浓度X2、乙二醇浓度X7为自变量,试验设计与结果见表5。
对表5采用统计软件进行响应面二次回归拟合,得到二次多项式回归方程:产量并对上述回归模型进行方差分析,结果见表6。

表5 Box-Benhnken试验设计与结果Table 5 Box-Benhnken test design and results
由表6回归模型方差分析可知,模型的P值为0.0005,差异极显著(P<0.01),失拟值的P值为0.5327,差异不显著(P>0.05),表明该方程回归显著。该模型的调整决定系数和决定系数分别为和R2=0.9849,说明该方程的拟合性较好,结果可靠。回归方程中对Y值的影响极显著(P<0.01),表明了实验因子对响应值不只是简单的线性关系,二次项对响应值也有很大关系,交互影响作用较小。
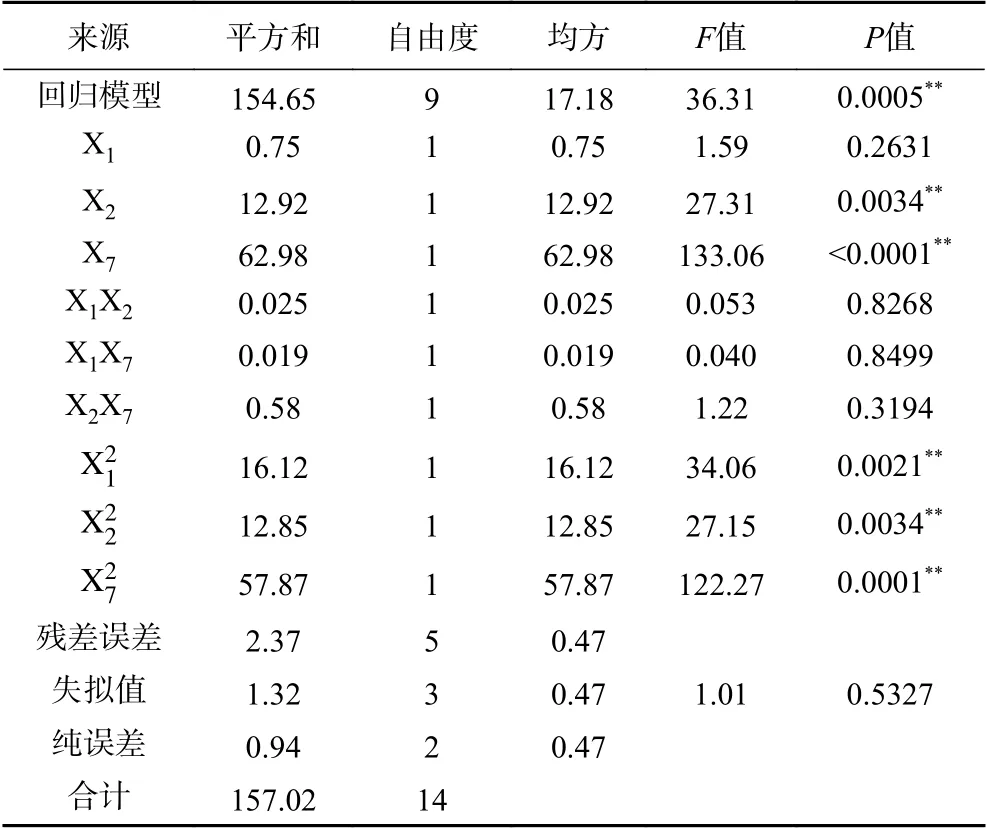
表6 回归模型方差分析Table 6 Analysis of variance of regression model
图4为该模型的响应面图以及等高线图。可以看出,随着山梨醇浓度、酵母粉浓度、乙二醇浓度的增加,羟基乙酸产量也逐渐增多,但不是持续增加,当这三个因子的浓度到达一定值时,羟基乙酸产量开始下降。可利用SAS 8.0软件进行分析,求出这三个因子的最佳值,来得到最大的产量。由SAS 8.0软件求出,当山梨醇浓度40.30 g/L,酵母粉浓度36.89 g/L,乙二醇浓度28.14 g/L,理论预测的羟基乙酸产量最大值为21.16 g/L。
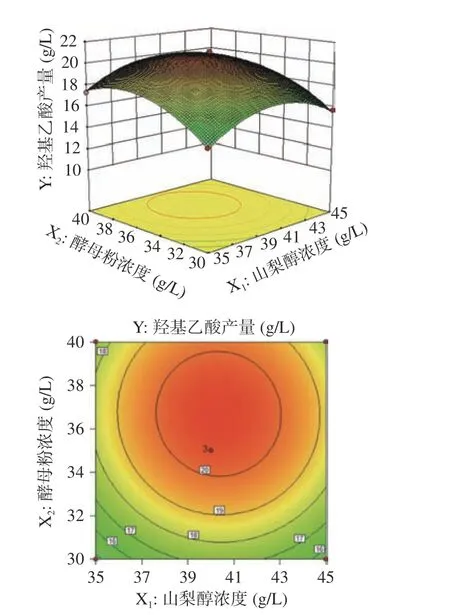
图 4 培养基成分对羟基乙酸产量的交互影响Fig.4 Interactive influence of medium composition on the production of glycolic acid
2.5 模型验证
通过对模型预测值进一步验证,确定了优化后的培养基成分为:山梨醇浓度40.30 g/L、酵母粉浓度36.90 g/L、CaCO3浓度2.50 g/L、乙二醇浓度28.14 g/L,发酵条件为:发酵温度30 ℃、pH7、接种量10%(v/v)、转速200 r/min、发酵时间48 h的条件下重复三次摇瓶实验,在此优化条件下,Gluconobacter frateuriiHD924羟基乙酸产量分别为20.97、21.10、21.05 g/L,平均值为21.04 g/L,与预测值(21.16 g/L)接近,误差P=0.03387(P<0.05),证明了该模型的有效性。
3 结论
本文首次将菌株Gluconobacter frateurii应用于转化乙二醇生产羟基乙酸,首先通过单因素实验对发酵条件进行探究,选择合适的碳源、氮源、无机盐以及发酵条件。其次通过Plackett-Burman试验设计快速有效地从7个影响羟基乙酸产量的因素中筛选出3个显著性影响因素:山梨醇浓度、酵母粉浓度以及乙二醇浓度;然后利用最陡爬坡试验逼近最大响应值区域并利用Box-Benhnken试验设计对转化体系进行了优化,确定了酵母粉浓度和乙二醇浓度对羟基乙酸产量的显著性,并建立了各因素与羟基乙酸产量之间的数学模型,取得了良好的试验结果。结果表明:当山梨醇浓度40.30 g/L、酵母粉浓度36.90 g/L、乙二醇浓度28.14 g/L时,羟基乙酸产量达到了21.04 g/L,与优化前(5.83 g/L)相比,羟基乙酸转化率提高了28.25%,转化率达到了74.77%,生产强度为10.52 g/(L·d)。
羟基乙酸作为一种重要的医药中间体和有机化工原料,具有较高的应用价值,但其在自然界中含量较低。本文采用一种对环境友好,降低化学污染的生产方法生产羟基乙酸,相比前人所报道的生产方法具有较大优势。今后将进一步进行放大实验,同时优化产品的提取纯化工艺,提高羟基乙酸的收率,为工业化应用提供基础数据。
