焦糖化与美拉德反应中DDMP、HMF及糠醛的生成研究
2022-06-11况丹妮刘若阳张志军侯天宇
王 丹,况丹妮,刘若阳,张志军,侯天宇,李 河
(中北大学化学工程与技术学院,山西太原 030051)
食品在贮藏、热加工及发酵过程中会产生一些有苦味或对人体存在健康威胁的化合物,如2,3-二氢-3,5-二羟基-6-甲基-4(H)-吡喃-4-酮(DDMP)、5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)及糠醛。它们主要来源于食品加工贮藏过程中的焦糖化反应(Caramelization)和美拉德反应(Maillard Reaction,MR)[1-2]。在没有氨基存在时,糖类尤其是单糖,加热会发生脱水与降解,当温度高达熔点以上会发生褐变,即发生焦糖化反应。当有氨基(源于铵根离子、氨基酸、多肽或者蛋白质)参与时,还原糖的羰基还会与氨基经缩合、聚合而最终生成类黑精,即发生MR[2]。由于焦糖化和美拉德反应在食品中的广泛存在,DDMP、HMF及糠醛在蜂蜜[3-4]、蔬菜[5]、水果[6]、调味品[7]、烤面包[8]、饮料[9]等多种食品中被发现。
作为焦糖化或美拉德反应的中间产物,DDMP、HMF和糠醛可以继续反应生成棕色及香味物质,具有增香调色功能[10],但对人体是否有害,目前尚存在争议。HMF和DDMP被认为是中草药中的有效活性分子[11-12],如HMF 在体外具有抗酪氨酸酶活性的作用[13],DDMP具有强抗氧化性[14-15],可以抑制人结肠癌细胞增殖,促进其凋亡[16]。然而,研究表明,糠醛或HMF被机体吸收后,会对肝脏、肾脏、心脏等器官产生不良影响[17];HMF能损害老鼠的DNA,诱发大鼠的结肠癌和引起中毒性肾损害[18],对眼黏膜、上呼吸道黏膜等产生刺激作用[19-20]。DDMP会在体外诱导DNA链发生断链和突变[21],也会刺激大鼠体内自主神经活动[22]。此外,糠醛、HMF和DDMP带有苦味,会影响食品的可接受度[8,23]。因此,DMP、HMF和糠醛仍然被认为是许多食品中严格控制的成分,进一步了解它们在不同MR体系中的形成途径,对于在实际应用中合理管理食品加工和贮藏具有重要意义[24]。目前,糠醛被允许作为香料使用,但在不同食品中有明确限量[1];欧洲食品安全委员会推荐HMF的最大限量为1.6 mg/人/d;Janzowski等[25]认为摄入HMF 0.5~1.0 mg/kg没有健康威胁。
目前大部分研究着重关注HMF的生成。卢键媚等[26]建立了糖-酸模型体系,研究了反应条件对3-DG和HMF生成的影响,结果表明,果糖和蔗糖反应体系中3-DG和5-HMF生成量远高于葡萄糖反应体系。欧隽滢等[24]研究了5种添加物对模型体系中HMF的生成影响,证实碳酸氢钠、碳酸氢铵和食盐在模拟体系和饼干中可以显著减少 HMF 形成;硫酸铝钾和硫酸铝铵则大幅增加HMF生成量。Gükmen等[6]基于水果贮藏过程中二羰基化合物与HMF的存在情况,讨论了美拉德反应在水果中的新角色。关于DDMP、HMF和糠醛在焦糖化和美拉德反应体系共同生成规律的研究不多,本文通过建立3种焦糖化体系、3种美拉德体系,探究不同反应体系,不同单糖种类以及赖氨酸的引入对DDMP、HMF和糠醛生成的影响,以期为食品贮藏、热加工提供有效的安全引导。
1 材料与方法
1.1 材料与仪器
D-果糖(纯度≥99.0%)、D-木糖(纯度≥98.0%)、L-赖氨酸(纯度≥99.0%)、5-羟甲基糠醛(HMF)、糠醛、邻苯二胺(OPD,纯度≥99.0%) 上海阿拉丁生化技术有限公司;D-葡萄糖 纯度≥99.5%,天津市化学试剂三厂;3-脱氧葡萄糖醛酮(3-deoxyglucosone, 3-DG) 上海紫霞生物科技有限公司;磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钠(NaH2PO4·2H2O) 纯度≥99.0%,天津市风船化学化学试剂有限公司;DDMP 由实验室自行制备分离得到,其详细信息见已发表的文献[27]。
SB25-12DTD超声波清洗器 宁波新芝生物科技股份有限公司;CTL550低速离心机 湖南湘立仪器有限公司;XW-80A涡旋混合器 上海驰唐电子有限公司;ZYCGF-III-20T超纯水制备系统 四川卓越水处理设备有限公司;BCD-576WDPU冰箱海尔公司;Ultimate 3000高效液相色谱仪 美国热电公司;pH计 上海美普达仪器有限公司;DF-II数显集热式油浴磁力搅拌器 金坛市杰瑞尔电器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;LC-DCY-12G氮吹仪 上海力辰仪器科技有限公司。
1.2 实验方法
1.2.1 焦糖化反应体系的制备 准确称取1.0 mol木糖(Xyl)、葡萄糖(Glc)和果糖(Fru),分别溶解于适量的磷酸盐缓冲液(0.2 moL/L,pH5.8)中,并用该缓冲液定容至1000 mL,得到浓度为1.0 mol/L的单糖溶液。利用移液枪准确移取5.0 mL上述溶液至耐高温消解管中,螺旋盖密封,置于120 ℃油浴锅中分别加热10、30、60、90、120 min,每组做两个平行。所有样品溶液反应完成后,立即取出置于冰水中以终止反应。冷却后的样品溶液移入10 mL离心管,置于4 ℃冰箱中待测。
1.2.2 美拉德反应体系的制备 准确称取1.0 mol Xyl和赖氨酸(Lys)、Glc和Lys,以及Fru和Lys,分别溶解于适量的磷酸盐缓冲液(0.2 moL/L,pH5.8)中,并用该缓冲液定容至1.0L,分别得到浓度为1.0 mol/L,摩尔比1:1的Xyl-Lys、Glc-Lys、Fru-Lys三种体系的溶液。准确吸取5.0 mL上述溶液到耐高温消解管中,旋紧瓶盖,置于120 ℃油浴锅中分别加热10、30、60、90、120 min,每组做两个平行。所有样品溶液反应完成后,立即取出置于冰水中以终止反应。冷却后的样品溶液移入10 mL离心管,置于4 ℃冰箱中待测。
1.2.3 DDMP、HMF及糠醛的测定
1.2.3.1 标准品溶液制备 准确称取DDMP、HMF和糠醛标准品各10 mg,分别用超纯水溶解并定容到10 mL容量瓶中,得到每种标准品浓度为1.0 mg/mL的标准贮备液。分别用甲醇水溶液(甲醇:水=1:4,v/v)进行梯度稀释,得到浓度为1.0、2.0、5.0、10.0和20.0 mg/L的混合标准工作液,经0.22 μm水系滤膜过滤后,上机测定。
1.2.3.2 样品溶液的处理 所有反应溶液经0.22 μm水系滤膜过滤后,HPLC检测,其中木糖-赖氨酸、葡萄糖-赖氨酸体系分别稀释10倍和5倍后检测。
1.2.3.3 色谱分析条件 参考课题组已发表文献[28],采用高效液相色谱法(HPLC)对3种物质进行测定,其中单独标准品进行定性分析,混合标准品进行定量分析。色谱条件如下:色谱柱:Hypersil GOLDTMC18(5 μm,250×4.6 mm);柱温25 ℃;进样量20 μL;流速1.0 mL/min;检测波长284 nm;流动相:A相为甲醇,B相为水,梯度洗脱,洗脱条件见表1。
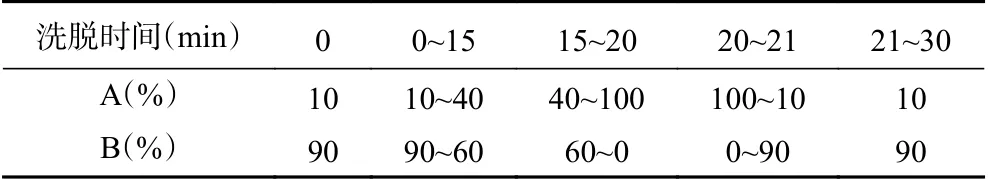
表1 DDMP、HMF和糠醛的HPLC梯度洗脱条件Table 1 Gradient elution procedure for the analysis of DDMP,HMF and furfural by HPLC
1.2.4 3-DG的测定
1.2.4.1 标准品及样品衍生化 准确称取3-DG标准品10 mg,用去离子水溶解并定容到10 mL容量瓶中,得到3-DG标准品浓度为1.0 mg/mL的标准贮备液。参考课题组已发表文献[28],取不同体积的标准品储备液与800 μL邻苯二胺(1.0mg/mL于pH7.0的磷酸缓冲液中)混合均匀,37 ℃水浴衍生化12 h,得到浓度分别为1、2、5、10、20 mg/L的标准品衍生化溶液,相同条件下,取200 μL反应溶液与800 μL邻苯二胺衍生化,过0.22 μm水系膜,待测。
1.2.4.2 色谱分析条件 采用高效液相色谱法(HPLC)对3-DG进行测定,色谱条件如下:色谱柱:Hypersil GOLDTMC18(5 μm,250×4.6 mm);柱温25 ℃;进样量20 μL;流速0.6 mL/min;检测波长315 nm;流动相:A相为甲醇,B相为水,梯度洗脱,洗脱条件见表2。
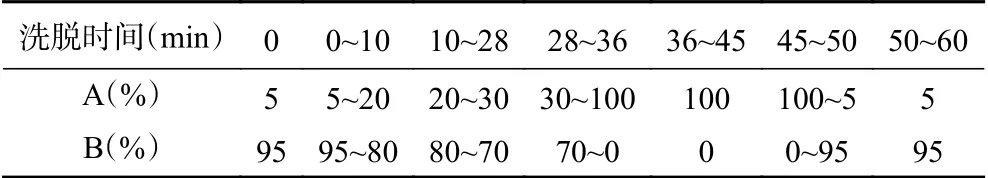
表2 3-DG测定的HPLC梯度洗脱条件Table 2 Gradient elution conditions for 3-DG determination by HPLC
1.2.5 中间和终末产物分析 参照文献[27],采用紫外分光光度法测定反应体系样品的中间产物和褐变产物。根据实验室分光光度计准确度,所有样品稀释后吸光度为0.2~0.8时,记录数据,以记录数据乘以稀释倍数为最终结果作为中间产物和终末产物的含量。
1.3 数据处理
本文实验数据均为两次重复,实验结果表达为平均值±标准差。数据先采用Excel进行数据归一和初始分析处理。运用Origin 2018进行作图和拟合处理,运用SPSS18.0进行方差分析,不同字母表示在两组之间有显著性差异(P<0.05)。
2 结果与分析
2.1 HPLC检测DDMP、HMF和糠醛
一般美拉德反应体系常由等摩尔的羰基和氨基构成[27],作为人体必需氨基酸之一,赖氨酸在食品原料中广泛存在[29],因此本实验选择赖氨酸参与的美拉德模型作为研究对象。采用HPLC对焦糖化和美拉德反应体系中的DDMP、HMF和糠醛进行检测,图1为三种物质标准品、焦糖化样品和美拉德样品的液相色谱图。三种物质的保留时间、线性方程及相关系数见表3。如图1所示,在1.2.3.3的色谱条件下,三种物质在10 min实现完全分离,峰型和分离度均较理想。不同反应样品的基质简单,色谱图未见明显干扰,可以准确对三种化合物进行积分和定量分析。图1C中美拉德反应样品DDMP生成量较大,定量时需稀释后分析,为便于比较,使用了稀释前的样品。

表3 三种物质的保留时间、线性方程及决定系数Table 3 Retention time, linear equation and correlation coefficient of three compounds
2.2 不同体系中DDMP、HMF和糠醛的生成规律
2.2.1 DDMP的生成 不同焦糖化及美拉德反应体系中DDMP的生成规律见图2,由图2可知,随着加热时间的延长,焦糖化体系中的DDMP含量逐渐升高,其DDMP含量顺序为果糖>木糖>葡萄糖,葡萄糖加热时没有DDMP检出;而美拉德体系中DDMP呈先增加后降低的趋势,这是因为DDMP不稳定,在反应中会发生降解[30],在反应前期,DDMP急剧累积,后期随着底物消耗,降解速度大于生成速度,DDMP含量下降。DDMP在美拉德体系中的生成量(最大为125.11±1.54 mg/L)远远大于焦糖化体系(最大为3.21±0.18 mg/L),其顺序为木糖-赖氨酸>葡萄糖-赖氨酸>果糖-赖氨酸,与焦糖化体系差异较大。这表明赖氨酸的参与促进了DDMP的生成。
2.2.2 HMF的生成 不同焦糖化及美拉德反应体系中HMF的生成规律见图3,由图3可知,随着加热时间的延长,两种体系中的HMF含量逐渐升高(P<0.05),经过方差和多重比较分析发现,焦糖化体系中HMF含量顺序为果糖最高,葡萄糖次之,木糖最少;而美拉德体系中葡萄糖-赖氨酸中的含量与果糖-赖氨酸没有显著性差异,木糖-赖氨酸体系中没有HMF检出;由图3可知,对比果糖和果糖-赖氨酸体系,赖氨酸的参与反而抑制了HMF的生成。
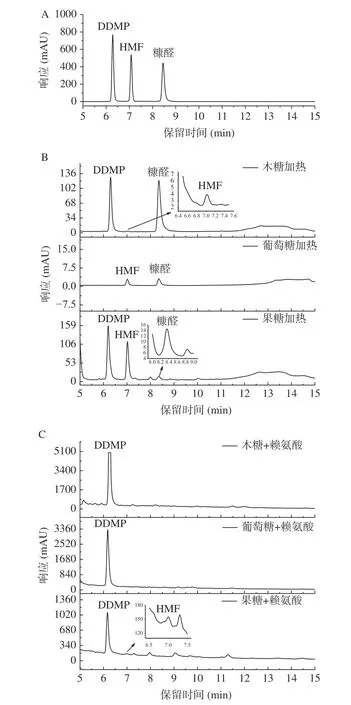
图 1 3种物质标准品与样品的液相色谱图Fig.1 HPLC chromatograms of standards and samples
2.2.3 糠醛的生成 不同焦糖化及美拉德反应体系中糠醛的生成规律见图4,由图4可知,糠醛主要在焦糖化体系中生成,并且木糖体系中糠醛的生成量远远大于其他体系,木糖是五碳糖,五碳糖降解易生成糠醛,这与前人报道的结果一致[1]。三种美拉德体系中均没有糠醛检出。这说明赖氨酸的参与也抑制了糠醛的生成。
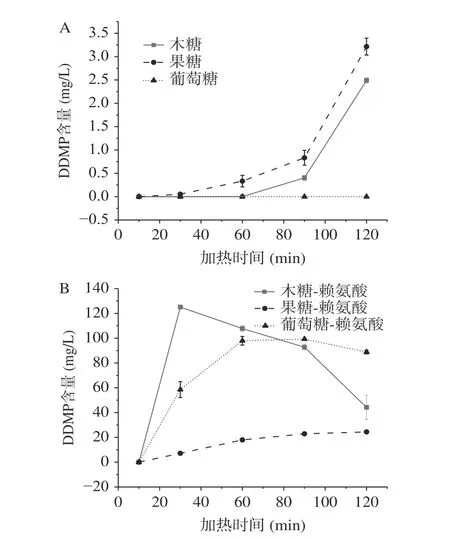
图 2 焦糖化和美拉德反应中DDMP的生成Fig.2 Formation of DDMP in caramelization and Maillard reaction
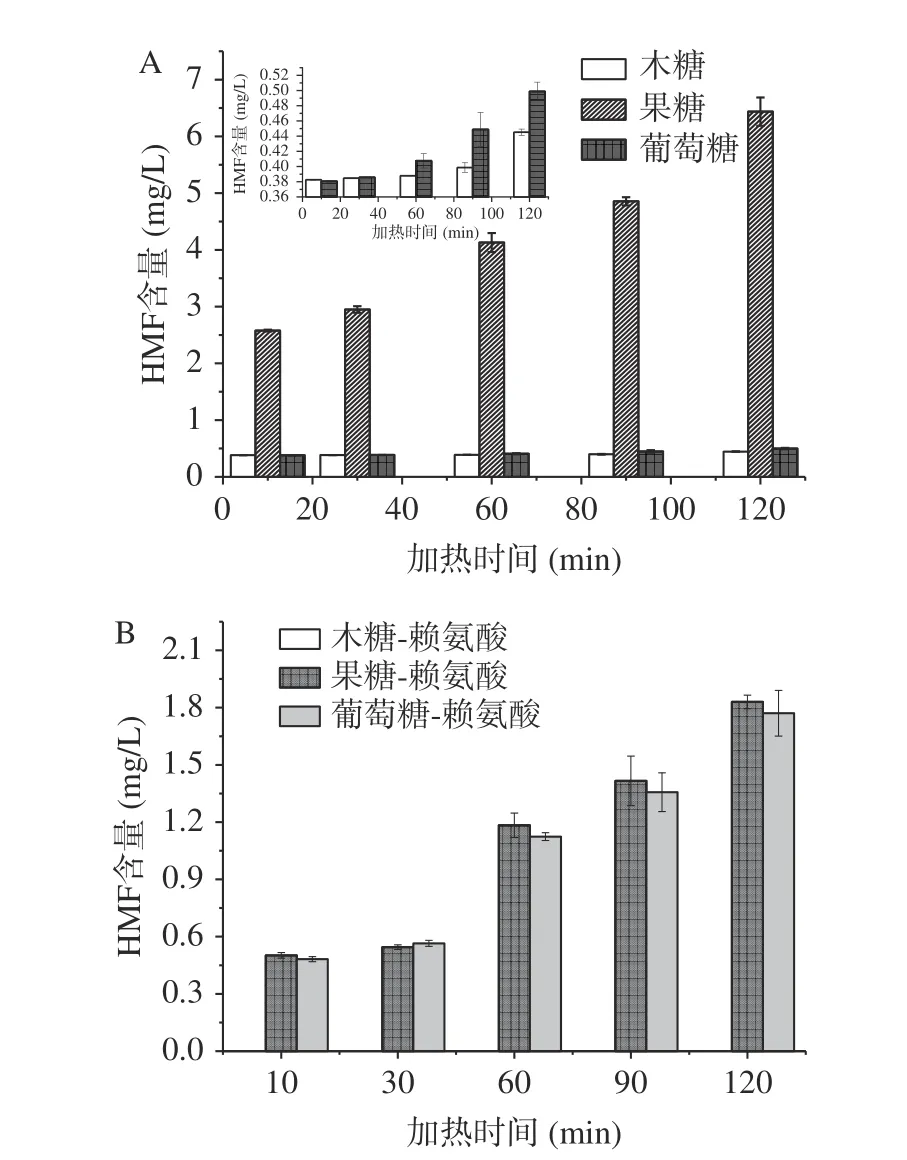
图 3 焦糖化和美拉德反应中HMF的生成Fig.3 Formation of HMF in caramelization and Maillard reaction
2.3 3-DG的生成
1-DG和3-DG分别是焦糖化和美拉德反应体系中DDMP和3-DG的前体物质,由于目前缺乏1-DG标品,本实验只测定了不同体系中3-DG中的含量。如图5所示,在焦糖化体系中,3-DG的生成规律与HMF一致,这说明果糖焦糖化体系中HMF生成量的增加主要取决于果糖降解生成较多的3-DG。然而在美拉德体系中,3-DG在木糖/果糖-赖氨酸体系中没有检出,在葡萄糖-赖氨酸体系加热初期生成较多,30 min之后逐渐降解,直至无法检出。下文将结合反应强度综合讨论DDMP、HMF及糠醛的生成途径。
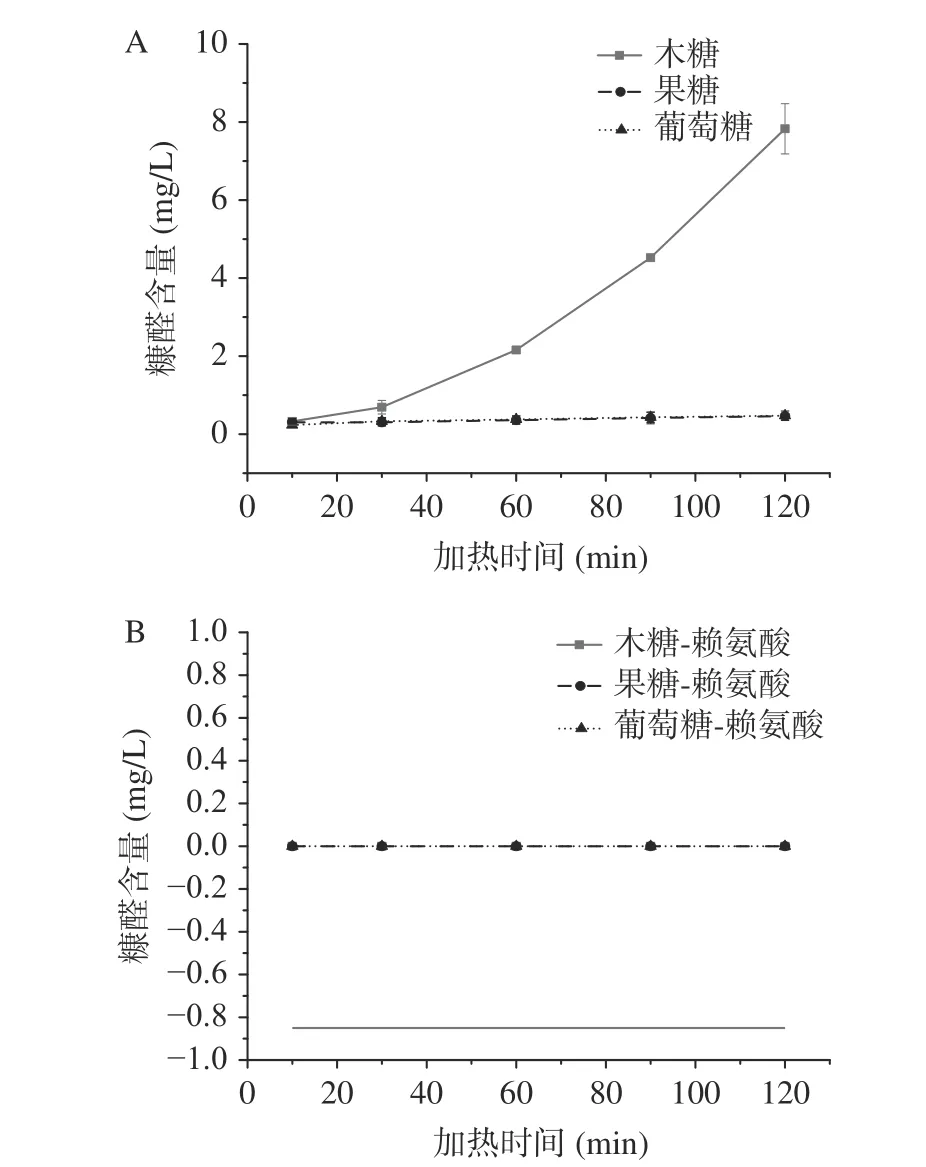
图 4 焦糖化和美拉德反应中糠醛的生成Fig.4 Formation of furfural in caramelization and Maillard reaction
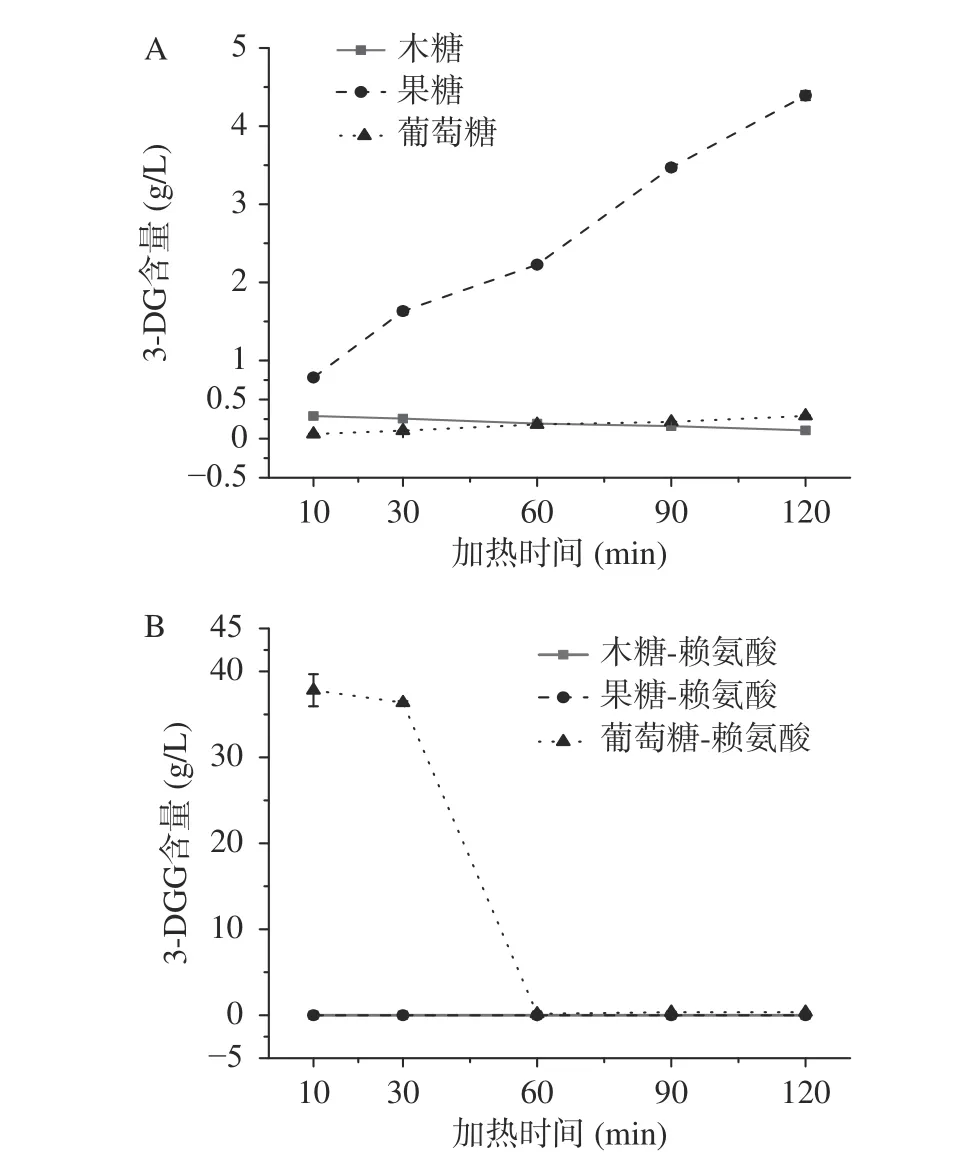
图 5 焦糖化和美拉德反应中3-DG的生成Fig.5 Formation of 3-DG in caramelization and Maillard reaction
2.4 DDMP、HMF及糠醛生成途径分析
一般认为,在焦糖化反应中,戊糖脱水反应后生成糠醛[1],己糖经脱水后生成 HMF和DDMP,而反应剧烈时,HMF会裂解为糠醛[23]。在MR中,氨基和羰基先形成席夫碱,席夫碱重排生成阿马道里重排产物(Amadori rearrangement products,ARPs)或者海因斯重排产物(Heyenes rearrangement products,HRPs)。当反应体系pH≤7时,ARPs或者HRPs主要发生1,2-烯醇化形成二羰基化合物 3-脱氧葡萄糖醛酮(3-DG),后环化形成糠醛及HMF等[26];当反应体系pH>7 时,ARPs或者HRPs则发生2,3-烯醇化反应、产生1-脱氧葡萄糖醛酮(1-DG),之后环化形成DDMP[31]。HMF和DDMP既在焦糖化反应中生成,也在MR中生成,两者随着反应体系及条件的变化存在竞争关系。三种物质在焦糖化和美拉德体系下的生成路径见图6[28,32]。
最近的研究表明干热或低水分时,葡萄糖-脯氨酸体系易发生2,3烯醇化,更多地生成DDMP[28],由此可见,除pH以外,水分含量及氨基酸活性也会影响DDMP和HMF的生成。反应产物的生成含量与底物浓度、反应温度、时间、体系pH等因素有关,而这些因素都会直接影响反应强度[28]。一般通常用反应物消耗、初级、中间及终末成色产物(brown products,BPs)的生成来表征美拉德反应进程。Li等[27]证实无色中间产物(uncolored intermediate products,UIPs)是美拉德反应中BPs的主要前体物质,一般用294 nm处的紫外吸收值(A294)来表征,标志着颜色变化的开始。UIPs主要包括糖基化产生的醛类、酮类等物质[33]。一般用420 nm处的吸光值来表征BPs的生成,表示美拉德反应的褐变程度[34]。本文采用A294和A420表征反应强度。
三种焦糖化体系的美拉德反应均不剧烈,A420很小,几乎没有成色物质生成。A294值也并没有显著性差异(数据未给出),这表明在反应强度相近的情况下,单糖结构是影响DDMP、HMF和糠醛的主要因素。焦糖化体系中3-DG的含量与HMF生成一致,均为果糖>葡萄糖>木糖。图7为美拉德反应体系中反应强度的变化。由图7可知,美拉德反应的强度要远远大于焦糖化体系。DDMP生成与A294的趋势呈正相关,均为木糖-赖氨酸>葡萄糖-赖氨酸>果糖-赖氨酸。然而HMF和糠醛的生成却呈现不同的趋势。尽管木糖-赖氨酸体系的A294值最大,但该体系中却没有HMF和糠醛检出。相反HMF更容易在葡萄糖/果糖-赖氨酸体系中生成。这主要是因为HMF还有一个关键的不饱和前体物质3,4-DGE(图6),3,4-DGE存在Z和E两个异构体,只有Z能够形成HMF[35-36]。无论是DDMP、HMF、糠醛,还是3-DG,在强度很大的美拉德反应中,均属于动态变化。随着反应物的消耗,DDMP会进一步分解生成小分子酮类及其他裂解产物,而HMF会进一步参与到褐变反应,生成BPs。对比A420值发现,随着反应时间的延长,三种美拉德体系的褐变值逐渐接近。在120 min时,木糖-赖氨酸体系有半固态树脂化产物生成,导致A420测定值降低。这说明,木糖-赖氨酸中中间产物更快地参与到了褐变反应中。3-DG除了脱水环化生成HMF之外,还会发生反缩醛化生成丙酮醛等小分子醛类[37],进一步参与到高级反应阶段。因此,在美拉德体系中监测到的3-DG变化只是一个静态值,并不能直接反映体系中3-DG是否产生(图5B)。Kanzler等[36]报道发现在麦芽糖-脯氨酸和麦芽糖-丙氨酸体系中,没有检测到1-DG和3-DG,但DDMP浓度却分别达到113和138 μmol/L。这意味着二羰基化合物真实产生过,但由于反应过于剧烈没有被追踪到。
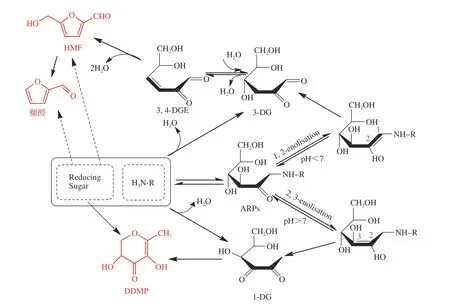
图 6 己糖焦糖化和美拉德反应中DDMP、HMF和糠醛的生成路径Fig.6 Proposed formation pathway for DDMP, HMF and furfural from caramelization and Maillard reaction models
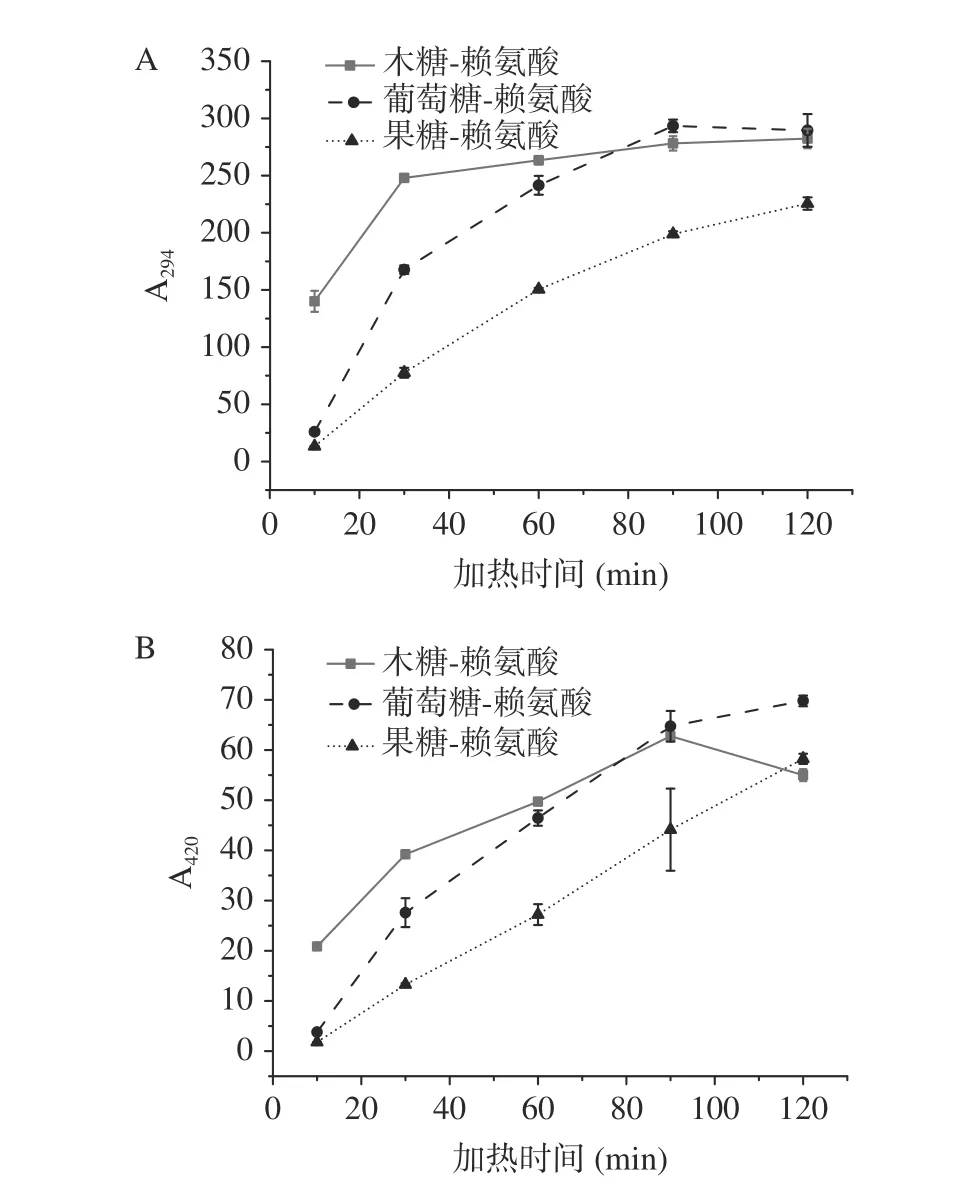
图 7 美拉德反应中中间产物(A294)和终末产物(A420)的变化Fig.7 Evolution of the absorbance at 294 nm (A) and 420 nm(B) as indicators of intermediate and advanced stages of MR, respectively
3 结论
本文基于120 ℃油浴加热,建立了木糖、果糖、葡萄糖焦糖化体系及木糖/果糖/葡萄糖-赖氨酸美拉德体系来研究DDMP、HMF和糠醛的生成规律。结果表明,体系生成的三种物质含量随着加热时间的延长而增加。果糖焦糖化体系中HMF的生成量最高,木糖焦糖化体系中糠醛的含量最高,赖氨酸通过竞争性抑制单糖降解的焦糖化途径抑制HMF和糠醛的生成。DDMP在果糖和木糖焦糖化体系中均有生成,但含量不高。赖氨酸的参与促进了美拉德体系中DDMP的大量生成,尤其在木糖-赖氨酸体系中,DDMP的含量达到了125.11±1.54 mg/L。结合A294和A420结果可知,单糖结构差异与赖氨酸竞争性参与单糖降解是影响DDMP、HMF和糠醛生成的主要因素。
