抗革兰氏阴性菌药物研究进展
2022-06-11陈萤林媛蒋建东
陈萤,林媛,蒋建东
·综述·
抗革兰氏阴性菌药物研究进展
陈萤,林媛,蒋建东
随着抗生素的不断发现和应用,人类诸多细菌类感染性疾病得到了及时有效的临床救治。但由于部分抗生素的不合理应用也导致了耐药菌株的不断出现,其中很多表现为“多重耐药性”。除此之外,细菌的自然进化和细菌之间的基因转移在使其产生自我保护机制的同时,也导致了对抗生素的耐药[1]。抗生素耐药问题,已成为临床面临的棘手问题,也是全球抗感染治疗的重大挑战。在美国,肠杆菌属耐药率最高可达到 88%,鲍曼不动杆菌耐药率最高可达 49%;在印度,大肠埃希菌的耐药率最高能达到 92%,鲍曼不动杆菌为 90%[2-3]。而我国是目前世界上抗生素使用量最多的国家,占世界用量的一半以上,也是受抗生素耐药影响最严重的国家之一[4]。
据我国细菌耐药监测网结果显示,临床最常见的病原性细菌耐药中,排名前五位的分别是大肠埃希菌、肺炎克雷伯杆菌、金黄色葡萄球菌、鲍曼不动杆菌、铜绿假单胞菌;导致感染死亡率最高的前几位耐药菌分别是耐第三代头孢菌素大肠埃希菌、耐甲氧西林金黄色葡萄球菌、耐碳青霉烯铜绿假单胞菌、耐第三代头孢菌素肺炎克雷伯杆菌[5]。上述耐药菌中大肠埃希菌、铜绿假单胞菌、肺炎克雷伯杆菌均属于革兰氏阴性菌,革兰氏阴性菌耐药问题已经成为危害人类健康的重大威胁之一。而目前临床上极度缺乏安全有效的用于治疗耐药革兰氏阴性菌感染的药物,这与革兰氏阴性菌特殊的细菌结构有关。
革兰氏阴性菌的细胞膜由内膜、细胞周质和外膜组成。内膜是由对称的磷脂双分子层组成,周质中含有一层较薄的肽聚糖,外膜是高度不对称的脂双层。脂多糖(lipopolysaccharides,LPS)是革兰氏阴性菌外膜的重要组成成分,是在内膜产生随后被转运到外膜而发挥作用的。LPS 能够吸附 Mg2+和 Ca2+等阳离子,形成非常紧密的堆积层,赋予外膜特有的渗透屏障特性,使它们在允许营养物质进入的同时能够有效地屏蔽抗生素等药物的进入,这也是抗革兰氏阴性菌抗生素研发较为困难的原因之一[6]。LPS 由 O 抗原、核心多糖以及类脂 A 三部分组成,并通过类脂 A 锚定在外膜上。类脂 A 的合成主要发生在细胞质和内膜上,反应需要经过 9 种酶的参与。反应的初始底物为 UDP-氨基葡萄糖乙酸酐(UDP-GlcNAc),利用 LpxA、LpxC、LpxD 酶的作用在底物上添加两个脂肪链;LpxH 将该分子上的 UDP 基团分解,形成 Lipid X 分子;LpxB 将 Lipid X 及其前体聚合,形成分子 DMSP;DMSP 在 LpxK、KdtA、LpxL 和 LpxM 的作用下添加磷酸、Kdo 基团和脂肪酸链,最终形成类脂 A。核心多糖在相关酶的催化下与类脂 A 结合,共同转运到内膜外侧。在周质空间中,O 抗原与类脂 A-核心多糖复合物结合最终形成 LPS 分子[7]。LPS 在转运过程中主要依赖 7 个不同的 LPS 转运蛋白(LptABCDEFG)协同完成,其中 LptBFG 从内膜组分中提取 LPS,周质中的 LptA/C 是连接 LptBFG 与 LptDE 的关键蛋白质,将 LPS 转至外膜,LptDE 将 LPS 垂直锚定在外膜上[8]。
本文主要针对自 2014 年起新批准上市的抗革兰氏阴性菌药物进行综述,包括 β-内酰胺类、β-内酰胺酶抑制剂类、四环素类、喹诺酮类、氨基糖苷类、截短侧耳素类和多黏菌素类(表 1)。文中主要介绍了药物的批准上市时间、类型、作用机制、抗菌谱、适应证和不良反应等内容,为抗革兰氏阴性菌药物临床使用提供一定的参考。
表1 自 2014 年新上市的对革兰氏阴性菌感染具有治疗作用的药物
药物名称类型公司对酶和菌株的活性文献 CREPAABESBL 头孢地尔(Cefiderocol)β-内酰胺类Shionogi++++[10-12] 头孢洛扎/他唑巴坦(Zerbaxa)β-内酰胺酶抑制剂类Merck++ +[13-14] 阿维巴坦/头孢他啶(Avycaz)β-内酰胺酶抑制剂类Pfizer++ +[15-17] 美罗培南/维博巴坦(Vabomere)β-内酰胺酶抑制剂类Melinta+ [18-19] 亚胺培南/西司他丁/瑞来巴坦(Recarbrio)β-内酰胺酶抑制剂类Merck + +[20]
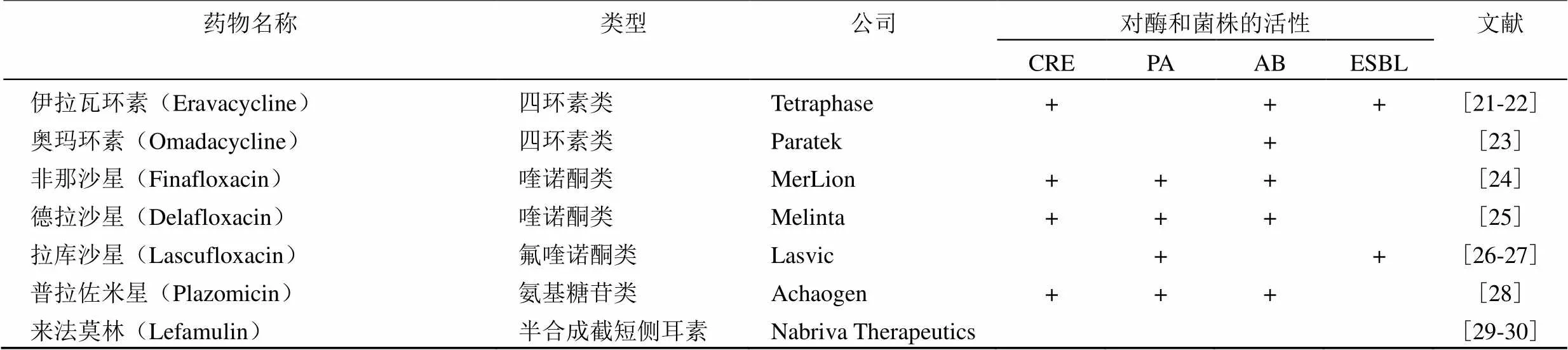
续表1
注:CRE:碳青霉烯类耐药的肠杆菌科;PA:铜绿假单胞菌;AB:鲍曼不动杆菌;ESBL:超广谱β-内酰胺酶;+ 表示具有活性作用。
1 β-内酰胺类
β-内酰胺类抗生素是一种杀菌剂,能够与青霉素结合蛋白结合,抑制细胞壁肽聚糖的合成,使细菌胞壁缺损,菌体膨胀裂解[31]。
头孢菌素是 β-内酰胺类抗生素中重要的一类半合成抗生素,因其广谱覆盖、低毒和良好的药代动力学特性而继续成为研究最多的抗生素之一。头孢菌素类抗生素目前已经发展到第五代。其中第三代对革兰氏阴性菌的作用较强,如头孢三嗪、头孢哌酮,第五代对革兰氏阳性菌作用较强,如头孢洛林、头孢吡普等[32]。但随着产超广谱 β-内酰胺酶(ESBLs)的大肠埃希菌分离株引起的感染发病率增加,使得第三代头孢菌素对这种病原体效果越来越弱[33]。
头孢地尔属于头孢菌素类,能够与三价铁结合,通过铁转运蛋白运输穿过外膜进入细菌内,在周质中达到较高的浓度,与青霉素结合蛋白结合来抑制革兰氏阴性菌细胞壁合成,故也被称为“铁载体头孢菌素”[34]。头孢地尔对碳青霉烯类耐药的革兰氏阴性菌具有良好活性,其中对亚胺培南耐药的铜绿假单胞菌的 MIC90为 2 μg/ml、对亚胺培南耐药的鲍曼不动杆菌 MIC ≤ 4 μg/ml[10]。头孢地尔在 2019 年 11 月获得美国食品药品监督管理局(FDA)批准,临床中主要用于治疗复杂性尿路感染和医院获得性肺炎[35]。常见不良反应为腹泻、输液部位反应、便秘、皮疹、念珠菌病、咳嗽、肝脏检查升高、头痛、低钾血症、恶心和呕吐[36]。
2 β-内酰胺酶抑制剂类
ESBLs 的产生是介导大部分细菌对 β-内酰胺类抗生素耐药的主要机制。β-内酰胺酶能够水解 β-内酰胺类抗生素的 β-内酰胺环,使其失效。β-内酰胺酶分为利用丝氨酸进行 β-内酰胺水解的 A、C 和 D 类酶和需要二价锌离子进行底物水解的 B 类金属酶[37]。β-内酰胺酶抑制剂与抗生素联用能够对抗部分细菌耐药问题。克拉维酸、舒巴坦、他唑巴坦主要抑制 A 类的 β-内酰胺酶,对其他组的 β-内酰胺酶几乎没有作用。阿维巴坦、维博巴坦、瑞来巴坦、齐达巴坦、那库巴坦与 A、C 类 β-内酰胺酶具有高度的亲和力[38]。
Zerbaxa(头孢洛扎/他唑巴坦)是一种新型复合抗生素。他唑巴坦为 β-内酰胺酶抑制剂,能够避免头孢洛扎被多种β-内酰胺酶水解,从而增加对肠杆菌属的抗菌活性[13]。Zerbaxa 对多重耐药(MDR)革兰氏阴性菌具有良好的活性作用,比较头孢他啶、美罗培南、环丙沙星、Zerbaxa对铜绿假单胞菌及其突变株耐药性实验中发现,铜绿假单胞菌对头孢他啶更易产生耐药性,其次为美罗培南、环丙沙星,最后为 Zerbaxa[14]。Zerbaxa 于 2014 年 12 月被美国 FDA 批准,临床主要用于治疗复杂性腹腔内感染和复杂性尿路感染,后增加其适应证,包括成人医院获得性肺炎及呼吸机相关肺炎。Zerbaxa 常见不良反应为肝酶升高、肾功能损害或衰竭以及腹泻[39]。
Avycaz(阿维巴坦/头孢他啶)的联合应用使得头孢他啶能够更好地发挥其抗菌活性。阿维巴坦是一种新型 β-内酰胺酶抑制剂,能够将 β-内酰胺酶的丝氨酸残基乙酰化,同时与其形成共价化合物,但阿维巴坦本身可重新环化恢复其活性,进而长效抑制 β-内酰胺酶[40]。Avycaz 用于治疗广泛的革兰氏阴性菌感染,包括多重耐药铜绿假单胞菌、碳青霉烯类抗生素耐药的革兰氏阴性菌,产 ESBLs 肠杆菌目细菌[16]。Avycaz 于 2015 年 2 月获得美国 FDA 批准,临床主要用于治疗成人复杂性腹腔感染和复杂性尿路感染,常见不良反应包括恶心、呕吐、腹痛等[15, 17]。
Vabomere(美罗培南/维博巴坦)属于碳青霉烯与β-内酰胺酶抑制剂的组合。美罗培南是一种 β-内酰胺类抗生素,主要是通过与细菌细胞壁中的青霉素结合蛋白结合,抑制细胞壁形成,最终导致细胞死亡。维博巴坦是一种广谱抑制剂,对碳青霉烯酶以及其他 A 类碳青霉烯酶具有较好的抑制作用[41]。体外研究发现,在 315 株产丝氨酸 β-内酰胺酶和碳青霉烯酶的肠杆菌目分离株中,8 μg/ml 的维博巴坦可恢复 93.7% 的分离株对美培罗南的活性[18]。在一项 III 期复杂性尿路感染试验中,接受 Vabomere 治疗患者的总体临床成功率为 98.4%。Vabomere 于 2017 年 8 月获得美国 FDA 的加速批准,可用于由特定的敏感肠杆菌引起的肾盂肾炎的成人患者。Vabomere 在使用过程中最常见的不良反应是头痛、输液部位反应和腹泻[19]。
Recarbrio(亚胺培南/西司他丁/瑞来巴坦)是一种新型的 β-内酰胺/β-内酰胺酶抑制剂组合。Recarbrio 具有抑制多种 β-内酰胺酶(例如 A 类和 C类 β-内酰胺酶,包括碳青霉烯酶)的能力。亚胺培南通过抑制细菌细胞壁的合成发挥抗菌作用[42]。西司他丁可以抑制肾脏对亚胺培南的代谢,本身并无抗菌活性。瑞来巴坦与 A、C 级 β-内酰胺酶具有高度的亲和力。对现有的临床和药代动力学数据支持的批准剂量为每 6 小时输注(30 分钟输注完)亚胺培南500 mg/西司他丁 500 mg/瑞来巴坦 250 mg,可根据肾功能进行剂量调整[20]。Recarbrio 于 2019 年 7 月被批准上市,临床主要用于治疗复杂性尿路感染、复杂性腹腔内感染、医院获得性细菌性肺炎和呼吸机相关性肺炎[43]。Recarbrio 常见的不良反应包括恶心、腹泻、头痛、发烧和肝酶升高。
3 四环素类
四环素类抗生素的主要作用机制是与核糖体 30S 亚基结合,与 tRNA 竞争A 位,阻止氨酰-tRNA 到达并与 mRNA 核糖体复合物的 A 位结合,阻止肽链延伸,抑制蛋白质的合成而抑制细菌生长[44-46]。
四环素类抗生素中第一代的金霉素、土霉素和四环素为天然产物,具有广谱的抗菌活性。在第一代四环素发现后不久,通过对 C 环的一系列化学修饰得到了第二代半合成衍生物甲烯土霉素,进一步修饰得到多西霉素的前体化合物。通过对四环素的结构改造得到了米诺环素,米诺环素成为了当时最有效的四环素类抗生素[47-50]。然而由于四环素耐药性的不断出现,人们开始重新对四环素类抗生素进行研究和评价。
替加环素是一种甘氨酰环素类抗生素,属于米诺环素的衍生物,于 1993 年被发现,2005 年进入临床使用[51]。替加环素具有广谱的抗菌活性,对多种革兰氏阴性及革兰氏阳性菌具有良好的活性作用。对 28 株青霉素敏感和 30 株青霉素耐药肺炎链球菌的体外 MIC90均为 0.12 μg/ml,而四环素、强力霉素、米诺环素的相应 MIC90范围在 8 ~32 μg/ml;替加环素对于 42 株粪肠球菌和 40 株屎肠球菌的 MIC90均为 0.25 μg/ml,而四环素、强力霉素、米诺环素相应的 MIC90为 16 ~ 128 μg/ml[52]。替加环素对大肠埃希菌 ATCC 25922 和耐四环素的大肠埃希菌 894 的 MIC 均为 0.12 μg/ml[53]。临床常用于成人复杂性皮肤感染、复杂性腹内感染和社区获得性细菌性肺炎等,不良反应主要包括恶心、呕吐、腹泻、肝功能异常和影响牙齿发育,导致永久性变色等[54]。
伊拉瓦环素是一种新开发的、人工合成的四环素类衍生物,对多种微生物表现出有效的广谱抗菌活性。除了对耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌等革兰氏阳性菌的抑制活性外,伊拉瓦环素对碳青霉烯类耐药肠杆菌和产 ESBLs 的肠杆菌也显示出潜在的体外活性[21]。研究发现,在 230 株对碳青霉烯类耐药的肠杆菌目菌中,伊拉瓦环素的 MIC90为 1 μg/ml,米诺环素和四环素与其相比则高出 8 ~ 16 倍[55]。伊拉瓦环素于2018 年 8 月由美国 FDA 批准上市,在临床主要用于治疗复杂性腹腔内感染,常见的不良反应为轻度的恶心和呕吐[22]。
奥玛环素是一种新型半合成类四环素。该药物显示出对革兰氏阳性、革兰氏阴性和非典型细菌的显著活性。奥玛环素对肠杆菌具有体外抑制活性,包括大肠埃希菌(MIC90=2 μg/ml)、肺炎克雷伯杆菌(MIC90= 8 μg/ml)、产酸克雷伯杆菌(MIC90= 2 μg/ml)、柠檬酸杆菌(MIC90= 4 μg/ml)和阴沟肠杆菌(MIC90= 4 μg/ml)。奥玛环素既可以静脉注射,也有口服制剂,在血清、肺表面活性剂或尿液存在的情况下,奥玛环素在 pH 8.0 时仍保持活性。奥玛环素于 2018 年 10 月获得美国 FDA 批准上市,临床上主要用于治疗成人细菌性肺炎和急性细菌性皮肤感染,常见不良反应主要为胃肠道反应等[23, 56]。
4 喹诺酮类
喹诺酮类抗生素通过靶向 DNA 回旋酶和拓扑异构酶 IV 来抑制 DNA 合成,进而干扰细菌分裂[57]。在抗疟药氯喹的化学制造过程中发现了第一种抗菌药喹诺酮,其显示出抗革兰氏阴性菌的活性,但其效力和抗菌谱不够显著,不足以用于临床治疗[58]。而在喹诺酮的结构基础上改造得到了萘啶酸,其对革兰氏阴性菌具有一定的抗菌活性,成功应用于临床,成为了第一代的喹诺酮类抗生素[59]。碳 6 位引入氟原子得到了氟喹诺酮,其中诺氟沙星对革兰氏阴性菌和阳性菌均具有一定活性,在临床上主要应用于泌尿生殖道感染[47]。环丙沙星具有广谱的抗菌活性,对肠杆菌目菌活性比诺氟沙星高出 4 ~ 8 倍,甚至比萘啶酸高出 64 倍,目前依旧在临床中被广泛应用[60]。左氧氟沙星是氧氟沙星的左旋体,在临床革兰氏阳性菌、革兰氏阴性菌和非典型菌表现出良好的体外活性。左氧氟沙星对流感嗜血杆菌、副流感嗜血杆菌和卡他莫拉菌 MIC90≤ 0.06 μg/ml[61]。但近年由于细菌耐药性不断增强,大肠埃希菌对左氧氟沙星以及环丙沙星的耐药性从 1994 年的 2.1% ~ 2.4% 升至 2016 年的 36.6% ~ 37.6%,肺炎克雷伯杆菌对左氧氟沙星的耐药性也有所增加,氟喹诺酮类抗生素的耐药也常发生在产 ESBLs 的菌株中[62]。
非那沙星是一种氟喹诺酮类抗菌药。非那沙星具有广泛的抗革兰氏阳性和革兰氏阴性菌活性,在 pH 5.8 的条件下,非那沙星对耐药大肠杆菌的 MIC 相当于其他氟喹诺酮类药物(如环丙沙星)的 1/2 ~ 1/16[63]。非那沙星和其他一些氟喹诺酮类药物(环丙沙星、莫西沙星)的共同之处是在N-1(7) 位具有亲脂性环丙基,使得生物利用度高,而非那沙星在 C-7(7) 取代基体积的增加延长了其半衰期[24]。非那沙星于 2014 年 12 月由美国 FDA 批准上市,临床中主要用于治疗由铜绿假单胞菌及金黄色葡萄球菌引起的急性外耳炎,常见的不良反应包括耳朵瘙痒和恶心[63]。
德拉沙星由 Melinta Therapeutics 公司开发。德拉沙星属于广谱的氟喹诺酮类抗生素,具有阴离子特性,在酸性条件下能够表现出良好的活性,更好地消灭酸性环境中的金黄色葡萄球菌[64]。但德拉沙星在临床应用中对于大肠埃希菌、产酸克雷伯氏杆菌、奇异变形杆菌和铜绿假单胞菌等革兰氏阴性菌均具有抗菌活性[25]。该药的静脉注射剂型和口服剂型均于 2017 年 6 月获美国 FDA 批准,临床用于成人急性细菌性皮肤及皮肤组织感染的治疗,不良反应包括腹泻、恶心和轻度的中枢神经系统反应[65]。
拉库沙星是一种口服的氟喹诺酮类抗菌剂。在革兰氏阴性菌中,拉库沙星对卡他莫拉菌、氨苄西林耐药的流感嗜血杆菌、肠杆菌属、肺炎克雷伯菌属、不动杆菌属均有抗菌活性。其中对肠杆菌属、肺炎克雷伯菌属和不动杆菌属的 MIC90分别为 0.25、0.25 和 0.5 μg/ml,对大肠埃希菌和铜绿假单胞菌的 MIC90分别为 0.25 μg/ml 和 4 μg/ml[26]。2019 年 9 月获得日本厚生劳动省(MHLW)批准上市,临床主要用于治疗耳鼻喉科感染和呼吸道感染。常见不良反应包括发热、头痛、白细胞增多等[66]。
5 氨基糖苷类
氨基糖苷类抗生素通过与细菌核糖体结合并抑制正常蛋白质合成来杀死细菌[67]。具体地说,它们是与细菌 30S 核糖体亚基的 16S 核糖体 RNA 的 A 位点(转移 RNA 受体位点)结合[68]。
1944 年科学家从灰色链霉菌中成功分离出链霉素,链霉素也成为第一种有效治疗结核病的药物[69]。随后的新霉素(1949 年)、卡那霉素(1957 年)、庆大霉素(1963 年)、奈替米星(1967 年)、妥布霉素(1967 年)和阿米卡星(1972 年)等均对革兰氏阴性菌展现出较好活性[70]。
普拉佐米星是一种新型的氨基糖苷类抗生素,可与细菌的 30S核糖体亚基结合,抑制细菌蛋白质的合成,同时能避免被主要的氨基糖苷类抗生素钝化酶破坏而失去活性[71]。除此之外,普拉佐米星对超广谱 β-内酰胺酶和碳青霉烯酶具有良好活性。有研究人员以 1:1 的比例随机分配 609 例患有复杂尿路感染的患者,接受静脉注射普拉佐米星(15 mg/kg·d)和美罗培南(1 g/8 h)[72]。结果显示,普拉佐米星组比美罗培南组的患者有更高的微生物根除率,包括根除对氨基糖苷不敏感的肠杆菌目菌和产 ESBLs 肠杆菌目菌,普拉佐米星组发生复发的患者少于美罗培南组。因此,每天一次的普拉佐米星在治疗由肠杆菌目菌(包括多重耐药菌株)引起的复杂的尿路感染和急性肾盂肾炎方面不亚于美罗培南。普拉佐米星注射剂于 2018 年 6 月获得美国 FDA 批准通过,用于治疗复杂性尿路感染,尤其是由耐多药革兰氏阴性杆菌引起的成人复杂性尿路感染。不推荐用于严重肾功能不全患者,包括接受肾脏替代治疗的患者[28]。
6 截短侧耳素类
来法莫林是一种新型半合成截短侧耳素抗生素。其作用机制主要是通过与核糖体中 50S 亚基中肽基转移酶中心相结合,抑制细菌蛋白质的合成[73]。来法莫林在体外对革兰氏阳性和革兰氏阴性需氧和厌氧细菌以及非典型细菌表现出广谱的抗菌活性,包括耐甲氧西林金黄色葡萄球菌、耐多药肺炎链球菌和耐大环内酯类肺炎支原体流感嗜血杆菌、嗜肺军团菌[30]。2019 年 8 月获得美国 FDA 批准,可用于治疗社区获得性细菌性肺炎。常见不良反应包括腹泻、恶心、注射部位反应等[29]。
7 多黏菌素类
多黏菌素类抗生素最早于 1947 从多黏类芽孢杆菌中分离获得,是一类天然来源的环状阳离子多肽[74]。多黏菌素类抗生素对大多数革兰氏阴性菌均具有抑制作用,但由于其肾毒性作用,临床使用逐渐减少。随着耐碳青霉烯类肠杆菌、鲍曼不动杆菌等多药耐药革兰氏阴性菌的不断出现,多黏菌素重新被重视起来,并成为了抗多药耐药革兰氏阴性菌治疗的“最后一道防线”。目前应用较多的为多黏菌素 B 和多黏菌素 E,其阳离子与细菌外膜上的含阴离子的脂多糖相结合,竞争性地取代原本的Mg2+和 Ca2+,破坏细胞膜的通透性[75-76]。但还有研究称多黏菌素类抗生素是通过羟自由基、泛醌氧化还原酶的产生抑制细菌生长[77-78]。在临床应用中,专家推荐根据不同感染部位、不同病原菌及药敏情况联合其他抗菌药物应用。主要应用于由多种革兰氏阴性菌引起的肺部感染、血流感染、中枢神经系统感染、泌尿系统感染等。主要不良反应包括肾毒性、神经毒性、色素沉淀、肌肉注射疼痛等[79]。
8 其他
除已经上市的药物之外,诸多化合物目前仍处于临床前和临床研究阶段[80]。骨架为吡咯嘧啶二酮的 G0507 及其结构衍生物和结构为吡啶咪唑的类似物等能够抑制细胞外膜脂蛋白转运系统,对革兰氏阴性菌具有活性作用[81-82]。化合物 IMB-881、POL7080、CHIR-090、LpxC-4 等通过抑制革兰氏阴性菌外膜脂多糖的形成而抑制革兰氏阴性菌的感染,IMB-881 能够抑制耐碳青霉烯的大肠埃希菌和多药耐药的鲍曼不动杆菌的生长;POL7080 对铜绿假单胞菌具有抗菌活性作用,已经进入 III 期临床研究;CHIR-090 和 LpxC-4 对大肠埃希菌和铜绿假单胞菌均具有活性作用[83-85]。JNJ-Q2 属于氟喹诺酮类化合物,具有良好的药代活性,对铜绿假单胞菌、耐环丙沙星的大肠埃希菌、流感嗜血杆菌和肺炎克雷伯杆菌具有较好的抗菌作用[86]。此外还包括一些利用其他作用机制的化合物对革兰氏阴性菌具有抑制作用,如新型苯并噻二唑衍生物 C109 通过抑制丝状温敏蛋白 Z 抑制革兰氏阴性菌等[80]。
9 总结与展望
目前新型抗菌药物的研发主要是基于对传统抗生素结构进行改造,从而达到增加抗菌谱、改善耐药性、降低毒性等目的,但同时也要避免交叉耐药现象的产生。例如以大环内酯类抗生素红霉素和克拉霉素为原料,对其 C-3、C-11 和 C-12 位进行改造,得到具有低耐药性、高抗菌活性的新衍生物[87]。除此之外,对细菌的结构以及生长繁殖代谢的各个环节进行了解,可发现针对病原体的新靶点用于研发新的药物。例如肽脱甲酰基酶是在细菌合成蛋白质过程中起到关键作用的一类金属酶,但不是哺乳动物合成蛋白质所需,因此肽脱甲酰基酶成为具有良好前景的抗菌靶点之一,肽脱甲酰基酶抑制剂 LBM415 对部分敏感的革兰氏阴性菌具有良好的活性作用[88]。另外,抗生素佐剂方法为抗生素的新发现提供了一种替代和补充的策略。这些化合物佐剂通过靶向抗药性或增强抗生素的作用来恢复或增强常用抗生素对多重耐药革兰氏阴性细菌的活性[89]。例如以 β-内酰胺类抗生素为基础的药物联用,能够扩大单一药物的抗菌谱,对产超广谱 β-内酰胺类的革兰氏阴性菌具有明显作用。
然而在抗革兰氏阴性菌药物研发过程中仍面临着诸多困难,包括细菌耐药性不断增强,耐药出现的周期逐渐缩短;研究周期长、利润回报低等原因,使得诸多制药公司放弃了抗生素的研发[90]。而革兰氏阴性菌特殊的细胞膜结构,使得药物研发更加困难。截至 2020 年 12 月共有 43 种抗生素处于临床开发阶段,I 期 15 种,II 期 13 种,III 期13 种,还有 2 种已经提交了新药申请,其中对革兰氏阴性菌具有抗菌作用的有 19 种[91]。不同机制和不同结构化合物的出现为抗革兰氏阴性菌药物的发展提供了更多的可能性。
综上所述,多药耐药菌和广泛耐药菌的不断出现促使着新型抗生素的不断研发。本文介绍了一些近几年被批准上市的抗革兰氏阴性菌药物以及正在研究的具有相关活性的化合物。在投入临床之前,每种药物需要进行强有力的临床试验来评估它们的安全性、有效性。为了减少耐药菌株的产生,每种药物都具有明确的适应证。随着科学技术的发展,多学科交叉应用,快速诊断技术、免疫疗法、基因编辑技术等更多更有效的手段用于抗生素药物的研发,相信革兰氏阴性菌感染问题会得到逐步解决。
[1] Högberg LD, Heddini A, Cars O. The global need for effective antibiotics: challenges and recent advances. Trends Pharmacol Sci, 2010, 31(11):509-515.
[2] Centers for Disease Control Prevention. Infographic: Antibiotic resistance the global threat. (2019-12-30) [2021-11-02]. https://www. cdc.gov/globalhealth/infographics/antibiotic-resistance/antibiotic_resistance_global_threat.htm.
[3] Jansen KU, Gruber WC, Simon R, et al. The impact of human vaccines on bacterial antimicrobial resistance. A review. Environ Chem Lett, 2021:1-32.
[4] Liu CX. Global concern: Strategies for antibiotic development and risk of resistance. Chin J Antibiot, 2019, 44(1):1-8. (in Chinese)
刘昌孝. 全球关注: 重视抗生素发展与耐药风险的对策. 中国抗生素杂志, 2019, 44(1):1-8.
[5] China Antimicrobial Surveillance Network. CHINE surveillance of bacterial resistance: results of first half of 2021. (2021-08-12) [2021-11-04]. http://www.chinets.com/Document. (in Chinese)
中国细菌耐药监测网. 2021年上半年细菌耐药监测结果. (2021-08- 12) [2021-11-04]. http://www.chinets.com/Document.
[6] Sperandeo P, Martorana AM, Polissi A. Lipopolysaccharide biogenesis and transport at the outer membrane of Gram-negative bacteria.Biochim Biophys Acta Mol Cell Biol Lipids, 2017, 1862(11):1451- 1460.
[7] Li YY, Shi F, Li Y, et al. Structure and function of lipopolyaccharide lipid A in bacteria —A review. Acta Microbiol Sinica, 2008, 48(6): 844-849. (in Chinese)
李颜颜, 史锋, 李烨, 等. 细菌类脂A结构与功能研究进展. 微生物学报, 2008, 48(6):844-849.
[8] Mo T, Liu MF, Cheng AC. Component and functions of lipopolysaccharide transport system in Gram-negative bacteria. Acta Microbiol Sinica, 2018, 58(9):1521-1530. (in Chinese)
莫婷, 刘马峰, 程安春. 革兰氏阴性菌脂多糖运输系统的构成及作用机制. 微生物学报, 2018, 58(9):1521-1530.
[9] Avery LM, Nicolau DP. Investigational drugs for the treatment of infections caused by multidrug-resistant Gram-negative bacteria. Expert Opin Investig Drugs, 2018, 27(4):325-338.
[10] Hsueh SC, Lee YJ, Huang YT, et al. In vitro activities of cefiderocol, ceftolozane/tazobactam, ceftazidime/avibactam and other comparative drugs against imipenem-resistant Pseudomonas aeruginosa and Acinetobacter baumannii, and Stenotrophomonas maltophilia, all associated with bloodstream infections in Taiwan. J Antimicrob Chemother, 2019, 74(2):380-386.
[11] Dobias J, Dénervaud-Tendon V, Poirel L, et al. Activity of the novel siderophore cephalosporin cefiderocol against multidrug-resistant Gram-negative pathogens. Eur J Clin Microbiol Infect Dis, 2017, 36(12):2319-2327.
[12] Sato T, Yamawaki K. Cefiderocol: discovery, chemistry, and in vivo profiles of a novel siderophore cephalosporin. Clin Infect Dis, 2019, 69(Suppl 7):S538-S543.
[13] Soon RL, Lenhard JR, Bulman ZP, et al. Combinatorial pharmacodynamics of Ceftolozane-Tazobactam against genotypically defined beta-lactamase-producing Escherichia coli: Insights into the pharmacokinetics/pharmacodynamics of beta-lactam-beta-lactamase inhibitor combinations. Antimicrob Agents Chemother, 2016, 60(4): 1967-1973.
[14] Cabot G, Bruchmann S, Mulet X, et al. Pseudomonas aeruginosa ceftolozane-tazobactam resistance development requires multiple mutations leading to overexpression and structural modification of AmpC. Antimicrob Agents Chemother, 2014, 58(6):3091-3099.
[15] Torres A, Rank D, Melnick D, et al. Randomized trial of ceftazidime-avibactam vs meropenem for treatment of hospital-acquired and ventilator-associated bacterial pneumonia (REPROVE): analyses per US FDA-specified end points. Open Forum Infect Dis, 2019, 6(4):ofz149.
[16] Pfizer Inc.. Pivotal phase III study underscores efficacy of Zavicefta™ (ceftazidime-avibactam) for treatment of hospital-acquired pneumonia, a leading cause of mortality in hospitals. (2017-04-24) [2021-11-08]. https://www.pfizer.com/news/press-release/press-release-detail/pivotal_phase_iii_study_underscores_efficacy_of_zavicefta_ceftazidime_avibactam_for_treatment_of_hospital_acquired_pneumonia_a_leading_cause_of_mortality_in_hospitals.
[17] Zhanel GG, Lawson CD, Adam H, et al. Ceftazidime-avibactam: a novel cephalosporin/beta-lactamase inhibitor combination. Drugs, 2013, 73(2):159-177.
[18] Castanheira M, Rhomberg PR, Flamm RK, et al. Effect of the β-lactamase inhibitor vaborbactam combined with meropenem against serine carbapenemase-producing enterobacteriaceae. Antimicrob Agents Chemother, 2016, 60(9):5454-5458.
[19] Cho JC, Zmarlicka MT, Shaeer KM, et al. Meropenem/vaborbactam, the first carbapenem/beta-lactamase inhibitor combination. Ann Pharmacother, 2018, 52(8):769-779.
[20] Smith JR, Rybak JM, Claeys KC. Imipenem-cilastatin-relebactam: a novel β-lactam-β-lactamase inhibitor combination for the treatment of multidrug-resistant gram-negative infections. Pharmacotherapy, 2020, 40(4):343-356.
[21] Solomkin J, Evans D, Slepavicius A, et al. Assessing the efficacy and safety of eravacycline vs ertapenem in complicated intra-abdominal infections in the investigating gram-negative infections treated with eravacycline (IGNITE 1) trial: a randomized clinical trial. JAMA Surg, 2017, 152(3):224-232.
[22] Lee YR, Burton CE. Eravacycline, a newly approved fluorocycline. Eur J Clin Microbiol Infect Dis, 2019, 38(10):1787-1794.
[23] Dougherty JA, Sucher AJ, Chahine EB, et al. Omadacycline: A new tetracycline antibiotic. Ann Pharmacother, 2019, 53(5):486-500.
[24] Taubert M, Chiesa J, Lückermann M, et al. Pharmacokinetics of intravenous finafloxacin in healthy volunteers. Antimicrob Agents Chemother, 2017, 61(10):e01122-17.
[25] Pfaller MA, Sader HS, Rhomberg PR, et al. In vitro activity of delafloxacin against contemporary bacterial pathogens from the United States and Europe, 2014. Antimicrob Agents Chemother, 2017, 61(4):e02609-16.
[26] Kishii R, Yamaguchi Y, Takei M. In vitro activities and spectrum of the novel fluoroquinolone lascufloxacin (KRP-AM1977). Antimicrob Agents Chemother, 2017, 61(6):e00120-17.
[27] Furuie H, Tanioka S, Shimizu K, et al. Intrapulmonary pharmacokinetics of lascufloxacin in healthy adult volunteers. Antimicrob Agents Chemother, 2018, 62(4):e02169-17.
[28] Shaeer KM, Zmarlicka MT, Chahine EB, et al. Plazomicin: a next-generation aminoglycoside. Pharmacotherapy, 2019, 39(1):77-93.
[29] Zhanel GG, Deng C, Zelenitsky S, et al. Lefamulin: a novel oral and intravenous pleuromutilin for the treatment of community-acquired bacterial pneumonia. Drugs, 2021, 81(2):233-256.
[30] Veve MP, Wagner JL. Lefamulin: review of a promising novel pleuromutilin antibiotic. Pharmacotherapy, 2018, 38(9):935-946.
[31] Bush K, Bradford PA. β-lactams and β-lactamase inhibitors: an overview. Cold Spring Harb Perspect Med, 2016, 6(8):a025247.
[32] Ding J. Advanced pharmacology. 2nd ed. Beijing: Science Press, 2019. (in Chinese)
丁健. 高等药理学. 2版. 北京: 科学出版社, 2019.
[33] Mughini-Gras L, Dorado-García A, Van Duijkeren E, et al. Attributable sources of community-acquired carriage of Escherichia coli containing β-lactam antibiotic resistance genes: a population-based modelling study. Lancet Planet Health, 2019, 3(8): e357-e369.
[34] Zhanel GG, Golden AR, Zelenitsky S, et al. Cefiderocol: A siderophore cephalosporin with activity against carbapenem-resistant and multidrug-resistant Gram-negative bacilli. Drugs, 2019, 79(3): 271-289.
[35] Ong'uti S, Czech M, Robilotti E, et al. Cefiderocol: A new cephalosporin stratagem against multidrug resistant gram-negative bacteria. Clin Infect Dis, 2022, 74(7):1303-1312.
[36] Biotechs T. FETROJA®(cefiderocol) Approved by the FDA for treatment of complicated urinary tract infections (cUTI) in adult patients with limited or no alternative treatment options. (2019-11-04) [2021-11-08]. https://www.businesswire.com/news/home/20191114005950/en/FETROJA%C2%AE-cefiderocol-Approved-FDA-Treatment-Complicated-Urinary.
[37] Ambler RP. The structure of beta-lactamases. Philos Trans R Soc Lond B Biol Sci, 1980, 289(1036):321-331.
[38] Karaiskos I, Galani I, Souli M, et al. Novel β-lactam-β-lactamase inhibitor combinations: expectations for the treatment of carbapenem-resistant Gram-negative pathogens. Expert Opin Drug Metab Toxicol, 2019, 15(2):133-149.
[39] Brooks M. Dual antibiotic Zerbaxa gets FDA nod for bacterial pneumonia. (2019-06-03) [2021-11-10]. https://www.medscape.com/ viewarticle/913838.
[40] Ehmann DE, Jahić H, Ross PL, et al. Avibactam is a covalent, reversible, non-β-lactam β-lactamase inhibitor. Proc Natl Acad Sci U S A, 2012, 109(29):11663-11668.
[41] Lomovskaya O, Sun D, Rubio-Aparicio D, et al. Vaborbactam: Spectrum of beta-lactamase inhibition and impact of resistance mechanisms on activity in enterobacteriaceae. Antimicrob Agents Chemother, 2017, 61(11):e01443-17.
[42] Hashizume T, Ishino F, Nakagawa J, et al. Studies on the mechanism of action of imipenem (N-formimidoylthienamycin) in vitro: binding to the penicillin-binding proteins (PBPs) in Escherichia coli and Pseudomonas aeruginosa, and inhibition of enzyme activities due to the PBPs in E. coli. J Antibiot (Tokyo), 1984, 37(4):394-400.
[43] Stover KR, Barber KE, Wagner JL. Allergic reactions and cross-reactivity potential with beta-lactamase inhibitors. Pharmacy (Basel), 2019, 7(3):77.
[44] Maxwell IH. Partial removal of bound transfer RNA from polysomes engaged in protein synthesis in vitro after addition of tetracycline. Biochim Biophys Acta, 1967, 138(2):337-346.
[45] Brodersen DE, Clemons Jr WM, Carter AP, et al. The structural basis for the action of the antibiotics tetracycline, pactamycin, and hygromycin B on the 30S ribosomal subunit. Cell, 2000, 103(7): 1143-1154.
[46] Pioletti M, Schlünzen F, Harms J, et al. Crystal structures of complexes of the small ribosomal subunit with tetracycline, edeine and IF3. EMBO J, 2001, 20(8):1829-1839.
[47] Nguyen F, Starosta AL, Arenz S, et al. Tetracycline antibiotics and resistance mechanisms. Biol Chem, 2014, 395(5):559-575.
[48] Boothe JH, Kende AS, Fields TL, et al. Total synthesis of tetracyclines. I.(±)-Dedimethylamino-12a-deoxy-6-demethylanhydrochlorotetracycline. J Am Chem Soc, 1959, 81(4):1006-1007.
[49] Stephens CR, Beereboom JJ, Rennhard HH, et al. 6-deoxytetracyclines. IV. 1,2 preparation, C-6 stereochemistry, and reactions. J Am Chem Soc, 1963, 85(17):2643-2652.
[50] Martell MJ, Boothe JH. The 6-deoxytetracyclines. VII. Alkylated aminotetracyclines possessing unique antibacterial activity. J Med Chem, 1967, 10(1):44-46.
[51] Sum PE, Petersen P. Synthesis and structure-activity relationship of novel glycylcycline derivatives leading to the discovery of GAR-936. Bioorg Med Chem Lett, 1999, 9(10):1459-1462.
[52] Boucher HW, Wennersten CB, Eliopoulos GM. In vitro activities of the glycylcycline GAR-936 against gram-positive bacteria. Antimicrob Agents Chemother, 2000, 44(8):2225-2229.
[53] van Ogtrop ML, Andes D, Stamstad TJ, et al. In vivo pharmacodynamic activities of two glycylcyclines (GAR-936 and WAY 152,288) against various gram-positive and gram-negative bacteria. Antimicrob Agents Chemother, 2000, 44(4):943-949.
[54] Yaghoubi S, Zekiy AO, Krutova M, et al. Tigecycline antibacterial activity, clinical effectiveness, and mechanisms and epidemiology of resistance: narrative review. Eur J Clin Microbiol Infect Dis, 2021:1-20.
[55] Livermore DM, Mushtaq S, Warner M, et al. In vitro activity of eravacycline against carbapenem-resistant enterobacteriaceae and acinetobacter baumannii. Antimicrob Agents Chemother, 2016, 60(6):3840-3844.
[56] Karlowsky JA, Steenbergen J, Zhanel GG. Microbiology and preclinical review of omadacycline. Clin Infect Dis, 2019, 69(Suppl 1): S6-S15.
[57] Fàbrega A, Madurga S, Giralt E, et al. Mechanism of action of and resistance to quinolones. Microb Biotechnol, 2009, 2(1):40-61.
[58] Mitscher LA. Bacterial topoisomerase inhibitors: quinolone and pyridone antibacterial agents. Chem Rev, 2005, 105(2):559-592.
[59] Zinsser HH. Nalidixic acid in acute and chronic urinary tract infections. Med Clin North Am, 1970, 54(5):1347-1350.
[60] Wise R, Andrews JM, Edwards LJ. In vitro activity of Bay 09867, a new quinoline derivative, compared with those of other antimicrobial agents. Antimicrob Agents Chemother, 1983, 23(4):559-564.
[61] Anderson VR, Perry CM. Levofloxacin: a review of its use as a high-dose, short-course treatment for bacterial infection. Drugs, 2008, 68(4):535-565.
[62] Bouchillon SK, Badal RE, Hoban DJ, et al. Antimicrobial susceptibility of inpatient urinary tract isolates of gram-negative bacilli in the United States: results from the study for monitoring antimicrobial resistance trends (SMART) program: 2009-2011. Clin Ther, 2013, 35(6):872-877.
[63] McKeage K. Finafloxacin: first global approval. Drugs, 2015, 75(6):687-693.
[64] Lemaire S, Tulkens PM, Van Bambeke F. Contrasting effects of acidic pH on the extracellular and intracellular activities of the anti-gram-positive fluoroquinolones moxifloxacin and delafloxacin against Staphylococcus aureus. Antimicrob Agents Chemother, 2011, 55(2):649-658.
[65] Jorgensen SCJ, Mercuro NJ, Davis SL, et al. Delafloxacin: place in therapy and review of microbiologic, clinical and pharmacologic properties. Infect Dis Ther, 2018, 7(2):197-217.
[66] Thakare R, Singh S, Dasgupta A, et al. Lascufloxacin hydrochloride to treat bacterial infection. Drugs Today (Barc), 2020, 56(6):365-376.
[67] Dozzo P, Moser HE. New aminoglycoside antibiotics. Expert Opin Ther Pat, 2010, 20(10):1321-1341.
[68] Magnet S, Blanchard JS. Molecular insights into aminoglycoside action and resistance. Chem Rev, 2005, 105(2):477-498.
[69] Waksman SA, Schatz A, Reynolds DM. Production of antibiotic substances by actinomycetes. Ann N Y Acad Sci, 2010, 1213:112-124.
[70] Krause KM, Serio AW, Kane TR, et al. Aminoglycosides: an overview. Cold Spring Harb Perspect Med, 2016, 6(6):a027029.
[71] Mckinnell JA, Dwyer JP, Talbot GH, et al. Plazomicin for infections caused by carbapenem-resistant enterobacteriaceae. N Engl J Med, 2019, 380(8):791-793.
[72] Wagenlehner FME, Cloutier DJ, Komirenko AS, et al. Once-daily plazomicin for complicated urinary tract infections. N Engl J Med, 2019, 380(8):729-740.
[73] Novak R. Are pleuromutilin antibiotics finally fit for human use? Ann N Y Acad Sci, 2011, 1241:71-81.
[74] Biswas S, Brunel JM, Dubus JC, et al. Colistin: an update on the antibiotic of the 21st century. Expert Rev Anti Infect Ther, 2012, 10(8):917-934.
[75] Velkov T, Roberts KD, Nation RL, et al. Pharmacology of polymyxins: new insights into an 'old' class of antibiotics. Future Microbiol, 2013, 8(6):711-724.
[76] Karaiskos I, Souli M, Galani I, et al. Colistin: still a lifesaver for the 21st century? Expert Opin Drug Metab Toxicol, 2017, 13(1):59-71.
[77] Deris ZZ, Akter J, Sivanesan S, et al. A secondary mode of action of polymyxins against Gram-negative bacteria involves the inhibition of NADH-quinone oxidoreductase activity. J Antibiot (Tokyo), 2014, 67(2):147-151.
[78] Sampson TR, Liu X, Schroeder MR, et al. Rapid killing of Acinetobacter baumannii by polymyxins is mediated by a hydroxyl radical death pathway. Antimicrob Agents Chemother, 2012, 56(11): 5642-5649.
[79] Chinese Research Hospital Association of Critical Care Medicine, Chinese Research Hospital Association of Evidence Base and Translational Infectious Diseases. Chinese expert consensus on polymyxins in the clinical practice. Chin Crit Care Med, 2019, 31(10): 1194-1198. (in Chinese)
中国研究型医院学会危重医学专业委员会, 中国研究型医院学会感染性疾病循证与转化专业委员会. 多黏菌素临床应用中国专家共识. 中华危重病急救医学, 2019, 31(10):1194-1198.
[80] Lu HJ, Zhang DF, Huang HH. Recent advances in study of drugs against Gram-negative pathogens. Acta Pharm Sinica, 2019, 54(9): 1554-1563. (in Chinese)
鲁海嘉, 张东峰, 黄海洪. 抗革兰氏阴性菌药物的研究进展. 药学学报, 2019, 54(9):1554-1563.
[81] Nickerson NN, Jao CC, Xu Y, et al. A novel inhibitor of the LolCDE ABC transporter essential for lipoprotein trafficking in gram-negative bacteria. Antimicrob Agents Chemother, 2018, 62(4):e02151-17.
[82] Mcleod SM, Fleming PR, Maccormack K, et al. Small-molecule inhibitors of gram-negative lipoprotein trafficking discovered by phenotypic screening. J Bacteriol, 2015, 197(6):1075-1082.
[83] Zhang X, Li Y, Wang W, et al. Identification of an anti-Gram-negative bacteria agent disrupting the interaction between lipopolysaccharide transporters LptA and LptC. Int J Antimicrob Agents, 2019, 53(4): 442-448.
[84] Montgomery JI, Brown MF, Reilly U, et al. Pyridone methylsulfone hydroxamate LpxC inhibitors for the treatment of serious gram-negative infections. J Med Chem, 2012, 55(4):1662-1670.
[85] Tomaras AP, Mcpherson CJ, Kuhn M, et al. LpxC inhibitors as new antibacterial agents and tools for studying regulation of lipid A biosynthesis in Gram-negative pathogens. mBio, 2014, 5(5):e01551- 14.
[86] Morrow BJ, He W, Amsler KM, et al. In vitro antibacterial activities of JNJ-Q2, a new broad-spectrum fluoroquinolone. Antimicrob Agents Chemother, 2010, 54(5):1955-1964.
[87] Li LJ, Gao L, Sun J, et al. Preparation and antimicrobial activity of the derivatives of erythromycin-based macrolides. Chin J Antibiot, 2019, 44(6):687-696. (in Chinese)
李立晶, 高蕾, 孙静, 等. 新型红霉素类大环内酯衍生物的合成及抗菌活性研究. 中国抗生素杂志, 2019, 44(6):687-696.
[88] Leeds JA, Dean CR. Peptide deformylase as an antibacterial target: a critical assessment. Curr Opin Pharmacol, 2006, 6(5):445-452.
[89] Liu Y, Li R, Xiao X, et al. Antibiotic adjuvants: an alternative approach to overcome multi-drug resistant Gram-negative bacteria. Crit Rev Microbiol, 2019, 45(3):301-314.
[90] Yang QW, Wu AH, Hu BJ, et al. Expert consensus on strategies for the prevention and control of spread of clinically important antimicrobial-resistant organisms. Chin J Infect Control, 2021, 20(1):1-14. (in Chinese)
杨启文, 吴安华, 胡必杰, 等. 临床重要耐药菌感染传播防控策略专家共识. 中国感染控制杂志, 2021, 20(1):1-14.
[91] The Pew Charitable Trust. Tracking the global pipeline of antibiotics in development, March 2021. (2021-03-09) [2021-11-20]. https://www. pewtrusts.org/en/research-and-analysis/issue-briefs/2021/03/tracking-the-global-pipeline-of-antibiotics-in-development.
10.3969/j.issn.1673-713X.2022.03.008
中国医学科学院医学与健康科技创新工程(2021-1-I2M- 026);国家自然科学基金(81773784)
100050 北京,中国医学科学院北京协和医学院药物研究所天然药物活性物质与功能国家重点实验室
林媛,Email:linyuan@imm.ac.cn
2021-12-02
