化学蛋白质组学方法解析天然产物生物合成途径
2022-06-09沈陈金鑫薛付冲李贤慧豪耿倚云许静远邓张双周怡青
李 晴 沈陈金鑫 薛付冲 李贤慧 郑 豪耿倚云 许静远 邓张双 周怡青
(1.常熟理工学院 生物与食品工程学院,江苏 苏州 215500;2.中国轻工业功能酵母重点实验室(三峡大学生物与制药学院),湖北 宜昌 443002)
相较于化学合成的小分子药物,天然产物在结构新颖性、生物相容性和功能多样性等方面具有明显的优势,并且在长期进化的过程中得到自然筛选优化.在新药研发和临床用药中天然产物及其衍生物占有很大比重.据统计在1939年至2016年间,美国FDA批准上市的药物中,有相当数量含有天然产物的分子片段(50%以上),甚至直接来源于天然产物[1].
从植物中提取是获得天然产物的传统手段.但是,由于植物资源的限制以及天然产物在植物中微小的含量,往往很难获得足够的样品用于天然产物活性的研究与开发.合成生物学的发展为植物天然产物的获取提供了新的途径,通过天然产物合成途径的解析和细胞工厂的构建,可以以葡萄糖为原料大量合成目标天然产物,从而为天然产物的研究和开发提供充足的原料[2].自然界中种类繁多,形态各异的植物产生了大量结构复杂多样的天然产物(或者称为次生代谢产物).这些天然产物既可以作为内源性小分子参与植物重要生理活动,例如调控植物自身的生长发育(例如赤霉素、脱落酸等植物激素)以及抵御病虫害(例如豌豆素、白藜芦醇等植保素),同时也是治疗人类重大疾病的创新药物分子的主要来源,例如:吗啡、阿司匹林、紫杉醇,喜树碱、青蒿素等.因此,解析植物天然产物的生物合成途径对于植物生物学研究、生态学研究,以及开发创新药物治疗人类重大疾病和植物保护分子都具有重要意义[3].
1 传统基因组层面天然产物生物合成途径解析策略
传统生物学研究原核生物天然产物的生物合成途径的方法主要是通过基于功能基因组学和生物信息学的cDNA克隆测序及表达序列标签(ESTs)特性分析[4].由于原核生物中催化功能相近的蛋白的基因同源性高,并且成簇(clusters)存在,在使用上述方法时更为方便快速.但在研究真核生物体系次生代谢产物的生物合成途径时,由于真核生物复杂的机体状态和不同的环境条件,次生代谢产物的生物合成途径也会千差万别,再使用和原核生物一样的方法进行研究,不仅工作量巨大,而且对于复杂生物体中的酶催化反应可能并不适用.此外,细胞中的蛋白表达水平可能并不对应负责细胞代谢、调控和信号传导的酶活性.例如一些反应可能需要几种不同的蛋白协同作用,共同催化反应的进行,而基因组转录不一定能够发现这些蛋白;再者,由于蛋白质的活性被很多翻译后修饰事件所控制,如磷酸化、甲基化、糖基化等,这些修饰后的活性蛋白的含量才能真正反映蛋白质在生理条件下的功能状态,因此仅仅在表达层面研究蛋白是不全面的.
与原核生物相比,研究来源于真核生物的天然产物的生物合成途径存在着更大的挑战.首先,真核生物基因组庞大,遗传背景复杂,难以获取高质量基因组序列;其次,真核生物,特别是植物天然产物生物合成基因大多数情况下并不成簇分布在植物基因组中,无法利用原核生物天然产物生物合成研究中常用的基因簇挖掘(genome mining)的方法来鉴定植物天然产物生物合成途径;最后,植物等真核生物生长周期相对原核生物更长,遗传操作相对复杂,很难通过体内敲除直接验证相关基因的功能.目前,在植物天然产物生物合成研究中的方法十分有限,包括了转录组分析、活性导向蛋白分离以及基于同源性的反向遗传学研究等[5].但这几种方法也有自身的一定局限性,不能有效促进植物中全新功能蛋白的发现,因此,开发出新颖高效的研究方法对于植物天然产物生物合成来说具有重要意义.
2 基于分子探针和化学蛋白质组学的天然产物生物合成途径解析策略
鉴于基因组或转录组层面研究蛋白功能存在上述缺陷,21世纪初,来自美国Scripps研究所的Benjamin Cravatt教授首次提出了基于活性/亲和性蛋白质谱(Activity/affinity-based protein profiling,ABPP)的概念,在功能蛋白质组层面研究蛋白功能[6].ABPP运用基于活性分子设计合成的高选择性的分子探针(activity-based probe,ABPs)对蛋白质的功能与结构进行研究,它不仅应用于鉴别与活性分子相互作用的蛋白质,同时也对其相互作用模式进行研究,在经典蛋白质组学与功能蛋白质组学间起到桥梁作用.基于活性探针(ABPs)能够在复杂的生物样品中特异性地标记处于功能状态下的蛋白质,该技术可以更直接地获取目标蛋白功能/结构层面的重要信息,而不仅仅是蛋白表达层面,因此具有更为重要的意义.ABPP策略弥补了其他蛋白质组学方法的不足,已经成为功能蛋白质组学研究的主要策略之一(如图1所示).根据探针结合蛋白的功能可分为3类:受体靶标(天然产物在异源体系发挥药效的生理靶标)、转运蛋白(天然产物在生源或异源物种的细胞器转运)、代谢酶(催化天然产物生源合成或分解,或称催化元件).截至目前,化学蛋白质组学策略已经广泛用于药用天然产物的异源(人)靶标或受体发现,本综述将通过近10年来的4组实例介绍该策略用于天然产物生物合成途径相关酶类挖掘方面的提出、发展以及应用.
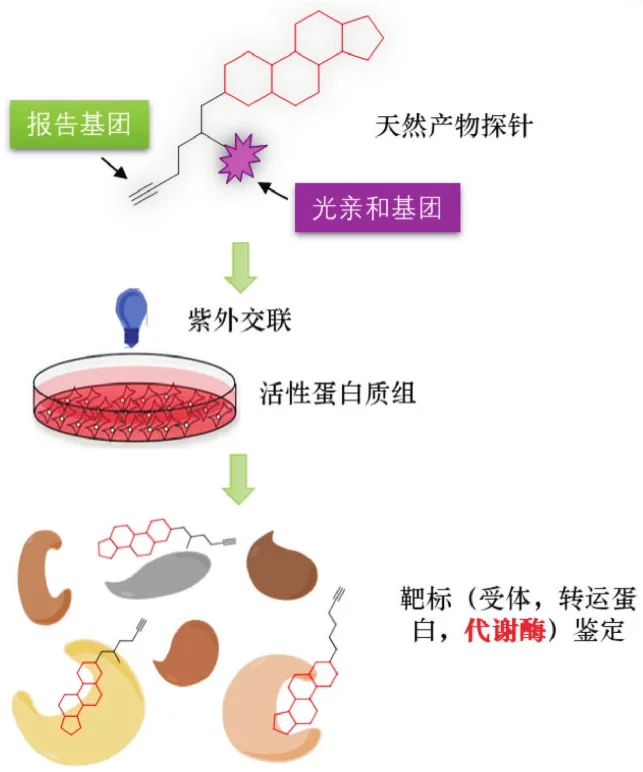
图1 基于分子探针和化学蛋白质组学的天然产物生物合成途径(代谢酶)的解析策略
2.1 胆固醇和胆酸
胆固醇(cholesterol)是人体组织细胞所不可缺少的重要代谢物.作为ABPP技术的创始人和引领者,Cravatt研究组在2013年合成了一系列基于胆固醇分子骨架的光亲和探针(如图2(a)所示),用于在哺乳动物细胞(HeLa)的活性蛋白质组中筛选胆固醇结合蛋白[7].结果发现,该探针能够标记并富集胆固醇生源合成途径中几乎所有的酶(如图2(b)所示).尽管该研究并不是在植物体系内完成,其结果首次给出了明确的提示:基于酶催化的底物或产物的衍生探针,通过化学蛋白质组学策略标记、富集并鉴定天然产物生物合成途径中的催化元件是完全可行的.
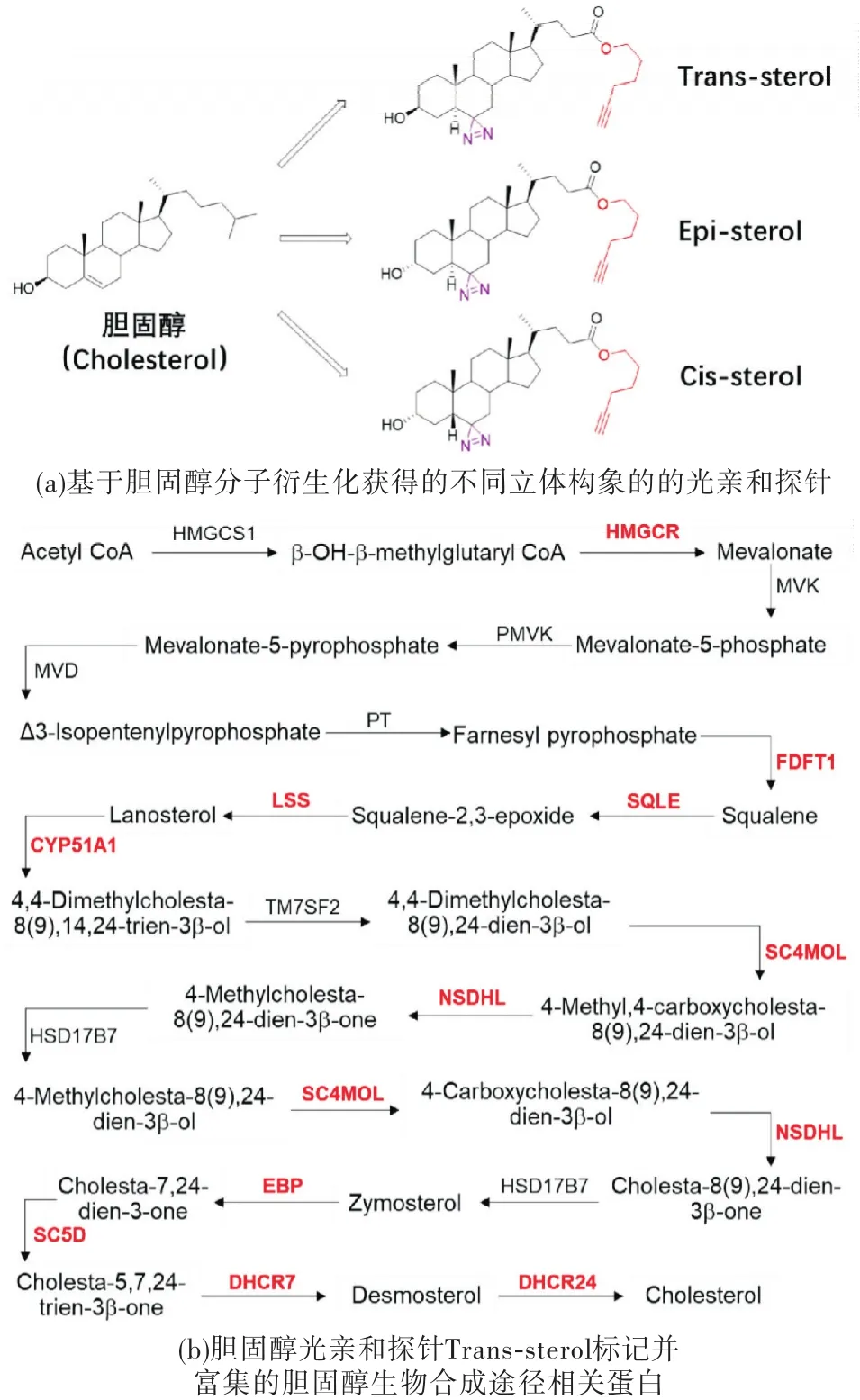
图2 活性/亲和性导向的蛋白质谱技术(ABPP)应用于胆固醇生物合成途径蛋白的富集[7]
2017年,北京大学的研究人员运用类似策略,以天然胆酸(Bile acid)分子结构为基础,设计并优化了一系列可以模拟胆酸生物学功能的光亲和探针,结合基于活细胞稳定同位素标记(Stable Isotope Labeling by Amino acids in Cell culture,SILAC)的定量蛋白质组学技术,在细胞水平上全面探寻了哺乳动物体内可以和胆酸分子特异性相互作用的潜在蛋白靶点[8].该方法成功鉴定到了600多个高置信度的胆酸相互作用蛋白,其中涵盖了胆酸的内源受体、转运体及其生物合成途径的催化元件.
2.2 原花青素
原花青素(Proanthocyanidin)是一类由儿茶素(Catechin)、表儿茶素(epi-Catechin)或没食子酸聚合而成的多酚类黄酮化合物.广泛存在于水果、蔬菜、花朵、坚果和树皮中.在植物体内可转变为花青素.流行病学资料表明花青素有降低肠胃癌症风险、心血管病风险及预防女性尿路感染等作用[9].无色花色素双加氧酶(Leucoanthocyanidin dioxygenase,LDOX)是花色素生物合成最后步骤的关键酶之一,催化无色花色素(Leucoanthocyanidin)氧化聚合并生成带有颜色的原花青素.
2011年,Chaluneau等设计并合成了一系列固载黄酮类天然产物的树脂(如图3(a)所示),并在蛋白质组富集潜在的催化原花青素生物合成最后一步的酶[10].在初步的可行性分析实验中他们发现,通过对黄酮B环的邻苯二酚结构的一个羟基进行化学衍生所获得的树脂无法富集LDOX蛋白,而对A环C3位进行化学修饰获得的树脂成功特异性富集了LDOX蛋白.2014年,Carrie等对儿茶素和表儿茶素进行化学衍生,合成了生物素化的探针(如图3(b)所示)[11].由于大部分天然黄酮含有邻苯二酚结构,可以通过高碘酸钠处理将其氧化成具有强亲电活性的邻苯醌结构并共价修饰包括生物合成酶在内的潜在的结合蛋白(如图3(c)所示).将该系列生物素化探针与LDOX共孵育后,加入高碘酸钠,使探针在原位(in situ)选择性共价修饰LDOX.结果显示,在高碘酸钠存在下,探针成功结合了LDOX蛋白,且其结合程度大大优于传统的光亲和探针(如图3(d)所示).加入还原剂抗坏血酸钠显著降低探针标记,证明邻二醌中间体在标记中是不可或缺的.同时,在体系内加入BSA蛋白后,探针仍然主要结合LDOX,说明该结合是具有结构选择性的.尽管该探针最终未被用于植物中黄酮生物合成元件的挖掘,它首次证明了将基于亲和性探针用于植物天然产物生物合成酶的标记是完全可行的.
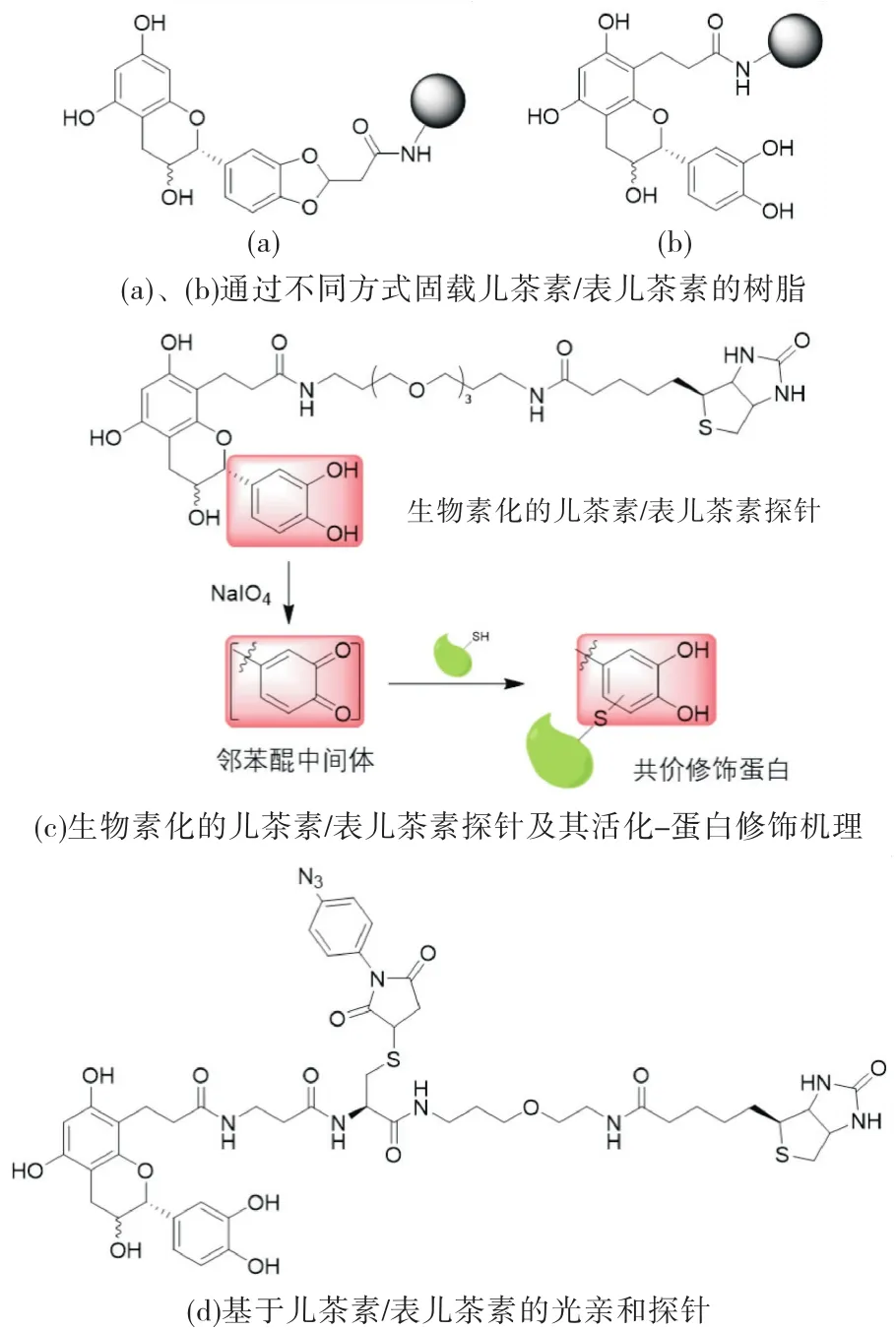
图3 原花青素生物合成途径LDOX酶的富集和标记[10-11]
2.3 桑白皮中D-A类型天然产物
桑白皮是来源于桑科植物根皮的一种传统中药,具有止咳、平喘、抗炎等功效,其作为“复方SH”的主要成分已被泰国政府批准用于治疗艾滋病.桑白皮中含有一类特殊的Diels-Alder(D-A)类型天然产物,它们具有共同的环己烯骨架结构,具有多样的生物活性.生源上,这类天然产物是由查尔酮(亲二烯体)和不同二烯体发生分子间Diels-Alder反应形成的.揭示桑树中全新的分子间Diels-Alder反应酶,不仅会极大地丰富对D-A反应酶的认知,也会促进桑科植物中这类具有重要生物活性的D-A类型天然产物的开发和利用.
为了找寻桑树愈伤组织中催化morachalcone A(2)和二烯体(4)发生分子间D-A反应的酶,北京大学雷晓光研究组与合作者开发了一种基于天然生物合成中间体探针(Biosynthetic Intermediate Probes,BIPs)的化学蛋白质组学策略,对亲二烯体morachalcone A进行化学衍生合成光亲和探针(如图4(a)~(b)所示),与具有高催化活性的桑树愈伤组织蛋白组分孵育并进行紫外交联,然后进行后续的靶标富集实验(如图4(c)所示),洗脱后通过银染找到了可能与探针分子存在相互作用的蛋白,并对互作蛋白胶内酶切后的肽段进行质谱检测[12].结果表明,被探针富集的条带中包含了BBE-like protein,暗示桑树中的BBE-like protein很可能是D-A反应酶.随后,研究人员对桑树愈伤组织进行了转录组测序,共鉴定出了14个BBE-like protein家族蛋白,并对转录水平最高的两个基因(Ma MO和MaDA)进行了表达纯化以及功能验证.酶学活性测试发现,Ma MO能够氧化moracin C(3)生成二烯体(4),而MaDA能够催化二烯体(4)和morachalcone A(2)发生分子间环化反应.后续生化实验结果表明,作为一个催化分子间Diels-Alder反应的酶,MaDA对二烯体和亲二烯体都具有很好的底物兼容性,可作为一种高效的生物催化剂,用于D-A类型化合物的合成.
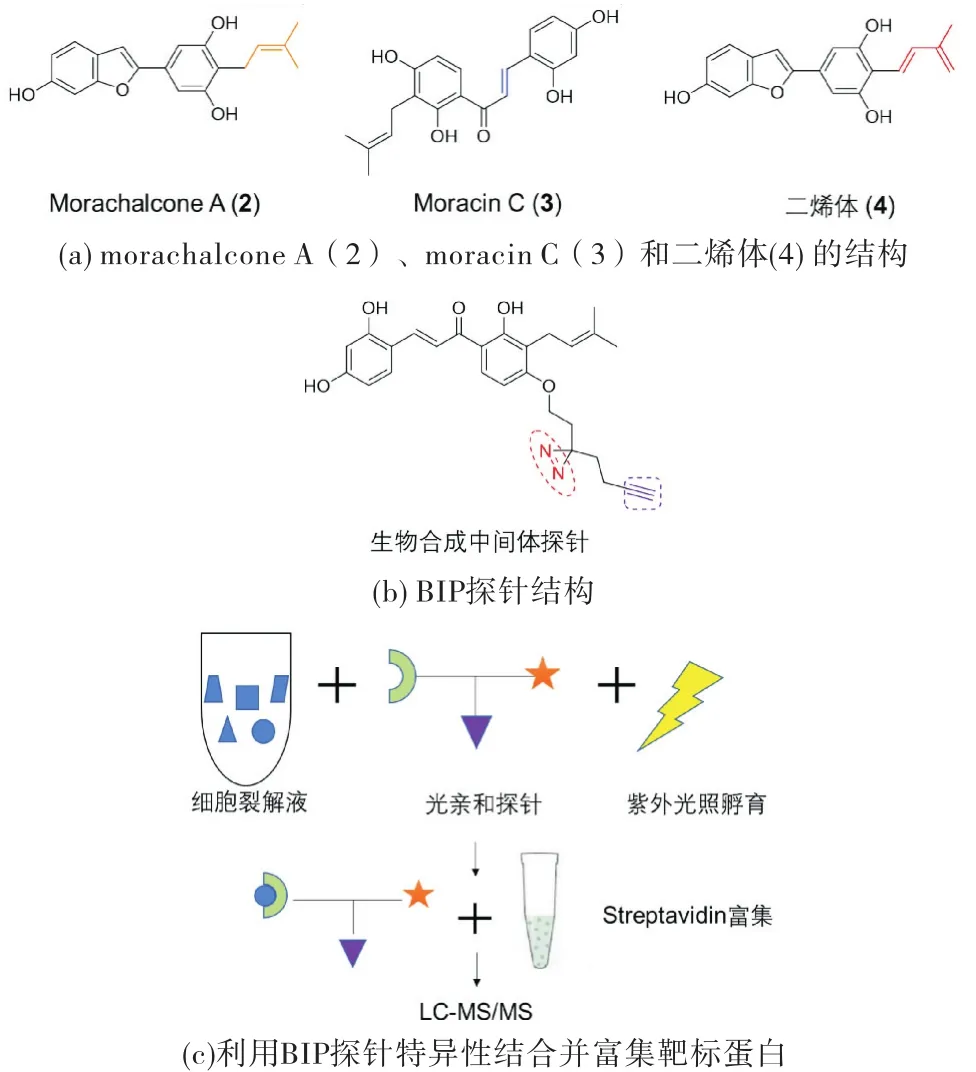
图4 分子探针技术应用于桑白皮中D-A类型天然产物生物合成途径相关蛋白的挖掘[12]
综上,基于生物合成中间体探针的化学蛋白质组学策略从蛋白和底物结合的角度为植物天然产物生物合成途径的研究提供了新的思路.近期,该研究组与合作者报道了自然界中催化不同endo/exo选择性Diels-Alder反应的酶,利用这两类酶实现了一系列D-A产物的高效精准合成,并解析了这两类不同反应的催化机制,为后续D-A反应酶的开发和在药物合成上的应用奠定了基础[13].
2.4 甜菊糖苷
随着20世纪60年代世界范围内禁止使用甜精和糖精等合成甜味剂,及后来对蔗糖摄食过多的危害性的不断认识,出现了以天然作物生产甜味剂替代蔗糖的发展要求.甜菊糖苷(Stevioside),简称甜菊糖,是从甜叶菊(Stevia rebaudiana Bertoni)叶片中提取得到的一种高甜度、低热量的天然甜味剂,其甜度相当于蔗糖的200~350倍,热量是蔗糖的200~300分之一,是目前国内外公认的可替代蔗糖的理想的健康新糖源.现已鉴定出甜叶菊中的甜味成分均属甙类,是双萜衍生物甜菊醇(steviol)糖基化后生成的多种糖苷类化合物.目前的研究发现该类糖基化反应都是由UDP依赖型糖基转移酶催化的,该类酶将一个糖基从一个活化的供体(通常是UDP-葡萄糖)转移到受体分子上.随着研究技术的发展,目前有34种甜菊糖甙类化合物被鉴定并报道.但是,在甜叶菊中只发现了数十种UGT转移酶,且只有有限的几个糖基转移酶可以确证在甜菊糖苷的生物合成中起到作用[14].
针对这一不对等的数据信息积累和发展,为高效解析甜菊糖苷生物合成途径,挖掘新的UGT元件,Li等利用活性分子探针导向的定量化学蛋白质组学策略,以二萜贝壳杉稀骨架衍生的甜菊醇(steviol)为基本结构设计化学小分子探针ST-Dayne和ST-yne,分别实现在非模式植物的富产甜菊糖苷同源宿主(甜叶菊)和不产该类化合物异源(拟南芥)模式植物的活性蛋白质组中标记并富集目标作用蛋白,从与甜菊醇骨架结合的蛋白中筛选具有特定催化活性的糖基转移酶[15-16].同时他们还基于非模式植物的转录组数据构建了蛋白质组数据库,从而依托成熟的质谱技术解析蛋白质序列,高通量获取甜菊糖苷生物合成途径中的多种转糖酶元件.该研究发现,甜叶菊来源的UGT73E1、UGT76G3和拟南芥来源的UGT73C1等糖基转移酶可以作为潜在的生物合成元件获得新颖的代谢产物.进一步利用光亲和探针标记技术,他们还成功解析了各转糖酶的底物结合位点,结合分子对接模拟计算对二萜化合物的糖基转移酶的底物专一性识别机制进行了解析.同时基于分子探针的设计,通过先活性反应对代谢合成物富集然后解离代谢组分析的策略获得关键代谢相关信息.以上两方面相关功能蛋白酶和代谢物的解析信息实现了合成途径的成功绘制(如图5所示).

图5 分子探针技术应用于甜菊糖苷代谢物解析和转糖酶元件的筛选[15-16]
尽管从概念上实现了基于化学蛋白质组学挖掘天然产物生物合成途径转糖酶元件这一设想并在甜叶菊和拟南芥等高等植物体系获得一定成功,该策略仍然存在一定缺陷:首先,基于糖基受体底物,即甜菊醇(Steviol)衍生的含有报告基团(炔基)和光亲和基团(偶氮丙啶)的“全功能探针”ST-Dayne的选择性较差,富集大量非转糖酶蛋白;其次,衍生化引起探针结构改变,无法完整覆盖甜菊糖苷的合成途径;再次,无法通过组学结果确认转糖酶及其对应的酶反应底物和产物,活性表征完全依赖于后期异源表达和生化验证,甚至需要通过大量正交实验进行筛查.为解决以上问题,Wong等开发了一种双分子探针策略,基于转糖酶的催化活性原位合成探针[17].具体而言,在糖基受体分子上衍生报告基团(炔基,alkyne)块;在糖基供体(UDP-glucose)分子上衍生光亲和模块(diazirine),这两个模块分别使用时均无法通过化学蛋白质组学方法富集蛋白.但是,在特异性转糖酶的催化下,这两个模块“合二为一”,生成同时含有报告基团和光亲和基团的产物“全功能探针”,并在紫外激发下在原位特异性标记催化其生成的转糖酶,最后通过传统的化学蛋白质组学方法鉴定该转糖酶.利用该方法,研究人员不仅成功验证了前期鉴定功能的UGT85C2,UGT73C1,UGT91D2等转糖酶,还在拟南芥中发现一个转糖酶UGT73C5可同时催化甜菊醇C13-羟基和C19-羧基的糖基化,为由甜菊醇一步合成甜茶素提供了全新的转糖酶元件(如图6所示).
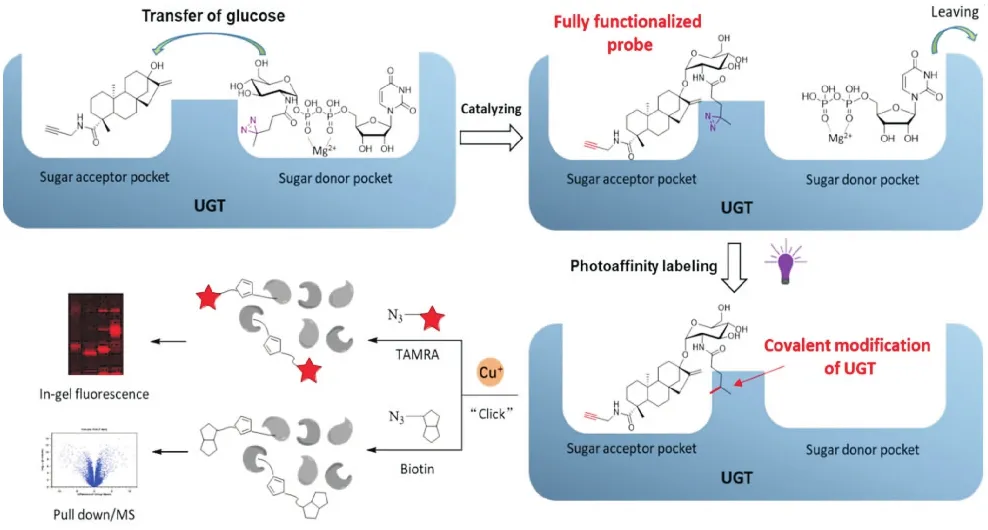
图6 双分子探针策略应用于甜菊糖苷转糖酶元件的筛选[17]
3 结 论
化学蛋白质组学技术利用小分子探针,在复杂的细胞或组织的蛋白质组样品中直接监测和读取靶标蛋白的活性和结构状态,并通过探针上的报告基团将被标记的靶标蛋白富集出来,利用在生物大分子质谱上加以检测和分析,这一创新性技术极大地加速了蛋白质功能的研究.传统的天然产物生物合成途径解析策略旨在基因/转录组和代谢组之间建立直接联系(如图6所示).随着高分辨蛋白质谱技术的发展,越来越多的研究人员开始聚焦基因/转录组与代谢组之前的重要桥梁-蛋白质组(如图7所示).
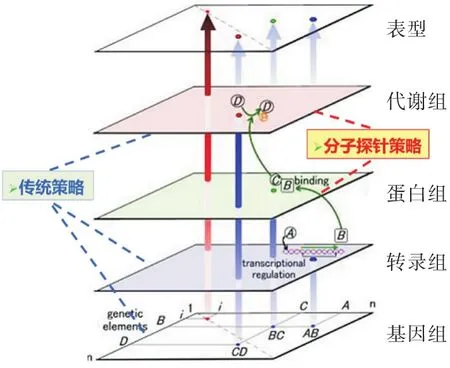
图7 传统基因组策略和基于分子探针的化学蛋白质组学策略研究天然产物生物合成途径(代谢酶)
近10年来,化学蛋白质组学技术在天然产物生物合成途径解析领域取得了一定进展,但还存在以下几个缺陷:1)蛋白质组学发展至今,仍依赖基因组或转录组数据进行比对,从头测序技术尚不成熟,限制了其在非模式植物的进一步应用;2)分子探针的构建可能对天然产物-代谢酶结合造成影响;3)植物和某些微生物中含有大量次级代谢产物,难以获取高质量活性蛋白.以上缺陷仍需在未来的研究中不断改进和克服.
