基于UHPLC-HRMS探讨水杨梅根水提物对大鼠血浆代谢物的影响
2022-06-09陈欣欣黄彩莹仇雯霞谢雪焜李定桦
陈欣欣,黄彩莹,仇雯霞,谢雪焜,李定桦,陈 闯*
(1.广西医科大学附属肿瘤医院,广西 南宁 530021;2.广西医科大学第一附属医院,广西 南宁 530021)
茜草科植物水杨梅(AdinarubellaHance)是我国一种传统民间用药,又称水杨柳、水泡木、小叶水团花、串鱼木等,主要分布于江苏、浙江、福建、广东和广西等地。水杨梅的根和地上部位均可作为药用部位,其味苦、辛,性凉,具有清热解表、活血解毒的功效,主要用于湿热泄泻、疮疖肿毒等[1]。现代药理研究表明,水杨梅根提取物能抑制人肝癌Bel7402细胞[2]、人直肠癌LS174T细胞[3]、小鼠L651白血病细胞和子宫颈癌细胞[4]的增殖。此外,研究发现在实验质量浓度范围内,水杨梅的各萃取部位(石油醚、醋酸乙酯和正丁醇),以及水杨梅石油醚萃取部位分离得到的甾体化合物,对金黄色葡萄球菌、藤黄微球菌、铜绿假单胞杆菌和枯草芽胞杆菌有一定的抑菌活性,且对革兰阳性菌的抑制作用强于革兰阴性菌[5]。而目前研究多关注水杨梅根的化学成分[6-8]和体外生物活性,对体内代谢组学研究较少。液相色谱-质谱联用仪(LC-MS)以LC对化合物进行分离、MS进行定性分析,是一种简单、灵敏、快速的分析方法,已被广泛应用于血清药物化学分析和体内代谢研究等领域[9-13]。本研究基于UHPLC-Q-Exactive 轨道阱高分辨质谱技术,从血浆代谢组学角度探讨水杨梅根水提物对大鼠体内血浆代谢物的影响,为水杨梅根的药效物质研究提供参考。
1 材料与方法
1.1 材料
1.1.1 试剂 水杨梅根药材购于广西仙茱中药科技有限公司,经广西仙茱中药科技有限公司黎秀按《广东省中药材标准(第一册)》(2004年版)[14]鉴定为茜草科植物细叶水团花AdinarubellaHance 的干燥根,产地为广东。质谱级甲醇(Methanol)、乙腈(Acetonitrile)、甲酸(Formic acid)均为CNW Technologies 公司产品。L-2-氯苯丙氨酸(2-Chloro-L-phenylalanine)纯度≥98%,购自上海恒柏生物科技有限公司。分析用水为Merck Millipore 纯水,其余试剂均为分析纯。
1.1.2 仪器 1290 UHPL型超高效液相色谱仪(美国Agilent公司);Q Exactive Focus 型高分辨质谱仪(美国Thermo Fisher Scientific公司);ACQUITY UPLC BEH C181.7 μm 2.1×100 mm型色谱柱(美国Waters公司);Heraeus Fresco17 型离心机(美国Thermo Fisher Scientific公司);BSA124S-CW型天平(德国Sartorius);JXFSTPRP-24 型研磨仪(上海净信科技有限公司);YM-080S 型超声仪(深圳市方奥微电子有限公司);热恒温鼓风干燥箱(上海一恒科技有限公司)。
1.1.3 动物 Sprague Dawley (SD)大鼠18只,体质量(150±10) g,购于广西医科大学(广西实验动物中心),生产许可证号:SCXK桂2014-0002,使用许可证号:SCXK桂2014-0003。大鼠饲养于广西医科大学动物房(普通级):12 h昼夜循环,具有空调设备,室温恒定在26 ℃,湿度55%~65%,自由饮食饮水,实验前适应性饲养7 d。
1.2 方法
1.2.1 水杨梅根干膏制备 取5 000 g水杨梅根药材(饮片),分两次煎煮。第1次加10倍量的水,先浸泡0.5 h,加热煎煮1.5 h,第2次加水8倍量,煎煮1 h,煎液过滤,合并两次提取液,滤液浓缩成稠膏后置于鼓风干燥箱(75 ℃)72 h,即得到干浸膏约409.5 g,出膏率为8.19%,置于玻璃干燥皿中备用。
1.2.2 给药与样品采集 SD大鼠随机分为空白组、水杨梅根水提物给药组,每组9只,两组大鼠给药前禁食12 h(可自由饮水)。《中华本草》[15]记载水杨梅根的人体最大用量为每天30 g,根据大鼠与人的体表面积换算率(6.3)及水杨梅根出膏率(8.19%),计算大鼠日剂量为15.48 g/kg(干膏量)。将“1.2.1”所制的干膏溶解于纯水中,配成1.548 g/mL水杨梅根水提物溶液灌胃给予大鼠,1次/d,连续给药3 d,空白组灌服纯水。末次给药2 h后异氟醚麻醉,腹主动脉取血置于5 mL含肝素钠采血管中,3 000 rpm室温离心10 min,取上清,0.5 mL/管分装至1.5 mL离心管中,-80 ℃冻存,备用。
1.2.3 生物样本处理 取400 μL血清样本,加入40 μL盐酸(2 mol/L);4 ℃ 涡旋1 min后静置15 min;重复涡旋静置4次后,加入1.6 mL乙腈沉淀蛋白;涡旋5 min,12 000 rpm[离心力13 800(×g),半径8.6 cm]离心5 min,取上清1 800 μL氮吹干燥;加入150 μL 80%甲醇(内标L-2-氯苯丙氨酸浓度为10 μg/mL)复溶,涡旋5 min,12 000 rpm[离心力13 800(×g),半径8.6 cm]离心5 min;取上清至进样瓶中上机检测。
1.2.4 上机检测条件 色谱条件:色谱柱UPLC BEH C18(1.7 μm;2.1 mm×100 mm);柱温为55 ℃;流动相:A为水(含0.1%甲酸);B为乙腈(含0.1%甲酸);梯度洗脱条件:0~11 min,85~25%A;11~12 min,25~2%A;12~14 min,2~2%A;14~14.1 min,2~85%A;14.1~15 min,85~85%A;15~16 min,85~85%A;流速 500 μL/min;进样量5 μL。
质谱条件:利用软件(Xcalibur,Thermo Fisher Scientific)控制Q Exactive Focus 质谱仪,基于FullScan-ddMS2功能进行一级、二级质谱数据采集。详细参数如下:鞘气流速:45 arb,辅助气流速:15 arb,毛细管温度:400 ℃,分辨率(full scan):70 000,分辨率(MS/MS scans):17 500,碰撞能量:NCE 模式下的15/30/45,喷雾电压:4.0 kV(正离子模式)或-3.6 kV(负离子模式)。
1.2.5 统计学处理 将获得的正负离子模式下的原始数据导入XCMS软件进行保留时间矫正、峰识别、峰提取、峰积分、峰对齐等工作。数据预处理方式如下[16]:基于相对标准偏差(RSD,即变异系数Coefficient of variation,CV)对偏离值进行过滤,只保留单组空值不多于50%或所有组中空值不多于50%的峰面积数据,然后对原始数据中的缺失值进行模拟(Missing value recoding),数值模拟方法为最小值二分之一进行填补。利用上海百趣生物医学科技有限公司提供的二级质谱数据库及相应裂解规律匹配法对含有MSMS数据的峰进行物质鉴定。使用SIMCA软件(V16.0.2,Sartorius Stedim Data Analytics AB,Umea,Sweden),对数据进行对数(LOG)转换及CTR(Center scaling)格式化处理,然后进行无监督的PCA分析。将数据进行UV (Unit variance scaling)格式化处理,对第一主成分进行OPLS-DA建模分析,模型的质量用7折交叉验证(7-fold cross validation)进行检验;然后用交叉验证后得到的R2Y(模型对分类变量Y的可解释性)和Q2(模型的可预测性)对模型有效性进行评判;最后通过置换检验(Permutation test),随机多次改变分类变量Y的排列顺序得到不同的随机Q值,对模型有效性做进一步检验。采用以下条件进行差异代谢物筛选:学生t检验(Student’st-test)的P值(P-value)<0.05,同时OPLS-DA模型第一主成分的变量投影重要度(Variable importance in the projection,VIP)>1。使用omicshare.com/tools(https://www.omicshare.com/tools/)在线数据分析平台将正负离子模式下的差异代谢物可视化。利用MetaboAnalyst 5.0(https://www.metaboanalyst.ca/)在线数据库获取差异代谢物的KEGG ID号并进行差异代谢通路分析。
2 结果
2.1 基于 UHPLC-Q-Exactive MS的大鼠血浆代谢组学质量控制
从18个样本中各取等量血浆充分混合后得到质控(Quality control,QC)样本。使用该QC样品进行过程质控和数据质控。在正负离子模式下,QC样品总离子流色谱图(Total ion chromatorgraphy,TIC)色谱峰保留时间和信号强度均重叠较好(见图1)。在正离子模式下,内标响应稳定性的RSD为8.36%,在负离子模式下,内标响应稳定性的RSD为3.45%(见表1),均小于20%。上述结果说明样品处理方法和检测系统稳定性均满足代谢组学研究要求,本次实验数据质量可靠。
注:A.所有QC样品正离子TIC;B.所有QC样品负离子TIC。

表1 QC样品中内标响应稳定性
2.2 数据处理
正离子模式的原始数据包含33 291个Peak,经数据预处理后,19 064个Peak被保留。同理,负离子模式的原始数据包含26 444个Peak,经数据预处理后13 338个Peak被保留。利用上海百趣生物医学科技有限公司提供的二级质谱数据库对所有代谢物进行物质信息搜索整理,正离子模式下鉴定出187个化合物,负离子模式下鉴定出116个化合物。正负离子模式下,空白组和给药组数据矩阵经无监督的PCA分析结果显示(见图2),两组血浆样本代谢轮廓可呈现出分离趋势。后续的OPLS-DA分析显示(见图3),两组样本区分非常显著。且所建立的OPLS-DA模型在正离子模式下R2Y=0.986,Q2=0.628;在负离子模式下R2Y=0.992,Q2=0.677,均表明其稳健可靠。随后进行的200轮置换检验显示(见图3),原模型R2Y非常接近1,说明建立的模型符合样本数据的真实情况;原模型Q2比较接近1,说明如果有新样本加入模型,可得到比较近似的分布情况,总体看,原模型可较好解释两组样本之间的差异。置换检验随机模型的Q2值均<原模型的Q2值;Q2的回归线与纵轴的截距<0;且随着置换保留度逐渐降低,置换的Y变量比例增大,随机模型的Q2逐渐下降,说明原模型具有良好的稳健性,不存在过拟合现象。

注:A.正离子模式 PCA 分析;B.负离子模式 PCA 分析。
2.3 生物标志物的筛选和代谢通路分析
通过筛选OPLS-DA模型中VIP>1且学生t检验P<0.05的变量,正离子模式下,筛选出29个差异代谢物(见图4A),其中10-acetyloxy-8,8-dimethyl-2-oxo-9,10-dihydropyrano[2,3-f]chromen-9-yl) (Z)-2-methylbut-2-enoate(白花前胡素A)等17个代谢物上调,Totarol(桃柁酚)等12个代谢物下调;负离子模式下筛选出17个差异代谢物,其中5-Ethoxy-10-gingerol(5-乙氧基-10-姜酚)等10个化合物上调,16-Hydroxyhexadecanoic acid等7个化合物下调(见图4B)。将正负离子模式下的差异代谢物合并为一个数据矩阵,其中16个化合物被KEGG数据库收录(见表2 )。使用MetaboAnalyst 5.0在线数据库对差异代谢物进行通路富集分析和拓扑分析,筛选潜在的靶标通路(Pathway impact≥0.10)[17]。结果见图5,横坐标Pathway impact的值越大,代谢通路越重要;纵坐标-log10(P)的值越大,代谢通路富集分析的显著性越好。代谢通路分析显示,水杨梅根可影响到脂肪酸生物合成、色氨酸代谢、不饱和脂肪酸的生物合成和花生四烯酸代谢4条通路。

注:A.正离子模式 OPLS-DA 分析;B.负离子模式 OPLS-DA 分析;C.正离子模式下 200 轮置换检验结果;D.负离子模式下200 轮置换检验结果。

注:A.正离子模式下的差异代谢物热图;B.负离子模式下的差异代谢物热图;不同位置的色块代表对应位置代谢物的相对表达量。
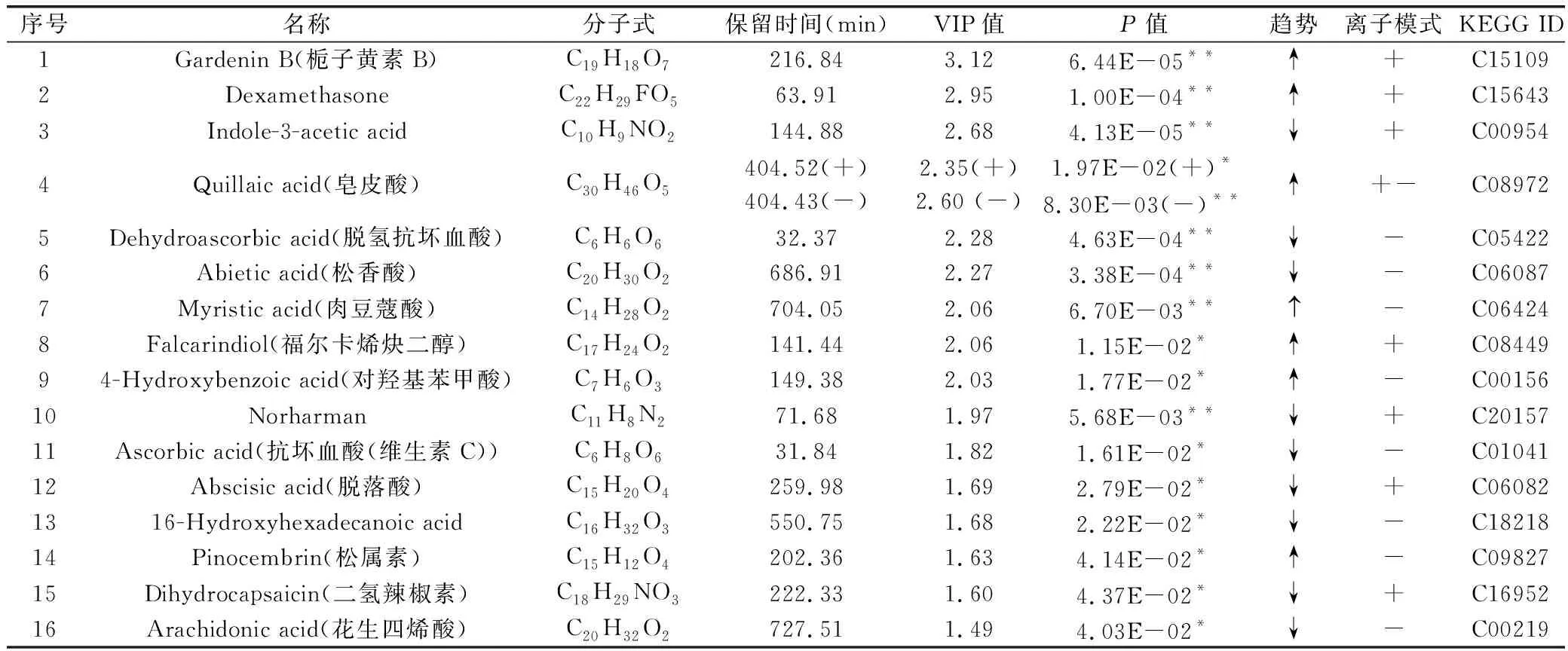
表2 差异代谢物中被KEGG收录的化合物
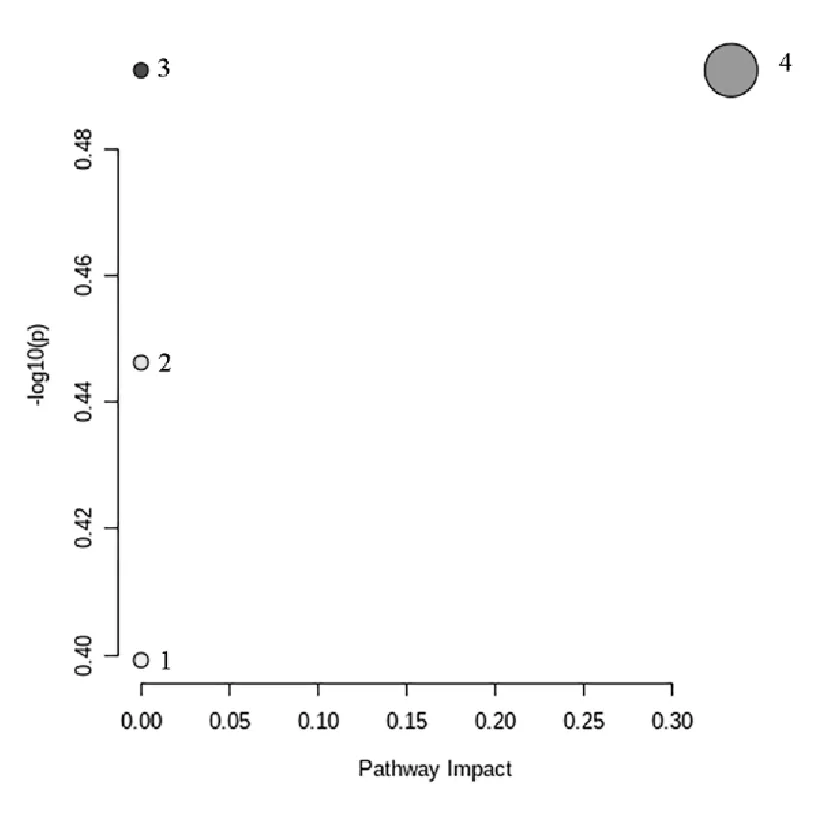
注:1.Fatty acid biosynthesis(脂肪酸生物合成);2.Tryptophan metabolism(色氨酸代谢);3.Biosynthesis of unsaturated fatty acids(不饱和脂肪酸的生物合成);4.Arachidonic acid metabolism(花生四烯酸代谢)。
3 讨论
单味中药是中医药防治疾病的基础,对单味中药的研究不仅关乎临床疗效,也为中药的合理应用提供依据。本研究基于UHPLC-Q-Exactive MS技术,对水杨梅根进行了非靶向血浆代谢组学分析。在正负离子模式下,给药组大鼠血浆对比空白对照组大鼠血浆共筛选鉴定出45种差异代谢物,花生四烯酸代谢通路影响值为0.333,其余3条通路的通路影响值为0。因此,笔者认为水杨梅根可通过影响花生四烯酸代谢而发挥作用。
水杨梅根治疗疮疖肿毒是其重要的临床应用之一。本研究发现,水杨梅根可下调血浆中的花生四烯酸水平。花生四烯酸(AA)是二十碳不饱和脂肪酸,当细胞受刺激后,细胞膜的磷脂酶(PLA)被激活,进而裂解膜磷脂,游离出花生四烯酸,后者通过环加氧酶和脂质加氧酶作用生成前列腺素(PG)、血栓素 A2(TXA2)和白三烯(LT)等炎性介质,从而导致局部和全身的炎症反应发生[18]。因此,笔者认为水杨梅根下调血浆中的花生四烯酸水平与其抗炎作用相关,这为今后通过干预大鼠疮疡模型,探讨水杨梅根是否能回调模型动物的炎症相关代谢物水平提供了参考依据。
临床上,水杨梅根常配伍藤梨根及虎杖根辨证治疗消化道恶性肿瘤,疗效确切[6,19]。张蓓等[20]用水杨梅总黄酮对S180荷瘤小鼠进行灌胃,证实了水杨梅总黄酮可提高其免疫功能,抑制肿瘤生长,且安全性好。叶勇等[3]用不同浓度的水杨梅根提取物处理人直肠癌LS174T细胞发现,药物抗癌作用表现为剂量依赖性,且乙酸乙酯提取部位是最主要的活性部位。此外,王成功等[2]发现水杨梅根乙酸乙酯提取物可体外抑制人肝癌Bel7402细胞增殖,其机制可能与p53基因表达上调、survivin表达下调而促进Bel7402细胞凋亡有关。研究证明,生理性血小板受体和血小板激动剂在癌症转移及血管生成中起重要作用。血小板提供促凝表面,促进恶性肿瘤相关凝血功能,且可被募集以覆盖肿瘤细胞,从而保护它们免受免疫反应的影响,并促进癌症的生长和传播[21],表明抗血小板聚集可能是肿瘤治疗的新策略。方晴霞等[22]发现水杨梅根黄酮类成分(ARF)能抑制5'-二磷酸腺苷(ADP)、血小板活化因子(PAF)及AA所诱导的血小板聚集,且随ARF剂量的增加,对血小板的聚集抑制率显著上调。TXA2可降低血小板内环磷酸腺苷(cAMP)浓度,对血小板的聚集有正反馈促进作用[23]。本研究发现水杨梅根能降低血浆中AA水平,提示其可能通过影响TXA2,从而抑制血小板聚集发挥抗癌作用。
本研究初步阐明了水杨梅根对大鼠血浆代谢物的影响,从代谢组学角度为草药水杨梅根的药效物质研究提供了一定依据。但笔者发现鉴定出的化合物部分未被KEGG注释,因而基于KEGG数据库代谢通路分析所得到的信息有限,这导致一些潜在且有价值的差异代谢物作用机制未被阐明,今后还需结合其他药理学方法进行机制探索。
