重组毕赤酵母表达棘孢木霉几丁质酶gene02524的酶学性质及抑菌活性
2022-06-09尹义旭汤伟咸洪泉
尹义旭 汤伟 咸洪泉






摘要:几丁质酶是催化降解几丁质的水解酶,在防治植物真菌病害与虫害方面的应用越来越广泛,是一种重要的生防蛋白。棘孢木霉TD3104是一株优良的植物病害生防菌,几丁质酶在抑菌防病过程中发挥重要作用。为克隆表达棘孢木霉TD3104几丁质酶基因gene02514,明确酶学性质和抑菌活性,利用毕赤酵母表达系统对目的蛋白进行表达,并通过SephadexG-100凝胶进行纯化,对序列进行分析并研究其酶学性质及进行体外抑菌试验。本研究成功地构建了pPIC9K/gene02524重组载体,并且经过比对发现其包含GH18家族的特征氨基酸序列,获得了毕赤酵母转几丁质酶基因工程菌,表达的重组几丁质酶表观分子量44.4 ku,K m=2.048 2 g/L,V max=0.635 5×103 μmol/(L·min),最适反应温度为50 ℃,最适pH值为5.0,在pH值为3.5时稳定性最高;金属离子Cu2+、Hg2+可强烈抑制酶活性;可抑制金黄壳囊孢菌等病原真菌的生长。研究结果为解析棘孢木霉几丁质酶在生防中的作用及功能奠定了基础,并为植物病虫害的防治提供了新的基因资源。
关键词:棘孢木霉;几丁质酶;基因表达;毕赤酵母;酶学性质
中图分类号:S188+.3 文献标志码: A
文章编号:1002-1302(2022)09-0096-07
植物真菌病害被认为是对作物产量影响最严重的因素[1],会造成严重的经济损失[2]。目前对植物真菌病害的防治普遍采用化学防治,这不仅会污染环境、破坏生态平衡,而且病原菌易产生抗药性[3],也可能会影响人的健康[4]。随着人们环保意识以及个人保护意识的增强,生物防治由于其低成本、环境友好等特点逐渐成为防治病害时首先考虑的方法。
用于植物病害防治的生物因子主要包括细菌、真菌、放线菌,目前在生防真菌中木霉菌是应用比较广泛的一类生防菌[5]。木霉菌对多种植物病害均有防治效果,并且对土壤生态平衡的影响最小,不会损害有助于控制病原体的有益生物体,可以提高植物抗病性,促进养分吸收和肥料利用,改善发育环境并提高产量[1]。几丁质酶在木霉菌防治植物病害过程中发挥着重要作用。
几丁质酶(chitinase,EC 3.3.2.14)是以几丁质为底物,通过催化降解β-1-4-糖苷键将几丁质(chitin)降解为N-乙酰氨基葡萄糖或寡聚N-乙酰氨基葡萄糖的水解酶[6-7],在自然界中发挥着重要的作用。植物病原真菌的细胞壁主要由葡聚糖和几丁质等物质组成[8],生防木霉菌会产生几丁质酶及葡聚糖酶等细胞壁降解酶[8-9],对病原菌的细胞壁进行破坏,从而达到抑制病原真菌的效果,并且幾丁质酶在杀虫剂的应用中也有良好的前景[10-11]。通过基因工程将几丁质酶基因转化到生防菌株或植物中,可以使生防菌生防效果增强或提高植物对病原菌的抗病性[12-13]。
棘孢木霉(Trichoderma asperellum)TD3104是一株优良的生防菌株,全基因组测序分析发现,该菌株有数十种几丁质代谢相关的基因,其中有15个内切几丁质酶基因。由于不同的几丁质酶在生物中发挥着不同的作用,为了之后可以更好地了解几丁质酶系统在木霉中所发挥的作用,尤其是在抑制病原菌方面的作用,本研究以内切几丁质酶基因gene02524为研究对象,利用巴斯德毕赤酵母(Pichia pastoris)表达系统进行异源表达、分离纯化,分析其酶学性质,检测其对病原真菌生长的影响,为解析几丁质酶系统中不同组分在生防中的作用奠定基础。
1 材料与方法
本试验于2020—2021年在青岛农业大学完成。
1.1 试验材料
1.1.1 试验菌株
棘孢木霉TD3104、大肠杆菌(Escherichia coli)DH5α、毕赤酵母GS115、苹果轮纹病菌(Botryosphaeria dothidea)、新月弯孢菌(Curvularia lunata)、金黄壳囊孢菌(Cytospora chrysosperma)、板栗疫病病原菌(Cryphonectria parasitica)均为笔者所在实验室保存。
1.1.2 试剂
本试验所需的Trizol、G418 antibiotic均购自Invitrogen 公司;EcoRⅠ与NotⅠ、StuⅠ均购自赛默飞世尔科技公司;pMD18-T vector、T 4连接酶、DNA Marker、RT-PCR试剂盒均购自TaKaRa公司;几丁质、质粒提取试剂盒、胶回收试剂盒均购自生工生物工程(上海)股份有限公司。各类培养基参照Invitrogen 公司的毕赤酵母表达说明书配制。PCR引物合成与序列测序均由北京擎科生物科技有限公司完成,全基因组测序由上海美吉生物医药科技有限公司于2020年2月完成。
1.2 目的序列的分析及重组载体的构建
Trizol法提总RNA之后反转录得到cDNA文库,根据全基因组测序和注释分析得到gene02524序列(图1),根据序列设计扩增gene02524几丁质酶CDS的特异性引物02524S:5′-CCGAATTCTCTGAGGGCGGTTATCGCT-3′;02524A:5′-GGGCGGCCGCTTAGTTATTTGGGAATCCATTCTT-3′。以cDNA文库为模板,利用设计的特异性引物进行扩增,胶回收PCR产物,与T载体连接转化DH5α感受态细胞,筛选测序得阳性克隆,提取质粒用EcoRⅠ和 NotⅠ 酶切,将回收后的目的片段,与酶切后的酵母表达载体pPIC9K通过T 4 DNA连接酶,16 ℃过夜连接得到重组载体pPIC9K/gene02524,并进行双酶切验证。将正确的质粒通过StuⅠ线性化后转入毕赤酵母GS115。酵母感受态的制备、转化及筛选等操作参考Invitrogen 公司的酵母表达说明书进行。DNAMAN(https://www.lynnon.com/dnaman.html)和WebLogo(http://weblogo.berkeley.edu/logo.cgi)用来进行氨基酸的比对。
1.3 几丁质酶的诱导表达及分离纯化
几丁质酶的诱导表达、分离纯化及酶活力测定参照汤伟等对几丁质酶Tachi1酶学性质研究的方法[14]。具体为:将重组表达gene02524工程株在 28 ℃、200 r/min条件下振荡培养,每天加入甲醇诱导,维持甲醇终浓度为0.5%,并每天通过DNS法对酶活性进行检测,3组重复。待酶活性稳定之后取菌液上清,将上清液使用硫酸铵沉淀获得蛋白,透析除盐后通过SephadexG-100凝胶纯化。
1.4 几丁质酶的酶学性质分析
1.4.1 几丁质酶的最适温度及温度稳定性测定 分别在30~80 ℃温度条件下测定表达的几丁质酶gene02524的活性,将最高的酶活性定为100%,分别计算其余处理组的酶活性。并将纯化后的酶液分别在35、40、45 ℃ 温度下孵育一段时间(10、20、30、40、50、60 min),以最高的酶活性为100%,检测酶活性。
1.4.2 最适pH值及pH值稳定性的测定 将表达的几丁质酶液在不同pH值(3.0~10.0)条件下反应并测定其酶活性,将最高的酶活性定为100%,测定其余处理的酶活力。pH值稳定性则是将酶液置于最适温度下于pH值为3.0~10.0体系中孵育 1 h,以最高的酶活性为100%,检测其余处理的酶活性。不同的pH值由表1缓冲体系提供。
1.4.3 几丁质酶gene02524米氏常数及酶促反应进程曲线的测定 酶促进程曲线为在最适环境中进行酶促反应,利用DNS法每隔10 min进行取样并测定还原糖产量。将底物稀释至终浓度分别为25、20、10、5、2.5 mg/mL,在最适条件下进行酶促反应,计算各处理的反应速度,做出Hans-Woolf曲线,得出米氏常数K m与V max。
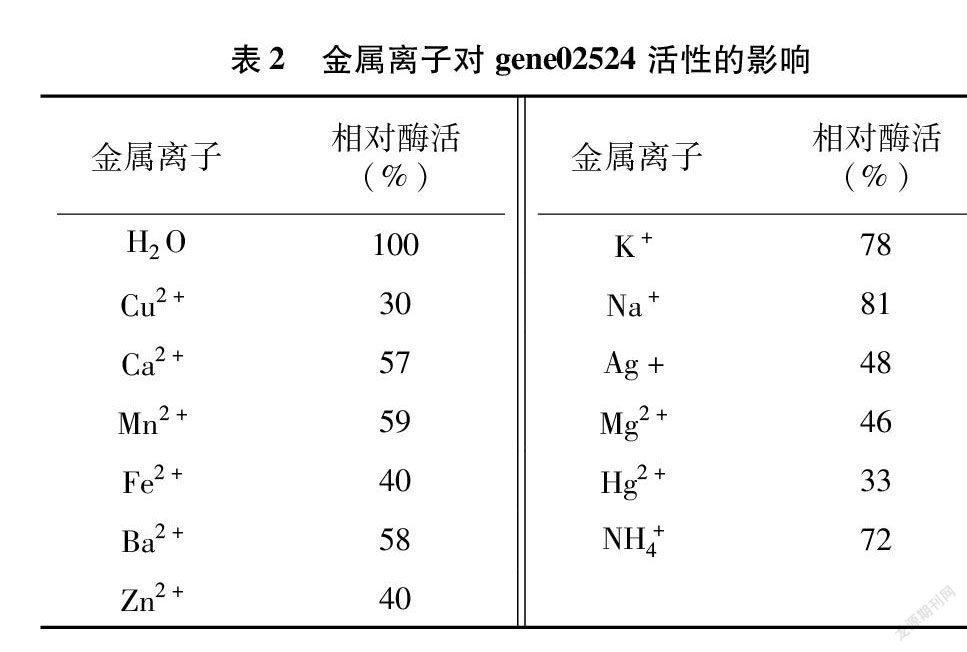
1.4.4 测定反应体系中金属离子对酶活性的影响 在酶反应体系中分别加入金属离子(Cu2+、Ca2+、Mn2+、Fe2+、Hg2+、Zn2+、Ag+、K+、Na+、Mg2+、NH+ 4、Ba2+),使其终浓度为0.05 mol/L,测定不同处理组的几丁质酶gene02524活性。将加水处理组的酶活性定义为100%,计算其余处理的相对酶活性。
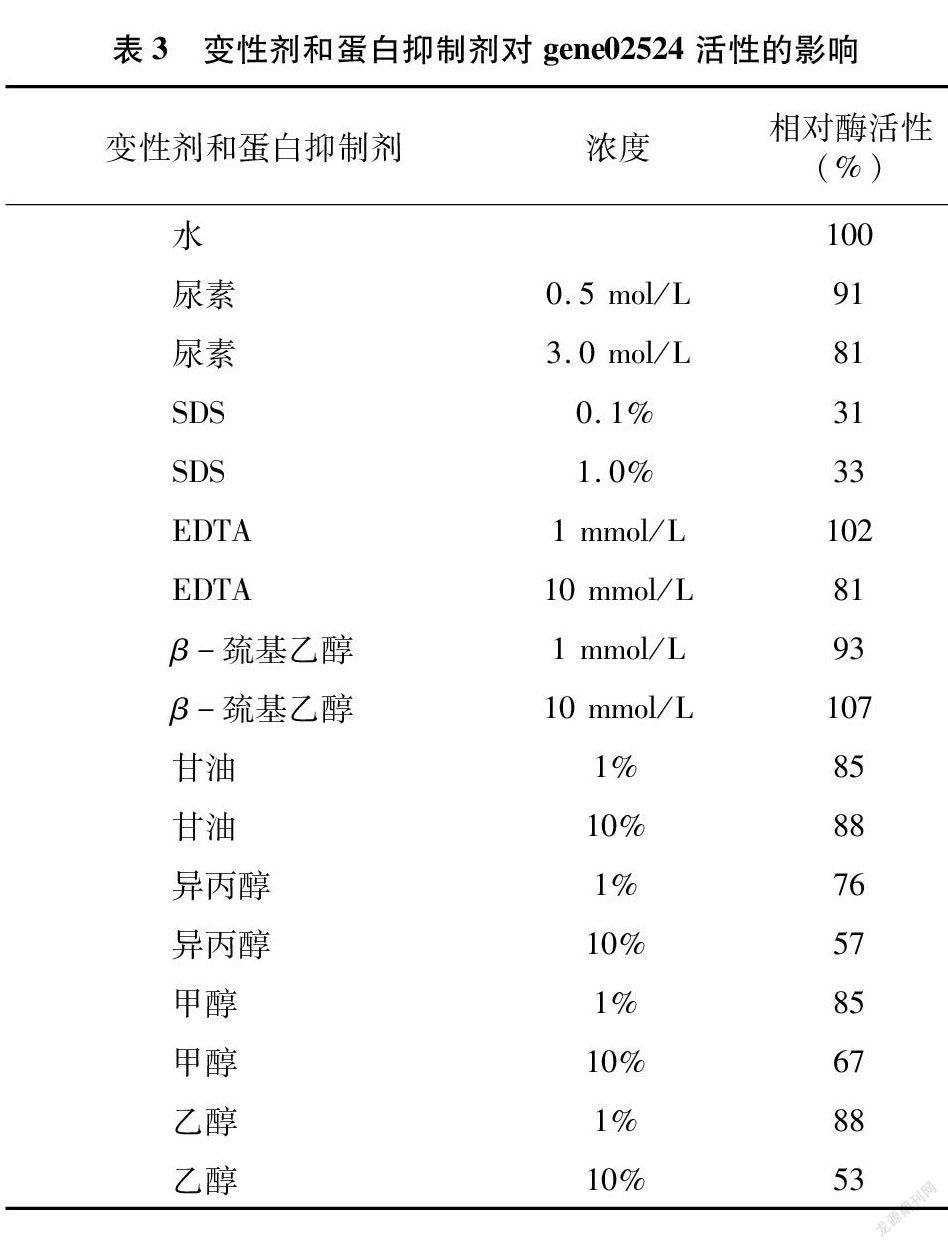
1.4.5 变性剂和蛋白抑制剂对酶活性的影响 在最适条件下,分别在体系中配入供试的变性剂和蛋白抑制剂,使尿素终浓度分别为0.5、3.0 mol/L,十二烷基硫酸钠(SDS)终浓度分别为0.1%、1.0%,乙二胺四乙酸(EDTA)与β-巯基乙醇终浓度为1、10 mmol/L,甘油、异丙醇、甲醇、乙醇的终浓度则分别设置1%和10% 2个浓度处理,将加入水的处理组的酶活性定义为100%,测定其余酶活。
1.5 几丁质酶gene02524对病原真菌的抑制作用
将供试真菌接种于马铃薯琼脂葡萄糖(PDA)板上,置于28 ℃培养箱中,待其长满板后取菌块于新的PDA平板中央,当菌落生长至3~4 cm时,在距菌落中心5 cm处放置4个无菌滤纸片,分别加入不同量(3、5、7 μg)的酶,继续培养。以加灭菌水的处理为对照,参考下式计算抑菌率:
病原菌生长抑制率=(对照菌落半径-处理菌落半径)/对照菌落半径×100%。
2 结果与分析
2.1 pPIC9K/gene02524重组质粒构建及序列分析
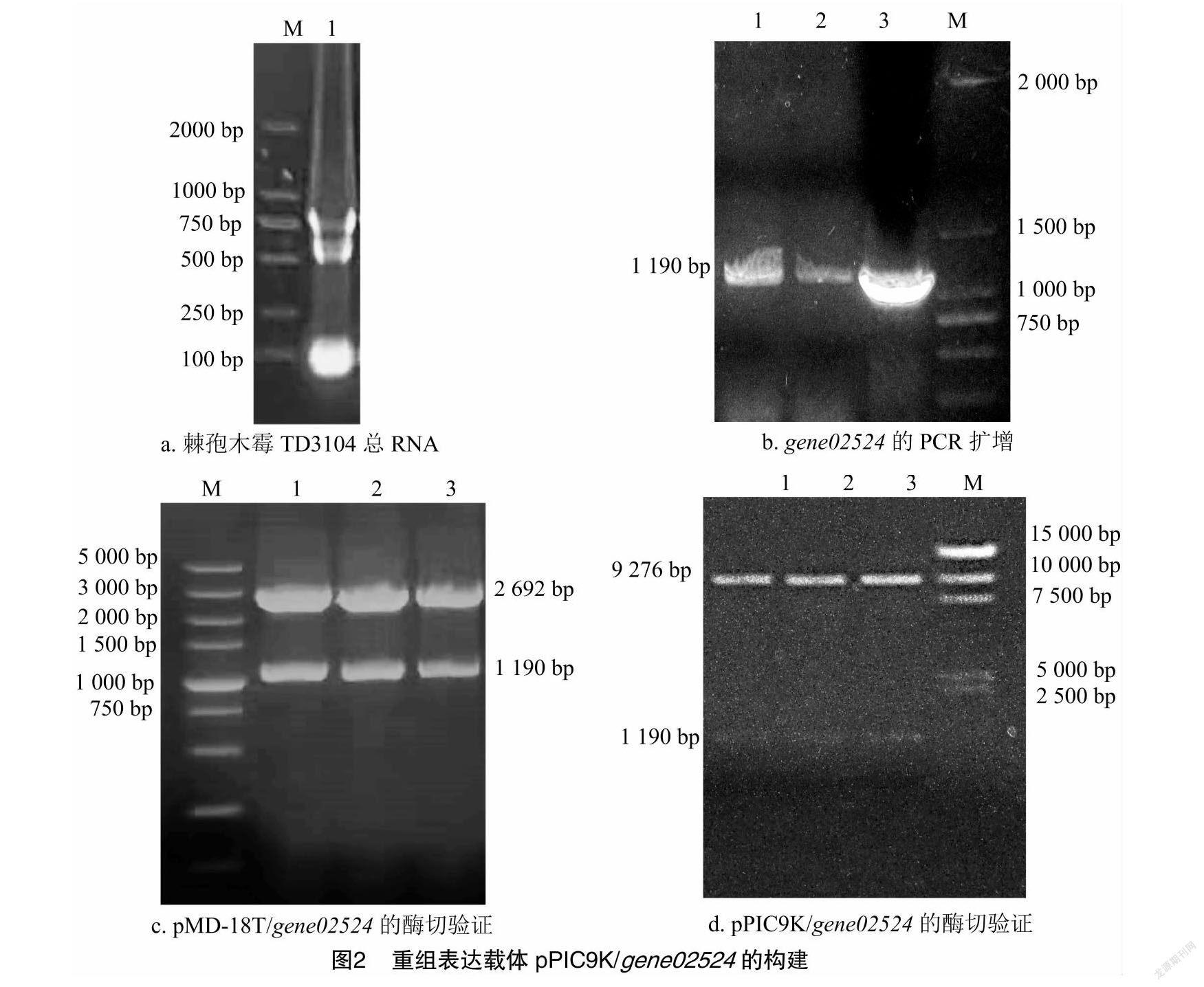
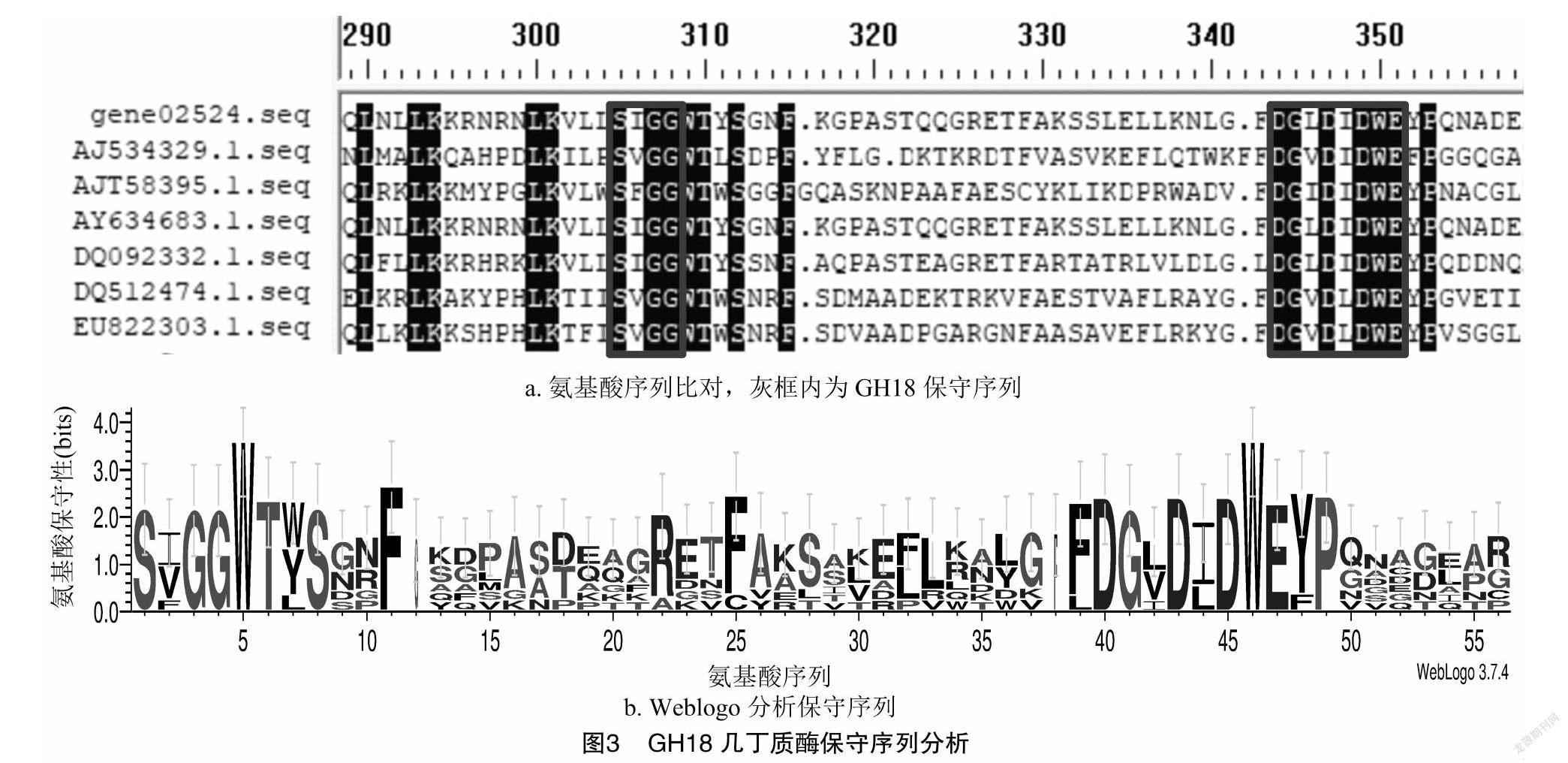
提取几丁质诱导的棘孢木霉TD3104菌丝中的总RNA(图2-a),以反转录得到的cDNA文库为模板,02524S和02524A为引物,扩增得到gene02524基因编码序列全长1 190 bp(图2-b),经测序和序列比对,克隆的CDS序列正确。gene02524几丁质酶基因含有2个内含子,大小分别为74、66 bp,编码397个氨基酸,预测表达蛋白大小44.48 ku,理论等电点为5.67。将氨基酸序列与GH18家族的几丁质酶比对,发现其包含GH18家族特征的序列SXGG及DXXDXDXE[15](图3-a、图3-b)。构建的克隆载体和酵母重组表达载体分别命名为pMD-18T/gene02524和pPIC9K/gene02524,酶切鉴定结果与预期相符(图2-c、图2-d)。将pPIC9K/gene02524通过StuⅠ 线性化后转入毕赤酵母GS115,经筛选得到表达重组几丁质酶gene02524的酵母工程菌GS115/gene02524。
2.2 几丁质酶的诱导表达及纯化
诱导表达5 d之后酶活性趋于稳定(图4-a),粗酶液经SephadexG-100凝胶过滤层析纯化,经 SDS-PAGE 可以发现纯化后的蛋白在44.4 ku大小处有一条带(图4-b),表观分子量与预测大小一致。
2.3 几丁质酶gene02524的酶学性质
2.3.1 最适温度及温度稳定性测定 在不同温度下测定gene02524蛋白的酶活性,从图5-a可以看出,该几丁质酶的最适温度为50 ℃,80 ℃时仍有活性,30~55 ℃范围内具有50%以上活性,具有较宽的温度适用性。将gene02524酶蛋白置于不同的温度中孵育,并对其剩余酶活性进行检测,可以看到该几丁质酶在35 ℃以下活力基本没有损失,保温 60 min 后仍有超過80%的活力,在40 ℃与45 ℃下保温 60 min 后仍然可剩30%左右的酶活力(图5-b)。
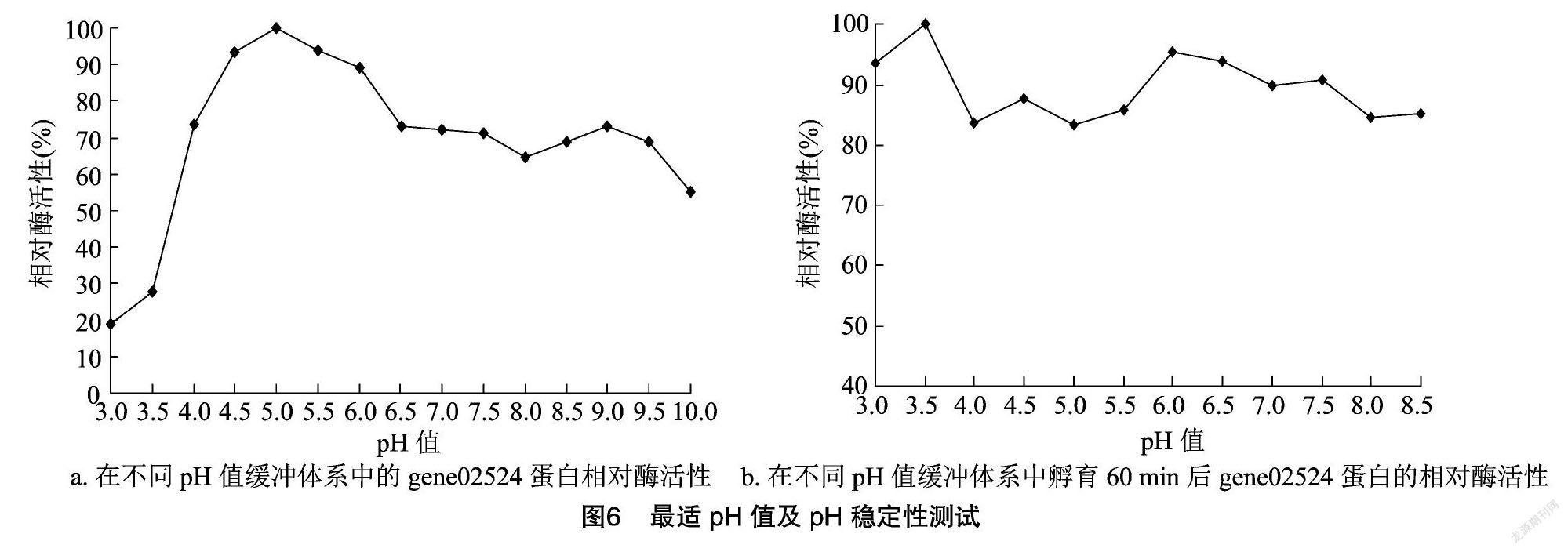
2.3.2 最适pH值及pH值稳定性 研究发现gene02524蛋白不仅具有非常广泛的pH值适用范围(图6-a),还拥有非常高的pH值稳定性(图6-b)。
在pH值4.0~10.0范围内均有较高的催化活性(剩余酶活>50%),最适pH值为5.0。在pH值为3.5时酶的稳定性最高,并且在pH值3.0~8.5范围内孵育60 min后仍均保有80%以上的酶活力。
2.3.3 酶促反應进程曲线及米氏常数的测定 gene02524重组几丁质酶的酶促反应在0~10 min内随着反应的进行还原糖产量不断增加,30 min后趋于稳定(图7-a)。取反应时间0~10 min作酶动力学Hans-Woolf曲线(图7-b),当胶体几丁质为底物时,几丁质酶gene02524的K m=2.048 2 g/L,V max=0.635 5×103 μmol/(L·min)。
2.3.4 金属离子对gene02524酶活性的影响 供试金属离子对gene02524酶活性有不同程度的抑制作用,研究发现Cu2+与Hg2+对酶活性抑制作用最强,剩余酶活性均只剩30%左右;而K+、Na+与NH+ 4则抑制酶活性较小,剩余酶活性均在70%以上;其他金属离子相对酶活性在40%~60%之间(表2)。
2.3.5 变性剂和蛋白抑制剂对酶活性的影响 gene02524重组几丁质酶对供试变性剂和蛋白抑制剂抵抗力较强,除SDS外其他试剂处理后酶活性均剩余50%以上;SDS对gene02524酶活性有明显的抑制作用;1 mmol/L EDTA与10 mmol/L β-巯基乙醇对酶活性有一定的促进作用(表3)。
2.4 几丁质酶gene02524对病原真菌的抑制作用
纯化后的几丁质酶gene02524对供试病原菌生长均有一定的抑制作用,并且存在一定的剂量效应。相同用量gene02524蛋白对金黄壳囊孢菌生长抑制作用最强,5 μg gene02524抑制率便能超过55%;3 μg gene02524对新月弯孢菌的抑菌率为15.56%,当酶量达到7 μg时,抑菌率增加到40.00%(表4)。
3 讨论
微生物几丁质酶的分子量一般在20~90 ku之间,胡仕凤等统计了8种木霉的39个几丁质酶,发现木霉几丁质酶多为内切酶,并且大多数分子量为42 ku[16]。Lorito等研究发现,木霉几丁质酶是对植物病原真菌非常有效的几丁质酶,不仅能够降解病原菌的菌丝,也对有几丁质复合结构的细胞壁及菌核有降解作用[17-18]。毕赤酵母异源表达的gene02524与原核表达的几丁质酶Tachi2相比,热稳定性gene02524低于Tachi2;但是gene02524在pH值 3.0~8.5范围内相对酶活性在80%以上,具有更高的pH值稳定性[19]。而gene02524与同为酵母异源表达的棘孢木霉几丁质酶Tachi1相比,在热稳定性上低于Tachi1,但是在pH值稳定性上高于Tachi1,并且当环境中存在金属离子及变性剂和蛋白酶抑制剂时gene02524有更高的稳定性[14],说明gene02524与已报道的棘孢木霉几丁质酶相比具有一定的差异性。几丁质酶对很多病原菌都有抑制效果,Olivera等研究发现不同的几丁质酶作用方式不同[20],所以不同的几丁质酶对不同的病原菌抑制效果不同。本研究表达的gene02524与已报道的棘孢木霉几丁质酶在酶学性质上有很多差异,这种酶性质的差异可能导致不同几丁质酶在木霉中执行不同的生物学功能,有待于进一步深入研究。本研究实现了几丁质酶gene02524的酵母表达,明确了gene02524的酶学性质和抑菌活性,为植物病害的防治提供了新的基因资源,同时也为进一步研究棘孢木霉中几丁质酶的结构及功能奠定了基础。
4 结论
本研究成功通过毕赤酵母表达系统表达了几丁质酶gene02524,蛋白表观分子量为44.4 ku,与理论分子量相符,gene02524基因编码序列全长 1 190 bp,编码397个氨基酸并包含GH18家族特征的序列SXGG及DXXDXDXE,理论等电点为5.67。最适反应温度为50 ℃,在35 ℃下稳定性最好;gene02524蛋白具有非常广泛的pH值适用范围,在pH值4.0~10.0范围内均有较高的催化活性(剩余酶活>50%),最适pH值为5.0,在pH值为3.5时稳定性最高;金属离子对gene02524活性有明显影响,其中Cu2+、Hg2+强烈抑制酶活性;SDS强烈抑制酶活性,1 mmol/L EDTA与10 mmol/L β- 巯基乙醇对酶活性有一定的促进作用。gene02524对供试的病原菌均有不同程度的抑制效果,抑菌谱较广。
参考文献:
[1]Sood M,Kapoor D,Kumar V,et al. Trichoderma:the “secrets” of a multitalented biocontrol agent[J]. Plants (Basel,Switzerland),2020,9(6):762.
[2]Roberts M,Schimmelpfennig D,Ashley E,et al. The value of plant disease early-warning systems:a case study of USDAs soybean rust coordinated framework[J]. Economic Research Report,2006,26:1-48.
[3]Atreya K. Pesticide use in agriculture:the philosophy,complexities and opportunities[J]. Scientific Research and Essays,2012,7(25):2168-2173
[4]Mwabulambo S G,Mrema E J,Ngowi A V,et al. Health symptoms associated with pesticides exposure among flower and onion pesticide applicators in arusha region[J]. Annals of Global Health,2018,84(3):369-379.
[5]尤佳琪,吴明德,李国庆. 木霉在植物病害生物防治中的应用及作用机制[J]. 中国生物防治学报,2019,35(6):966-976.
[6]汤 伟,夏 伟,李雅华,等. 棘孢木霉(Trichoderma asperellum)几丁质酶基因的克隆与生物信息学分析[J]. 中国生物化学与分子生物学报,2012,28(4):385-392.
[7]Yang J K,Zhang K Q. Chitin synthesis and degradation in fungi:biology and enzymes[J]. Advances in Experimental Medicine and Biology,2019,1142:153-167.
[8]Elsherbiny E A,Amin B H,Aleem B,et al. Trichoderma volatile organic compounds as a biofumigation tool against late blight pathogen Phytophthora infestans in postharvest potato tubers[J]. Journal of Agricultural and Food Chemistry,2020,68(31):8163-8171.
[9]de la Cruz J,Hidalgo-Gallego A,Lora J M,et al. Isolation and characterization of three chitinases from Trichoderma harzianum[J]. European Journal of Biochemistry,1992,206(3):859-867.
[10]Chen W,Yang Q. Development of novel pesticides targeting insect chitinases:a minireview and perspective[J]. Journal of Agricultural and Food Chemistry,2020,68(16):4559-4565.
[11]Mahmood S,Kumar M,Kumari P,et al. Novel insecticidal chitinase from the insect pathogen Xenorhabdus nematophila[J]. International Journal of Biological Macromolecules,2020,159:394-401.
[12]Kumar V,Parkhi V,Kenerley C M,et al. Defense-related gene expression and enzyme activities in transgenic cotton plants expressing an endochitinase gene from Trichoderma virens in response to interaction with Rhizoctonia solani[J]. Planta,2009,230(2):277-291.
[13]Shah M R,Mukherjee P K,Eapen S. Expression of a fungal endochitinase gene in transgenic tomato and tobacco results in enhanced tolerance to fungal pathogens[J]. Physiology and Molecular Biology of Plants,2010,16(1):39-51.
[14]湯 伟,李雅华,刘 露,等. 重组毕赤酵母表达棘孢木霉几丁质酶Tachi1的酶学性质研究及表达条件优化[J]. 微生物学报,2012,52(3):345-352.
[15]Rosas-García N M,Fortuna-González J M,Barboza-Corona J E. Characterization of the chitinase gene in Bacillus thuringiensis Mexican isolates[J]. Folia Microbiologica,2013,58(6):483-490.
[16]胡仕凤,高必达,陈 捷. 木霉几丁质酶及其基因的研究进展[J]. 中国生物防治,2008,24(4):369-375.
[17]Lorito M,Peterbauer C,Hayes C K,et al. Synergistic interaction between fungal cell wall degrading enzymes and different antifungal compounds enhances inhibition of spore germination[J]. Microbiology,1994,140(Pt 3):623-629.
[18]LoritoM,WooSL,DAmbrosiM,etal.Synergisticinteraction
between cell wall degrading enzymes and membrane affecting compounds[J]. Molecular Plant-Microbe Interactions,1996,9(3):206-213.
[19]张军霞,丛大鹏,李雅华,等. 棘孢木霉几丁质酶tachi2基因的原核表达及酶学性质研究[J]. 中国生物工程杂志,2013,33(6):45-51.
[20]Olivera I E,Fins K C,Rodriguez S A,et al. Glycoside hydrolases family 20 (GH20) represent putative virulence factors that are shared by animal pathogenic oomycetes,but are absent in phytopathogens[J]. BMC Microbiology,2016,16(1):232.
