碱蓬内生菌对盐胁迫西瓜幼苗形态建成及生理特性的影响
2022-06-09陈昆张正亮高磊
陈昆 张正亮 高磊


摘要:为明确碱蓬内生菌对西瓜幼苗盐胁迫的缓解效应,以西瓜自交系材料HG-1和碱蓬内生菌为试验材料,采用外源添加NaCl溶液的方式模拟盐胁迫环境,通过在西瓜幼苗根部接种碱蓬内生菌,研究其对盐胁迫下西瓜幼苗形态建成、光合特性、活性氧积累及保护酶系统的影响。结果表明,盐胁迫能够显著降低西瓜幼苗株高、茎粗、地上部干鲜质量、根系干鲜质量,碱蓬内生菌液能够缓解盐胁迫对西瓜幼苗生长的抑制程度,且以复配后的NE2处理效果最佳。盐胁迫能够显著降低西瓜幼苗光合色素含量和光合能力,碱蓬内生菌液能够缓解盐胁迫对西瓜幼苗光合色素合成与净光合速率的抑制作用,且以复配后的NE2处理效果最佳。单纯NaCl胁迫能够显著促进西瓜叶片超氧阴离子的积累和丙二醛含量的增加,碱蓬内生菌液能够有效减轻活性氧的积累、降低丙二醛含量,其中NE2处理较单纯盐胁迫NE0处理分别降低37.54%、59.36%,且处理间差异显著(P<0.05)。单纯NaCl胁迫能够显著降低西瓜叶片保护酶活性,而碱蓬内生菌能有效缓解盐胁迫对保护酶活性的抑制作用,且以NE2处理的效果较佳,其中NE2处理下超氧化物歧化酶、过氧化物酶、抗坏血酸过氧化物酶活性较对照分别增加32.45%、27.28%、35.15%。表明碱蓬内生菌能够有效缓解NaCl对西瓜幼苗形态建成及生理特性的胁迫效应,且以复配后的NE2处理效果较好,能够用于缓解保护地西瓜的盐胁迫效应。
关键词:碱蓬;内生菌;盐胁迫;西瓜;形态建成;生理特性
中图分类号:S651.01 文献标志码: A
文章编号:1002-1302(2022)09-0116-06
全球约20%的耕地和50%的灌溉田正遭受不同程度的盐胁迫,其中我国盐渍化土地面积约为3.6×107 hm2,土壤盐渍化是当今农业生产面临的一大难题[1]。土壤盐渍化带来的盐胁迫已成为限制作物生长的重要非生物胁迫因子,它能够抑制作物发育进程、胁迫植物光合系统、引发膜脂过氧化反应[2]、打破细胞内的离子代谢平衡[3]、降低作物产量和品质等。相关研究报道,内生菌是一种广泛存在于健康植物组织或组织间隙的微生物类群,是修复盐胁迫危害的重要微生物资源[4]。韩坤从锦葵块根中分离出的内生菌能够有效提高小麦过氧化物酶活性,增加小麥的抗盐性[5]。Jan等将内生菌SXSP1接种到玉米植株上进行盐胁迫试验研究发现,内生菌能够诱导玉米合成吲哚-3-乙酸(IAA),促进植株生长,提高植株对盐胁迫的适应性[6]。可见,内生菌在植物抵御盐胁迫逆境伤害领域有重要的研究和应用价值。
早春保护地西瓜因较露地西瓜提早占有市场而具有较高的经济效益,种植面积逐渐增加,但保护地得不到雨水淋洗使得盐分无法向地下转移,加之农户化肥施用过量,长期的土壤水分蒸腾使土壤表层聚集较多的盐分,致使保护地土壤遭受盐渍化危害。西瓜不耐盐碱[7],其产量和品质受土壤盐渍化状况的影响显著,因此如何提高保护地西瓜的耐盐性已成为当前西瓜产业可持续发展迫切需要解决的关键难题。生产上有在保护地使用更换新土的办法进行解决,但不具有可持续性,而且在连片种植的瓜区较难实现。碱蓬生活在盐碱地这一逆境条件下,从中分离出来的内生菌因可以生活在这种极端逆境下而具有许多其他生物所没有的重要生理特性,有着十分重要的利用和科研价值。当前,有关内生菌在西瓜耐盐胁迫上的研究报道较少,而有关选用盐碱地碱蓬内生菌进行西瓜盐胁迫方面的试验研究亦未见详细报道。因此,本试验设计利用盐碱地碱蓬内生菌的耐盐碱特性来减轻盐渍化土壤对西瓜生长的危害,通过研究内生菌对盐胁迫条件下西瓜幼苗植株形态建成、光合色素、光合参数、活性氧积累、质膜过氧化水平及保护酶系统的影响,探究碱蓬内生菌对西瓜幼苗盐胁迫的缓解机制,以期为盐碱地西瓜栽培提供理论依据。
1 材料与方法
1.1 供试材料
供试西瓜材料为HG-1,为自交系材料,由商丘市农林科学院提供。供试碱蓬样品材料采自山东省东营市盐碱地。
1.2 内生菌的分离及筛选
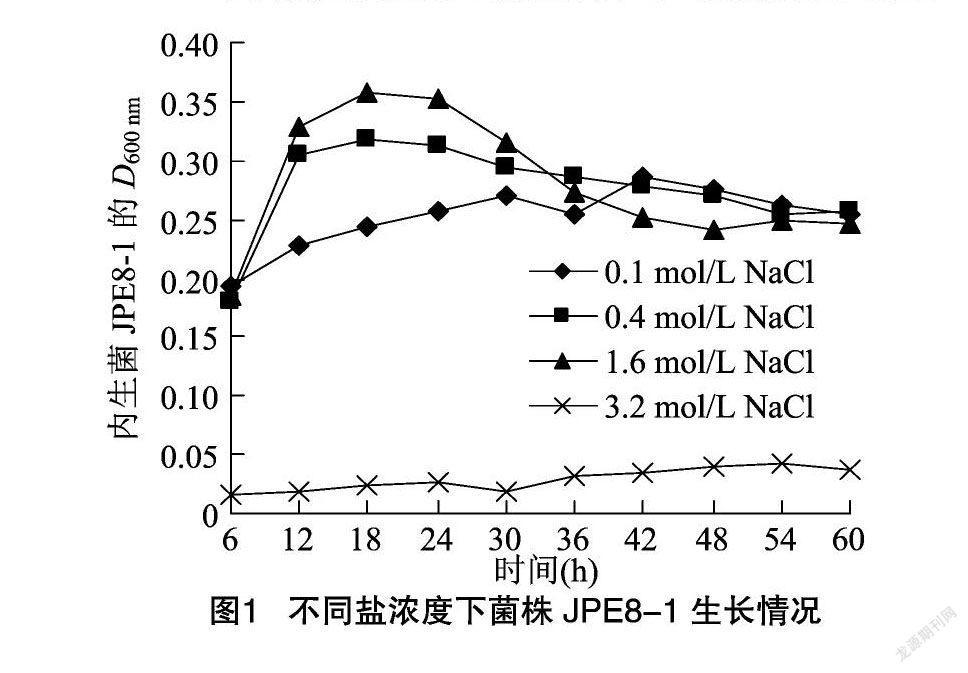
将从山东省东营市盐碱地采回的碱蓬样品洗净后剪成小段并晾干。用75%乙醇对样品消毒 5 min,无菌水冲洗3次,再用氯化汞消毒7 min,无菌水冲洗5次。将样品研磨后取汁液1 mL置于装有99 mL无菌水的三角瓶中,用涡旋混匀器混匀后稀释至10-4。取稀释液在高盐浓度的LB培养基上涂布,置于28 ℃培养箱中。3 d后挑取生长快、长势好、形态不同的单菌落,于相应培养基上划线转接至纯菌落,从中分离出1株耐盐菌株JPE8-1。不同盐浓度下菌株JPE8-1生长情况如图1所示,可知其生长盐浓度范围在0.1~1.6 mol/L之间。前期试验表明,在NaCl浓度为0.14 mol/L时西瓜幼苗能够表现出盐胁迫症状,因此选用NaCl浓度为0.14 mol/L的碱蓬内生菌液进行西瓜盐胁迫试验。
1.3 试验设计
试验于2021年2—6月在商丘市农林科学院巴庄蔬菜试验站人工气候室内进行。试验共设置1个对照(CK),3个处理(NE0、NE1、NE2)。其中,对照(CK)只浇灌清水,处理1(NE0)只浇灌 0.14 mol/L NaCl溶液,将浇灌不同含盐成分的碱蓬内生菌液分别记为NE1、NE2。NE1处理的内生菌液的获取办法为将试验菌种接种在液体LB培养基中活化后,于28 ℃、260 r/min摇床中振荡培养12 h后,取培养后的菌液按1%接种量分别接种在装有200 mL 浓度为0.14 mol/L的NaCl液体LB培养基的锥形瓶中,于28 ℃、260 r/min 恒温摇床中培养12 h。NE2处理的内生菌液的获取办法为将试验菌种接种在液体LB培养基中活化后,于28 ℃、260 r/min摇床中振荡培养12 h后,取培养后的菌液按1%接种量分别接种在装有100 mL 浓度为0.14 mol/L的NaCl溶液+100 mL浓度为0.14 mol/L(K 2SO 4+KNO 3)的液体LB培养基的锥形瓶中,于28 ℃、260 r/min恒温摇床中培养12 h。NE2处理为不增加内生菌液中Na+、Cl-的含量,使得NaCl盐胁迫加重,用K+、NO- 3、SO2- 4代替培养基中的Na+、Cl-进行复配改良,因此又称NE2处理的内生菌液为复配内生菌液。
将西瓜种子播种于穴盘内,每孔1粒,每盘播种32粒,共播种50盘,待西瓜幼苗长至3叶1心时,选取长势基本一致的瓜苗36盘,对照和任一处理均为9盘,每3盘为1次重复,重复3次。对照处理只添加清水,NE0处理浇灌0.14 mol/L NaCl溶液,NE1、NE2处理分别浇灌相应的内生菌液。处理 14 d 后对各指标进行测定。
1.4 测定的指标与方法
株高、茎粗分别用直尺、游标卡尺测量,干、鲜质量用万分之一天平称量。光合指标采用美国产LI-6400便携式光合测定仪测定,测定位置均为倒3张叶片。叶绿素含量、超氧阴离子(O- 2·)、抗坏血酸过氧化物酶(APX)活性分别采用95%乙醇提取法[8]、李忠光等的方法[9]、赵云霞等的方法[10]进行测定。丙二醛含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性分别采用硫代巴比妥酸法、氮蓝四唑(NBT)法、愈创木酚氧化法、高锰酸钾滴定法进行测定[11]。
1.5 数据处理
利用Microsoft Excel 2007软件对数据进行处理和作图,使用SPSS 25.0软件对数据进行统计分析。
2 结果与分析
2.1 内生菌对盐胁迫条件下西瓜幼苗农艺性状的影响
從表1可以看出,盐胁迫(NE0处理)能够降低西瓜株高、茎粗、地上部干鲜质量、地上部干质量、根系鲜质量与根系干质量,较对照分别降低51.79%、31.11%、54.75%、51.68%、52.01%、46.51%,与对照差异显著(P<0.05)。与盐胁迫NE0处理相比,碱蓬内生菌液NE1、NE2处理能够有效缓解盐胁迫对西瓜幼苗生长的抑制作用,且NE2处理下西瓜幼苗各农艺性状指标均高于NE1处理。表明碱蓬内生菌JPE8-1能够缓解盐胁迫对西瓜幼苗生长的危害,且以复配后的NE2处理效果更佳。
2.2 内生菌对盐胁迫条件下西瓜幼苗光合色素含量的影响
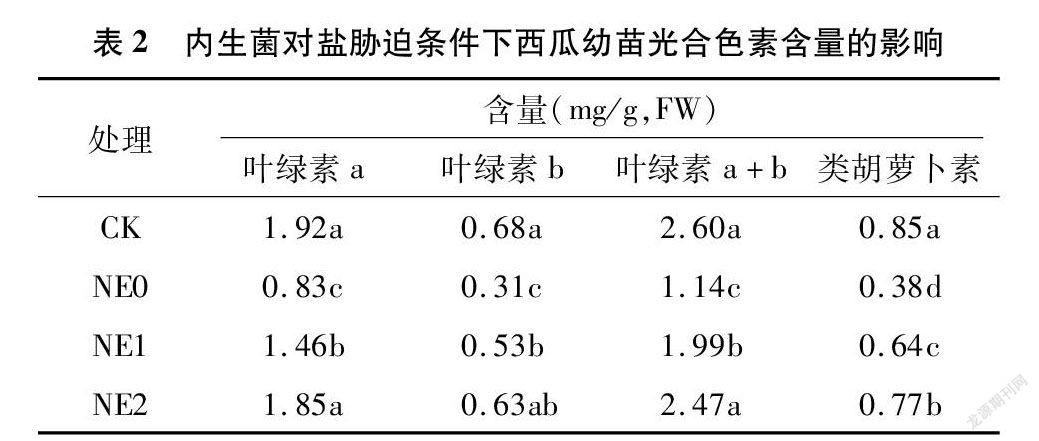
从表2可以看出,在盐胁迫逆境条件下西瓜幼苗叶绿素含量呈降低趋势,且以单纯盐胁迫NE0处理下叶绿素含量降低程度较为显著,说明盐胁迫对西瓜叶片光合色素的合成有抑制作用。含内生菌液的NE1、NE2处理西瓜幼苗光合色素含量亦低于对照,但均高于单纯盐胁迫NE0处理,且与NE0处理差异显著(P<0.05),说明内生菌液能够促进西瓜幼苗叶片叶绿素含量的增加。其中,NE1处理叶绿素a、叶绿素b、叶绿素a+b和类胡萝卜素含量分别较NE0处理增加75.90%、70.97%、74.56%、68.42%,NE2处理叶绿素a、叶绿素b、叶绿素a+b和类胡萝卜素含量分别较NE0处理增加122.89%、103.23%、116.67%、102.63%。另外,NE2处理下叶绿素a、叶绿素b、叶绿素a+b、类胡萝卜素含量均高于NE1处理,且NE2处理下叶绿素a、叶绿素b、叶绿素a+b含量与对照差异均不显著(P>0.05),表明复配内生菌液较内生菌液更有利于叶片光合色素的合成。
2.3 内生菌对盐胁迫条件下西瓜幼苗光合指标的影响
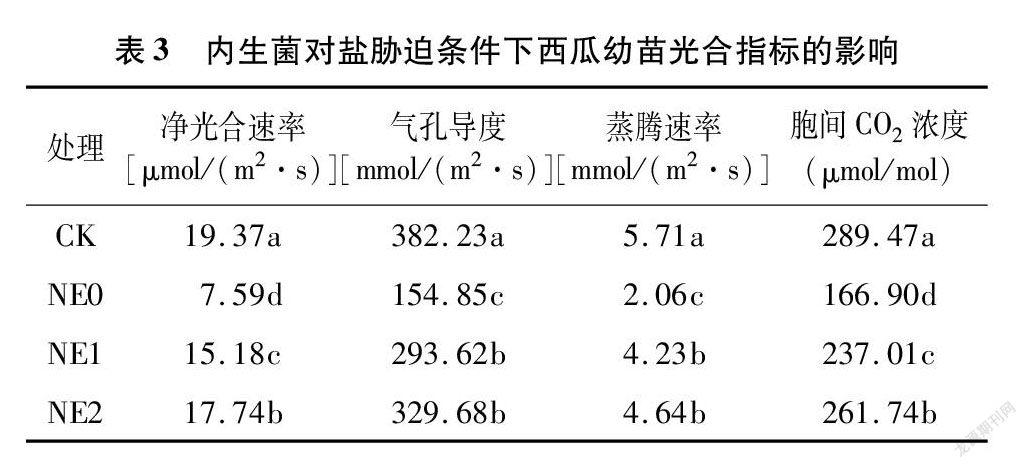
从表3可以看出,盐胁迫对西瓜幼苗光合能力的提高有显著的抑制作用,其中NE0处理净光合速率、气孔导度、蒸腾速率、胞间CO 2浓度较对照分别降低60.82%、59.49%、63.92%、42.34%,且与对照差异达显著水平(P<0.05)。内生菌NE1、NE2处理下的西瓜叶片净光合速率低于对照,气孔导度、蒸腾速率、胞间CO 2浓度亦低于对照,但均显著高于单纯盐胁迫NE0处理,其中,NE2处理下各指标均高于NE0、NE1处理,且较NE0处理分别增加133.73%、112.90%、125.24%、56.82%。说明内生菌能有效缓解盐胁迫对西瓜叶片光合能力的抑制作用,且复配后的内生菌液体对西瓜叶片光合能力改善作用更佳。
2.4 内生菌对西瓜幼苗超氧阴离子与丙二醛含量的影响
从图2可以看出,NE0处理下的单纯盐胁迫能够显著增加西瓜叶片超氧阴离子和丙二醛含量,较对照分别增加82.66%、196.83%。内生菌对西瓜叶片活性氧的积累及膜脂过氧化伤害程度有一定的缓解作用。NE1、NE2处理下的超氧阴离子和丙二醛含量均显著低于NE0处理,且以NE2处理效果较好,NE2处理较NE0分别降低37.54%、59.36%。另外,NE2处理下的超氧阴离子和丙二醛含量虽然仍高于对照,但与对照差异不显著,表明复配后的内生菌液能够有效减轻盐胁迫对西瓜叶片的膜伤害。
2.5 内生菌对西瓜幼苗抗氧化酶保护系统的影响
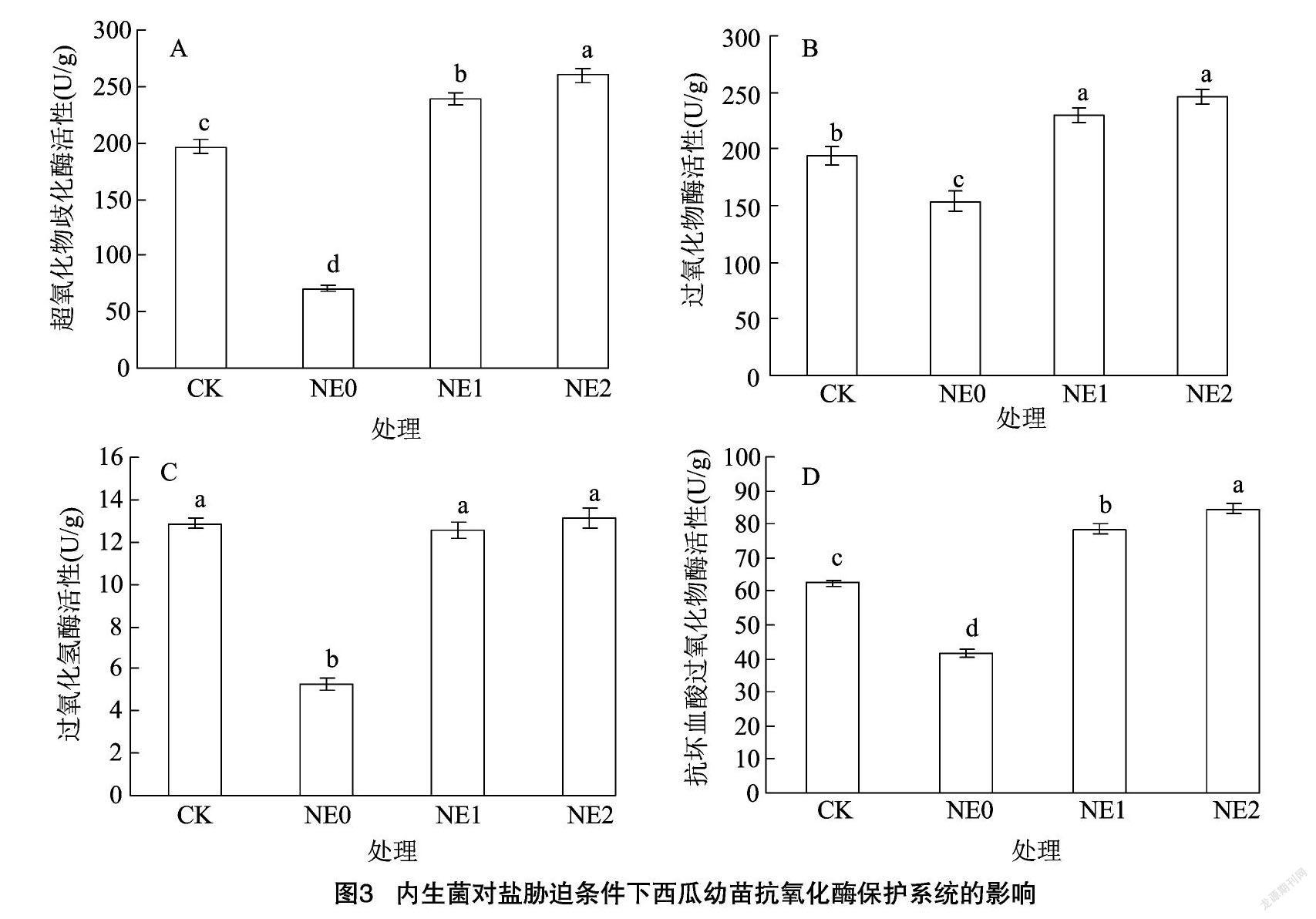
从图3可以看出,单纯NaCl胁迫能够显著降低西瓜叶片保护酶活性,NE0处理西瓜叶片超氧化物歧化酶活性较对照降低64.16%(图3-A),过氧化物酶活性较对照降低20.63%(图3-B),过氧化氢酶活性较对照降低59.13%(图3-C),抗坏血酸过氧化物酶活性较对照降低33.36%(图3-D)。内生菌对盐胁迫在保护酶活性的抑制程度上有明显的缓解效应,NE1、NE2处理下的超氧化物歧化酶、过氧化物酶、过氧化氢酶、抗坏血酸过氧化物酶活性均显著高于NE0处理,且以NE2处理的效果较佳。NE1、NE2处理下过氧化氢酶活性与对照差异均不显著。NE1、NE2处理下超氧化物歧化酶、过氧化物酶、抗坏血酸过氧化物酶活性均高于对照,且与对照差异显著(P<0.05),其中NE2处理下较对照分别增加32.45%、27.28%、35.15%。
3 讨论与结论
研究认为,内生菌在植物的组织和器官中广泛存在[12],且在大多数情况下与植物存在互惠共生的关系,即内生菌从植物体内汲取所需养分,植物利用内生菌分泌的大量活性物质提高自身机体抗虫、抗病、抗逆境胁迫能力[13]。董芮萌等研究认为,在盐胁迫条件下,接种内生菌的水稻幼苗株高、根长等生长指标均高于未接种内生菌的水稻幼苗[14]。陈珣等研究指出,人参内生菌提取物能够有效降低盐胁迫对番茄幼苗生长的抑制作用[15]。本研究结果表明,在盐胁迫条件下西瓜幼苗生长受到显著抑制,但碱蓬内生菌能够有效缓解盐胁迫对西瓜幼苗的抑制作用,且复配内生菌液效果更好,本试验结果与前人研究结论一致,这可能是因为内生菌分泌物中含有包括赤霉素(GA)、生长素(IAA)等在内的能够促进植株生长的相关物质;另外,内生菌可使宿主吸收较多的矿质营养元素,为植物的生长积累物质基础,进而间接促进宿主植物生长[16]。但也有与上述研究不一致的结论,内生菌对黑麦草的营养生长不具有促进作用,且在高盐环境下被内生菌侵染的黑麦草地上部生物量与分蘖数均低于未被内生菌侵染的黑麦草[17],表明内生菌与宿主之间存在选择性,如基因型的匹配是二者共生的前提。
叶绿素含量高低与植物光合能力强弱密切相关。正常条件下,植物体叶绿素含量保持一个动态平衡,但在盐胁迫条件下这种动态平衡会因细胞色素系统的损伤和破坏而被打破,致使叶绿素含量降低[18]。张宜辉等研究得出,盐胁迫能够显著降低构树幼苗叶片光合色素含量,而外源添加巨大芽孢杆菌(BN1259)能够有效缓解盐胁迫对构树幼苗光合色素合成的抑制作用[19]。张广波等研究认为,桃树叶片叶绿素含量、净光合速率在NaCl浓度达到0.6%以上时表现出下降趋势[20]。本研究结果表明,NaCl浓度为0.14 mol/L时西瓜叶片光合色素含量显著降低,说明盐胁迫能够对西瓜叶片造成损伤,进而抑制了光合色素的生成,这与前人的试验结论一致,这应该是因为植株机体在NaCl逆境胁迫下积累的强氧化剂过氧化氢,通过哈伯·韦斯反应生成的羟基自由基使细胞膜发生膜脂过氧化反应[21],损害生物膜及其功能,叶绿体稳定性降低,类囊体和基粒分别在排列顺序与排列方向上发生改变,叶绿体蛋白与叶绿素之间的连接变得不再紧密,致使叶绿素从类囊体膜上脱离,叶绿素含量降低,或者叶绿素的合成场所受到破坏导致叶绿素含量下降[22],柯玉琴等在NaCl对甘薯叶绿体超微结构影响的研究中也证明了这一观点[23]。内生菌液能够有效缓解NaCl胁迫对西瓜幼苗叶片叶绿素合成的抑制作用,且以复配后的内生菌液效果更佳,这可能是因为内生菌侵染西瓜植株后能够刺激光合色素生物合成酶类的活性,促进叶绿素的合成;另外,西瓜被外源内生菌侵染后能够刺激抗氧化系统保护酶活性的提高,活性氧清除能力提高,减轻机体因盐胁迫造成的活性氧积累的增加,进而减轻活性氧对叶绿体的伤害。复配后的内生菌液NE2处理效果好于内生菌液NE1处理,这应该是因为水合离子半径相似的钠离子与钾离子之间具有拮抗作用,钠离子能够抑制植株对钾离子的吸收利用,进而抑制生长代谢过程中需要K+参与的生理生化反应[24],复配后的内生菌液用KNO 3和K 2SO 4来代替培养液中的NaCl,在保证同等浓度盐胁迫的同时为植株提供了生长所需的K+,并增强了植株的抗逆性[25],从而减轻了盐胁迫对西瓜幼苗的损伤。
光合作用是高等植物进行物质积累和获得能量的前提条件,但植株光合能力的高低除与自身遗传特性有关外,还受到盐胁迫等逆境条件的制约。本研究条件下,单纯盐胁迫NE0处理下的西瓜叶片净光合速率显著低于对照,这应该是因为高浓度盐胁迫能够降低细胞内RuBP羧化酶活性,接收CO 2底物的能力降低,加之细胞水势降低使气孔趋于关闭,进一步减少光合底物,使叶片光合能力降低[26]。另外,叶绿素含量的降低使其捕捉光减少,降低了光合同化力产生,使得光系统Ⅰ(PSⅠ)和光系统Ⅱ(PSⅡ)活性减弱,造成植物光合能力下降[27]。内生菌能够通过影响植株气孔的开闭来影响其光合能力,陈世苹等研究指出,内生菌可通过分泌物中的赤霉素来调节盐胁迫环境下植物体内的脱落酸含量,进而调节气孔开关[28]。本试验条件下,添加有内生菌的NE1、NE2处理西瓜幼苗各光合参数均高于NE0处理,这应该是因为内生菌侵染宿主植物之后,宿主激素水平的改变能够调控植株气孔的开放程度,进而影响净光合速率和蒸腾速率的改变[29]。
盐胁迫通过引发膜脂过氧化反应对细胞质膜造成损伤[30-31],MDA与膜脂过氧化作用密切相关[32]。本试验条件下,NE0处理西瓜叶片MDA含量与CK相比显著提高,表明盐胁迫能够对西瓜幼苗葉片细胞质膜造成伤害,该试验结果与韩春梅等在莴笋幼苗盐胁迫试验中的结论[33]一致,其原因应该是NE0处理下活性氧的积累速度超出了活性氧清除系统的清除范围,致使活性氧代谢失衡,膜脂过氧化产物MDA含量不断增加,并引起细胞膜上蛋白质分子间与分子内交联,进而对细胞膜系统造成损伤[34];同时,细胞中积累的Na+与具有保护和稳定细胞质膜的Ca+发生置换反应,也能够破坏细胞质膜的稳定性[35]。添加有内生菌的NE1、NE2处理西瓜叶片超氧阴离子含量显著低于NE0处理,说明内生菌对细胞质膜有一定的保护作用,这应该是因为内生菌可以刺激植物体内的抗坏血酸-谷胱甘肽循环系统,该循环能够有效清除植物体内的超氧阴离子,增强植株逆境胁迫能力[36],同时内生菌可通过抑制不饱和脂肪酸的降解速率刺激抗氧化酶活性的提高,从而清除机体过量的超氧阴离子[37]。另外,本试验条件下,NE1、NE2处理下的SOD、POD、CAT、APX等保护酶的活性均高于单纯的盐胁迫的研究结果也进一步证明了内生菌能够提高植株机体保护酶活性这一观点,从而为活性氧的清除提供了必要条件,说明内生菌能够激活西瓜幼苗叶片的抗氧化代谢反应,使抗氧化物质增加、抗氧化酶活性提高,二者协同减弱了超氧阴离子对细胞质膜的伤害,该试验结果与王正凤等在野大麦上的研究结论[38]一致。
参考文献:
[1]赵 莹,杨克军,李佐同,等. 外源糖浸种缓解盐胁迫下玉米种子萌发[J]. 应用生态学报,2015,26(9):2735-2742.
[2]刘 梅,郑青松,刘兆普,等. 盐胁迫下氮素形态对油菜和水稻幼苗离子运输和分布的影响[J]. 植物营养与肥料学报,2015,21(1):181-189.
[3]Grattan S R,Grieve C M.Mineral element acquisition and growth response of plants grown in saline environments[J]. Agriculture,Ecosystems & Environment,1992,38(4):275-300.
[4]Farrar K,Bryant D,Cope-Selby N. Understanding and engineering beneficial plant-microbe interactions:plant growth promotion in energy crops[J]. Plant Biotechnology Journal,2014,12(9):1193-1206.
[5]韩 坤. 具ACC脱氨酶的海滨锦葵内生细菌对植物的耐盐性影响[D]. 郑州:郑州大学,2015.
[6]Jan F G,Hamayun M,Hussain A,et al. A promising growth promoting Meyerozyma caribbica from Solanum xanthocarpum alleviated stress in maize plants[J]. Bioscience Reports,2019,39(10):BSR20190290.
[7]韩志平,张海霞,高 迎,等. 水杨酸对盐胁迫下西瓜种子萌发特性的影响[J]. 山西大同大学学报(自然科学版),2011,27(5):66-69.
[8]王学奎. 植物生理生化实验原理和技术[M]. 2版.北京:高等教育出版社,2006.
[9]李忠光,龚 明. 植物中超氧阴离子自由基测定方法的改进[J]. 云南植物研究,2005,27(2):211-216.
[10]赵云霞,于贤昌,李超汉,等. 高低温胁迫对番茄叶片抗坏血酸代谢系统的影响[J]. 山东农业科学,2010,42(4):22-26.
[11]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:79-83.
[12]郝晓娟. 植物内生菌[M]. 北京:中国农业科学技术出版社,2010:39-40.
[13]Guo B,Wang Y,Sun X,et al. Bioactive natural products from endophytes:a review[J]. Applied Biochemistry and Microbiology,2008,44(2):136-142.
[14]董芮萌,王佳瑶,朱梦卓,等. 内生菌对镉和盐单一及复合胁迫下水稻幼苗生长及生理特性的影响[J]. 安徽农业科学,2021,49(19):31-34,37.
[15]陈 珣,杨 镇,曹 君,等. 人参内生菌提取物对硝酸盐胁迫下番茄幼苗生长及氮代谢相关指标的影响[J]. 江苏农业学报,2017,33(5):1111-1116.
[16]文才艺,吴元华,田秀玲. 植物内生菌研究进展及其存在的问题[J]. 生态学杂志,2004,23(2):86-91.
[17]任安芝,高玉葆,章 瑾,等. 内生真菌感染对黑麦草抗盐性的影响[J]. 生态学报,2006,26(6):1750-1757.
[18]过晓明,张 楠,马代夫,等. 盐胁迫对5种甘薯幼苗叶片叶绿素含量和细胞膜透性的影响[J]. 江苏农业科学,2010,38(3):93-94.
[19]张宜辉,王 琳,陶 立,等. 盐胁迫下BM1259对构树幼苗生长和生理特性的影响[J]. 环境科学与技术,2021,44(增刊1):40-44.
[20]张广波,王 震,刘粉粉,等. NaCl胁迫对信阳五月鲜桃生长和光合特性的影响[J]. 江苏农业科学,2021,49(17):145-149.
[21]蒋明义,杨文英,徐 江,等. 滲透胁迫下水稻幼苗中叶绿素降解的活性氧损伤作用[J]. 植物学报,1994,36(4):289-295.
[22]郑文菊,张承烈. 盐生和中生环境中宁枸杞叶显微和超微结构的研究[J]. 草业学报,1998,7(3):72-76.
[23]柯玉琴,潘廷国. NaCl 胁迫对甘薯叶片叶绿体超微结构及一些酶活性的影响[J]. 植物生理学报,1999,25(3):229-233,315.
[24]Zhang J L,Shi H Z.Physiological and molecular mechanisms of plant salt tolerance[J]. Photosynthesis Research,2013,115(1):1-22.
[25]郝艳淑,姜存仓,夏 颖,等. 植物钾的吸收及其调控机制研究进展[J]. 中国农学通报,2011,27(1):6-10.
[26]赵福庚. 植物逆境生理生态学[M]. 北京:化学工业出版社,2004:69.
[27]Allakhverdiev S I,Nishiyama Y,Miyairi S,et al. Salt stress inhibits the repair of photodamaged photosystem Ⅱ by suppressing the transcription and translation of psbA genes in Synechocystis[J]. Plant Physiology,2002,130(3):1443-1453.
[28]陈世苹,高玉葆,梁 宇,等. 水分胁迫下内生真菌感染对黑麦草叶内游离脯氨酸和脱落酸含量的影响[J]. 生态学报,2001,21(12):1964-1972.
[29]Malinowski D P,Belesky D P. Adaptations of endophyte-infected cool-season grasses to environmental stresses:mechanisms of drought and mineral stress tolerance[J]. Crop Science,2000,40(4):923-940.
[30]王仁雷,华 春,周 峰,等. 盐胁迫下不同耐盐性水稻幼苗叶绿素荧光差异性研究[J]. 江苏农业科学,2008,36(4):34-37.
[31]王宝山.生物自由基与植物膜伤害[J]. 植物生理学通讯,1988,24(2):12-16.
[32]Zheng J,Ma X H,Zhang X L,et al. Salicylic acid promotes plant growth and salt-related gene expression in Dianthus superbus L.(Caryophyllaceae) grown under different salt stress conditions[J]. Physiology and Molecular Biology of Plants,2018,24(2):231-238.
[33]韩春梅,李春龙,贺阳冬,等. NaCl胁迫对莴笋种子萌发及幼苗根系生理生化指标的影响[J]. 长江蔬菜,2009(10):21-23.
[34]Shi L X,Guo J X. Changes in photosynthetic and growth characteristics of Leymus chinensis community along the retrogression on the Songnen grassland in Northeastern China[J]. Photosynthetica,2006,44(4):542-547.
[35]颜志明. 外源脯氨酸提高甜瓜幼苗耐盐性的生理调节功能[D]. 南京:南京农业大学,2011.
[36]Waller F,Achatz B,Baltruschat H,et al. The endophytic fungus Piriformospora indica reprograms barley to salt-stress tolerance,disease resistance,and higher yield[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(38):13386-13391.
[37]Sun C,Johnson J M,Cai D G,et al. Piriformospora indica confers drought tolerance in Chinese cabbage leaves by stimulating antioxidant enzymes,the expression of drought-related genes and the plastid-localized CAS protein[J]. Journal of Plant Physiology,2010,167(12):1009-1017.
[38]王正鳳,李春杰,金文进,等. 内生真菌对野大麦耐盐性的影响[J]. 草地学报,2009,17(1):88-92.
