κ-阿片肽受体激活抑制内皮素-1诱导的心肌细胞肥大与细胞外信号调节激酶通路有关
2022-06-08冀建伟李桃英赵继玲李志业杨育红
邢 玲,冀建伟,李桃英,赵继玲,李志业,杨育红
(1.郑州大学第二附属医院,河南 郑州 450014;2.锦州医科大学 心脑血管药物研究重点实验室,药理学教研室,辽宁 锦州 121001)
高血压、心瓣膜病及心肌炎等多种原因所致的心血管疾病均可引起一种心脏功能的代偿性改变,即心肌肥大,主要表现为心肌细胞体积的增大、细胞外基质增多所致的心肌纤维化。这种心肌细胞增大而无细胞分裂的现象如果未进行及时有效的干预会最终造成心肌肥厚,而这种长期持续性未干预的心肌肥厚是引起不可逆转的心脏衰竭甚至猝死的一个重要原因[1]。
心肌细胞本身可以合成、释放阿片肽,其对心脏活动的调节方式为自分泌或旁分泌。许多研究显示,心脏上存在κ阿片肽受体(kappa-opioid receptor,κ-OR)及δ-OR亚型。研究表明,κ-OR对心肌细胞可以产生负性调节作用,而该作用可以抑制多种因素如去甲肾上腺素、异丙肾上腺素、血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)等诱导的心肌肥大[2],而这种抑制作用无一例外的都与细胞内[Ca2+]i瞬变有关[3]。
研究显示,血管内皮素1(vascular endothelin-1,ET-1)诱导的心肌肥厚反应是通过激活磷脂酶C(phospholipase C,PLC)、蛋白激酶C(protein kinase C,PKC)、磷脂酶A2(phospholipase A2,PLA2)和丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)等通路实现的。ET-1属于G蛋白偶联受体,能够结合G蛋白后激活PLC,后者让二磷酸磷脂酰肌醇(phosphatidylinosito(4,5) biosphosphate,PIP2)水解为三磷酸肌醇(inositol triphosphate,IP3)及二酰基甘油(diacylglycerol,DG),IP3引起细胞内[Ca2+]i 的瞬变,并促成胞外Ca2+向胞内转移,使钙调蛋白活化,然后触发活化T细胞核因子(nuclear factor of activated T-lymphocytes,NFAT)核转位,从而使相关基因、蛋白表达增加,最终造成心肌肥厚[4]。最新研究证明,该致心肌肥厚过程与ET-1和受体结合后通过PKC依赖性或PKC非依赖性等一系列过程激活MAPK使其磷酸化,进而激活许多物质以使肥厚基因表达增加有关[5]。MAPKs是一组蛋白丝/苏氨酸激酶,其信号转导通路主要包括细胞外信号调节激酶(extracellular signal-regulated kinases,ERKs)、应激活化蛋白激酶(stress-activated protein kinase/c-Jun N-terminal kinase,SAPKs/JNKs)和p38三种[6],且ERK途径是细胞生长、分化与存活等过程的重要信号转导机制。
而阿片肽是否通过ERK通路抑制ET-1诱导的心肌肥大,国内外尚未见报道。本研究采用体外培养心肌细胞模型,重点观察了κ阿片受体激动剂(U50488H)和ERK抑制[1,4-diamino-2,3-dicyano-1,4-bis(o-aminophenylmercapto)butadiene,U0126]对ET-1诱导的心肌肥大的影响及ANP-mRNA和ERK1/2表达的影响,以探讨κ阿片受体对ERK诱导的心肌肥大的抑制作用及其信号转导机制。
1 材料与方法
1.1 实验动物SD大鼠(生后1~3 d),雌雄不限,由河南省试验动物中心提供,动物许可证号SCXK(豫)2017-0001。
1.2 药品与试剂胎牛血清(FB25015)购于美国CLARK公司、DMEM培养基(SH30081.01)购于澳洲 HyClone 公司、U50488H、κ-OR受体拮抗剂(nor-binaltorphimine,NOR-BNI)、PKC抑制剂(bisindolylmaleimide IX mesylate,Ro-31-8220)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、百日咳毒素(pertussis toxin,PTX)、ET-1、U0126、均购自Sigma;PCR检测试剂盒购自大连宝信生物技术公司;RIPA buffer(SDS,Tritern X-100,PMSF)购自上海生工,其他试剂均为分析纯。
1.3 仪器信息超净工作台:江苏吴县市净化技术研究所、二氧化碳孵箱:Sheldon Manufacturing Inc,USA、XD-101型倒置显微镜:OLYMPUS TOKYO,JAPAN、79-1磁力加热搅拌器:江苏金坛中大仪器厂、TDL-4型离心机:上海安亭科学仪器厂制造、电子天平:北京赛多利斯天平有限公司、DNM-9602G酶标分析仪:北京普朗新技术有限公司、2041 ELECTRO:RioRad Trans-Blot Sdelectrophoresis、Mini ProteanⅡ vertical:BioRad、PowerPac Basic:BioRad。
1.4 体外大鼠乳鼠心肌细胞培养[7]无菌环境下,眼科剪剪开出生1~3 d的SD大鼠乳鼠剑突,取出心脏,用Hanks液冲洗3次,并剪至碎块1 mm3大小,用胰蛋白酶(浓度为0.8 g·L-1)消化分离细胞。用含小牛血清(体积分数为0.15)、DMEM培养基(体积分数为0.84)、双抗液(体积分数为0.01,含1×10 U·L-1的青霉素,100 mg·L-1链霉素)的培养基对之前离心分离的细胞进行处理,吹打均匀后接种于培养瓶其密度为1×109·L-1,或用24孔培养板接种其密度为0.5×109·L-1,培养箱为二氧化碳孵箱内含5% CO2。为了减少血清中的成分对实验结果的影响,常规培养心肌细胞2 d后,更换为含0.004小牛血清的培养基再培养1 d后加入处理因素。
1.5 分组及给药方法为了减少血清中成分对检测结果的影响,常规培养心肌细胞48 h后,无菌条件下,加药前更换培养基换为含0.04%小牛血清DMEM培养基,更换后送入通以5% CO2,孵箱中30 min后分组给药,每组用5个培养瓶;如果是培养板,每板分为四组,每组6孔。分组如下:(1) 正常组、(2) ET-1 10 nmol·L-1组、(3) ET-1 10 nmol·L-1+U50488H 1 μmol·L-1组、(4) ET-1 10 nmol·L-1+U0126 1 μmol·L-1组、(5) ET-1 10 nmol·L-1+Ro-31-8220 1 μmol·L-1组 、(6) ET-1 10 nmol·L-1+U50488H 1 μmol·L-1+U0126 1 μmol·L-1组、(7) ET-1 10 nmol·L-1+U50488H 1 μmol·L-1+Ro-31-8220 1 μmol·L-1组、(8) ET-1 10 nmol·L-1+U50488H 1 μmol·L-1+NOR-BNI 1 μmol·L-1组、(9)ET-1 10 nmol·L-1+U50488H 1 μmol·L-1+PTX 5 mg·L-1组、(10) ET-1 10 nmol·L-1+U0126 1 μmol·L-1+NOR-BNI 1 μmol·L-1组、(11) ET-1 10 nmol·L-1+Ro-31-8220 1 μmol·L-1+NOR-BNI 1 μmol·L-1组。各组药物的浓度以文献报道为标准[8],48 h后进行各项指标的测定:各组先给相应阻断剂预处理,然后放入通以5% CO2的二氧化碳孵箱中;30 min后取出给保护药,继续送入上述二氧化碳孵箱中;30 min后取出加入造模药ET-1;48 h后进行各项指标的测定。
1.6 培养心肌细胞体积测量[9]测量细胞直径进而通过计算可以获得细胞体积,用D-Hanks液快速3次冲洗培养孔,其内加胰蛋白酶(浓度为0.3 mL·g·L-1),将其放入温度为37 ℃的恒温箱,10 min后,加入培养基(含有10%的血清)0.2 mL以结束消化,将细胞收集后加入到一个用硅化的盖玻片制作的细胞室内,用倒置显微镜(扩大400倍)观察上述制作的细胞室内的呈球形的细胞。细胞的直径(R)利用计算机CIAS大恒细胞图象分析系统测量,细胞的体积公式为4/3πr3(r=1/2R)。
1.7 RT-PCR法测心肌细胞ANP的mRNA表达[7]利用培养瓶培养大鼠心肌细胞,种植密度为1×108·L-1,分组给予药物处理2 d后,丢掉培养液,以PBS洗涤2次,收集心肌细胞入EP管,经过离心保留细胞成分,之后用TRIzol试剂完全裂解细胞,取此裂解液1 mL,抽提(氯仿)、沉淀(异丙醇),最后回收总RNA,并用-70 ℃冰箱贮存备用。以1%琼脂糖凝胶电泳及紫外分光光度计(A260/A280)鉴定RNA的纯度和浓度。取总RNA(约1 μg),进行反转录。反转录条件如下:先42 ℃ 60 min,后99 ℃ 2 min,4 ℃保存。ANP引物序列(5′-3′)为GGC TCC TTC TCC ATC ACC AA TGT TAT CTT CGG TAC CG,内参 GAPDH引物序列(5′-3′)为CAA AGT TGT CAT GGA TGA CCA TGG AGA AGG CTG GG。上述由大连宝信生物有限公司合成的引物。灭菌水溶解上述引物,配成100 μmol·L-1的上下游引物混合液,使用浓度(μmol·L-1)。
1.8 Western blot法测ERK1/2相对表达水平[10]细胞分组给药48 h后,PBS缓冲液冲洗、离心、收集细胞,放入-70 ℃冰箱备用。对指标进行测定时,每份制样选取50 μg,每份制样中选取10 μL作为样品进行点样,点样标准物为蛋白质(Cell Signaling Tecnology,MA,USA)。采用恒压电泳法电泳3~5 h,凝胶为变性的SDS聚丙烯酰胺,采用半干法转模9~12 h,4 ℃条件下封闭过夜,洗膜,然后先用一抗(以1 ∶5 000稀释的兔抗ERK及兔抗p-ERK)室温条件下反应2 h,随后用二抗(以1 ∶2 000稀释的鼠抗兔IgG抗体)室温反应1 h,Supel Signal West Pico试剂盒内作用5 min,放射条件下显影。
1.9 倒置相差显微镜观察细胞形态变化[7]将倒置相差显微镜置于有机玻璃保温箱内,并保持箱内采用恒温气体对流装置,使观测中的培养板始终被37 ℃恒温气流覆盖。用放大倍数为200倍目镜观察心肌细胞形态。

2 结果
2.1 U50488H对ET-1诱导心肌细胞体积增大的抑制作用ET-1组与对照组相比,心肌细胞体积明显增大;与ET-1组相比,U50488H(1 μmol·L-1)、U0126(1 μmol·L-1)、Ro-31-8220(50 nmol·L-1)均可明显使ET-1诱导的心肌细胞体积变小,且三者显著差异;当U0126(1 μmol·L-1)或Ro-31-8220(50 nmol·L-1)存在时,U50488H(1 μmol·L-1)可以使心肌细胞体积减小现象被部分抑制;但当用PTX(5 mg·L-1)预处理时U50488H(1 μmol·L-1)使ET-1诱导的心肌细胞体积变小的现象基本消失;当用NOR-BNI(1 μmol·L-1)预处理时,U50488H(1 μmol·L-1)、U0126(1 μmol·L-1)、Ro-31-8220(50 nmol·L-1)使ET-1诱导的心肌细胞体积变小的现象基本消失,且三者差异无统计学意义(Fig 1)。
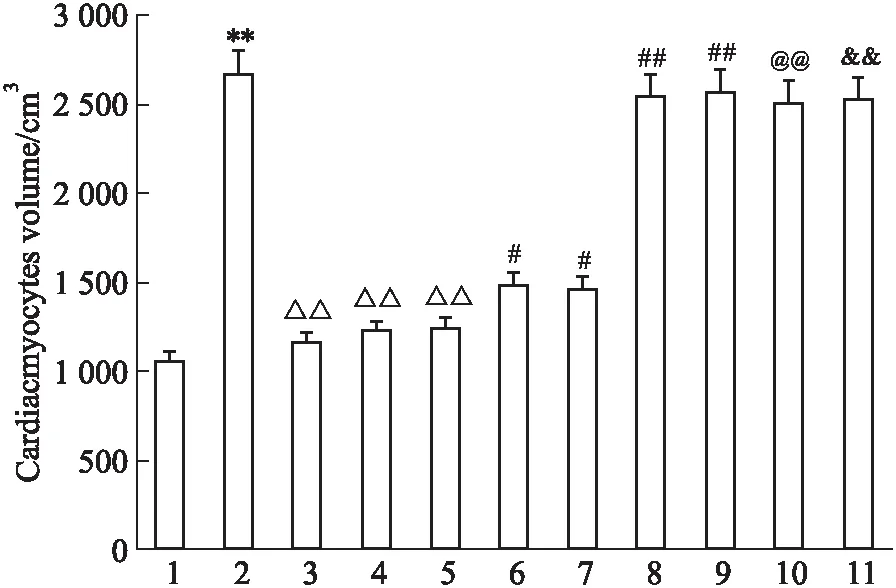
Fig 1 Effects of different agents on cell size of cultured cardiacmytes induced by n=100)
2.2 U50488H对ET-1培养诱导的心肌细胞的ANP-mRNA的抑制作用ET-1组与对照组相比,心肌细胞ANP-mRNA表达明显增多;与ET-1组相比,U50488H(1 μmol·L-1)、U0126(1 μmol·L-1)、Ro-31-8220(50 nmol·L-1)均可明显使ET-1诱导的心肌细胞ANP-mRNA减少,且三者无显著差异;当U0126(1 μmol·L-1)或Ro-31-8220(50 nmol·L-1)存在时,U50488H(1 μmol·L-1)可以使心肌细胞ANP-mRNA表达减少的情况被部分抑制;但当用PTX(5 mg·L-1)预处理时U50488H(1 μmol·L-1)使ET-1诱导的心肌细胞体积变小的现象基本消失;当用NOR-BNI(1 μmol·L-1)预处理时,U50488H(1 μmol·L-1)、U0126(1 μmol·L-1)、Ro-31-8220(50 nmol·L-1)使ET-1诱导的心肌细胞ANP-mRNA表达减少的现象基本消失,且三者差异无统计学意义(Fig 2)。
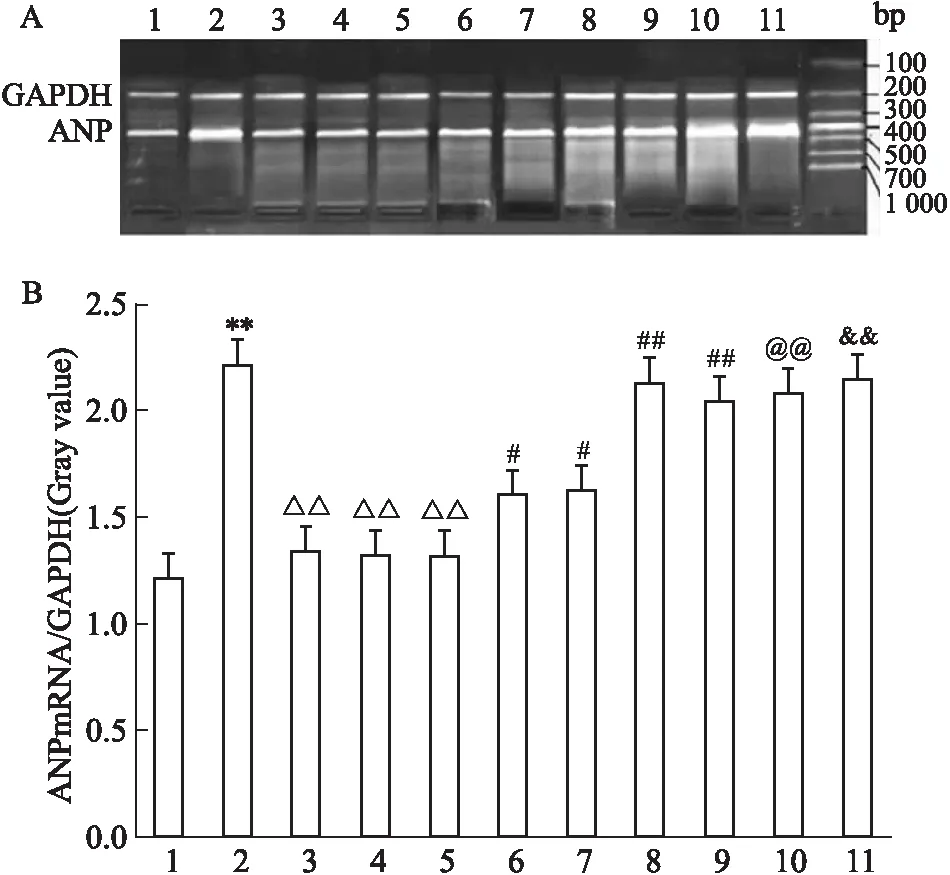
Fig 2 Effects of different agents on expression of ANPmRNA of cultured cardiacmytes induced by n=4)
2.3 U50488H对ET-1培养诱导的心肌细胞p-ERK相对表达含量的抑制作用ET-1组与对照组相比,心肌细胞ERK1/2表达含量明显增多;与ET-1组相比,U50488H(1 μmol·L-1)、U0126(1 μmol·L-1)、Ro-31-8220(50 nmol·L-1)均可明显使ET-1诱导的心肌细胞p-ERK相对表达含量减少,且三者差异无统计学意义;当U0126(1 μmol·L-1)或Ro-31-8220(50 nmol·L-1)存在时,U50488H(1 μmol·L-1)可以使心肌细胞p-ERK相对表达减少的现象被部分抑制;但当用PTX(5 mg·L-1)预处理时,U50488H(1 μmol·L-1)使ET-1诱导的心肌细胞p-ERK相对表达含量减少的现象基本消失;当用NOR-BNI(1 μmol·L-1)预处理时,U50488H(1 μmol·L-1)、U0126(1 μmol·L-1)、Ro-31-8220(50 nmol·L-1)使ET-1诱导的心肌细胞p-ERK相对表达含量减少的现象基本消失,且三者差异无统计学意义(Fig 3)。
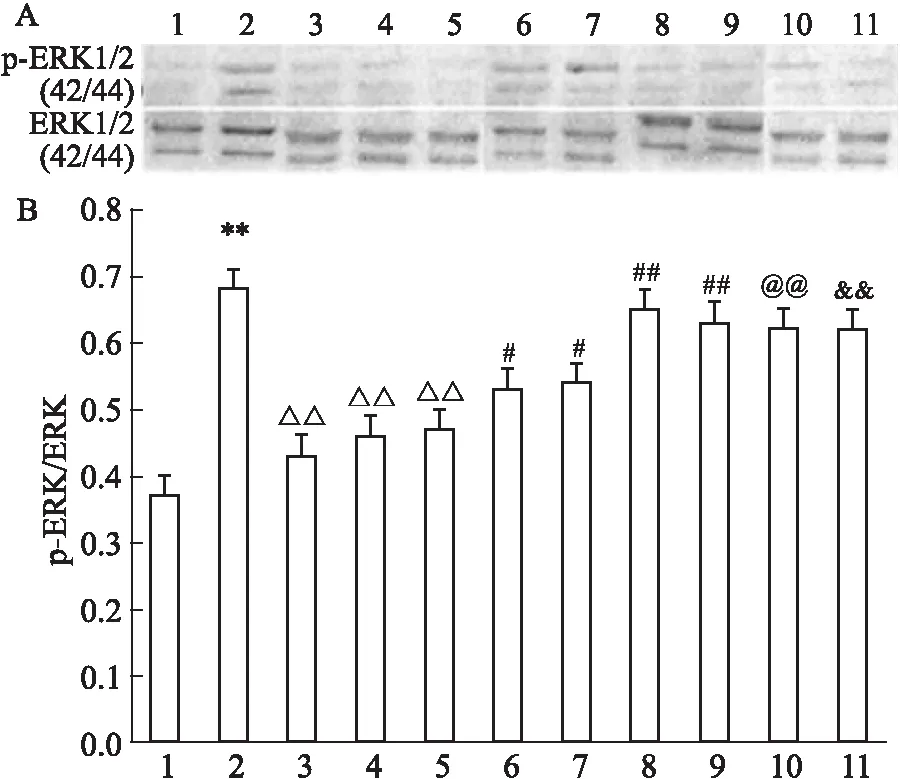
Fig 3 Effects of different agents on p-ERK relative expression of cultured cardiacmytes induced by n=4)
2.4 U50488H对ET-1培养诱导的心肌细胞形态的影响ET-1组与对照组相比,心肌细胞明显增大,形态变化不规则;与ET-1组相比,U50488H(1 μmol·L-1)、U0126(1 μmol·L-1)、Ro-31-8220(50 nmol·L-1)均可明显使ET-1诱导的心肌细胞变小,且形态变化相对规则;当U0126(1 μmol·L-1)或Ro-31-8220(50 nmol·L-1)存在时,心肌细胞变小现象减弱,形态稍不规则;但当用PTX(5 mg·L-1)预处理时心肌细胞变大;当用NOR-BNI (1 μmol·L-1)预处理时,U50488H(1 μmol·L-1)、U0126(1 μmol·L-1)、Ro-31-8220(50 nmol·L-1)使心肌细胞变小现象基本消失(Fig 4)。
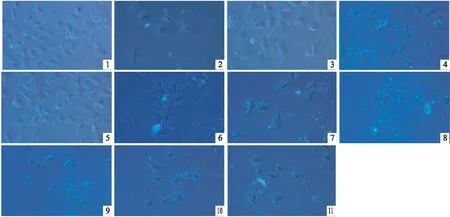
Fig 4 Effects of different agents on cell morphology of cultured cardiacmyocytes induced by ET-1(n=24)
3 讨论
多种心血管疾病都可造成心肌的代偿性肥大,早期的心肌肥大是有利的,是一种适应疾病的病理表现。但这种肥大如果未被合理干预,持续进行下去则会最终发展为不可逆转的心力衰竭、心律失常甚至猝死等一系列心脏的严重不良结局。多种原因均可以造成心肌肥大,但具体分子机制尚不清楚,多篇文献证明,各种信号转导通路通过胞内Ca2+耦联产生作用。在心肌细胞受到机械牵拉或心脏负荷被动增加时会代偿的导致心肌肥大,此时心肌细胞内的Ca2+浓度是增加的;各种体液因子包括AngⅡ、苯肾上腺素、内皮素1等所致的心肌细胞的肥大反应过程内,心肌细胞内的Ca2+均是增加的[11]。内皮素是一种活性多肽,总共含有21个氨基酸,是经过血管内皮细胞和心肌细胞等合成分泌的,有3个异构体:ET-1、ET-2和ET-3,目前研究较多的是ET-1,主要由ET-A和ET-B两个受体亚型调节。这两种受体均属于G蛋白偶联家族中的一员,ET-1与心肌细胞膜上的ET-A特异性受体结合后通过与G蛋白耦联,激活IP3/Ca2+信号传递即PLC-PIP2-IP3-Ca2+途径,接着激活PKC,使细胞内Ca2+浓度升高并激活细胞内的早反应原癌基因如c-fos、c-myc、c-jun、Egr-1、Ras-等核内信使或转录调节因子,进而调控次级反应基因,以促成心肌蛋白质合成,细胞体积增加最终引起心肌肥厚[12-14]。OR是7次跨膜G蛋白偶联受体,有证据显示κ-OR抑制心肌肥大的作用有细胞外信号调节激酶通路的参与。那么,κ-OR激活抑制ET-1诱导的心肌肥大时也有可能与细胞外信号调节激酶通路有关。
本研究结果显示,ET-1可以增大心肌细胞的体积,增多心肌细胞内的ANP-mRNA,增多心肌细胞内的ERK1/2表达,增大心肌细胞的形态,表明造模成功。U50488H应用时心肌细胞肥大受到抑制,且细胞内的ERK1/2表达明显减少,这表明U50488H对ET-1诱导的心肌肥大的抑制作用可能与细胞外信号调节激酶通路参与有关。后续试验表明,当细胞外信号调节激酶通路的抑制剂U0126同时应用时,U50488H抑制ET-1诱导的心肌肥大的作用减弱,提示U50488H对ET-1诱导的心肌肥大的抑制作用可能确实有细胞外信号调节激酶通路的参与。但是,当κ-OR阻滞剂NOR-BNI参与时,U0126对心肌细胞的抑制作用并未完全消失,表明U0126对U50488H的抑制作用未被完全阻断,该抑制作用可能还有其他通路参与,细胞外信号调节激酶通路并不是唯一途径,当然这有待更进一步的研究。研究发现[15-16]阿片肽通过激动κ-OR从而抑制心肌肥大,心肌κ-OR兴奋可以激活PTX-敏感性G蛋白-DAG-IP3途径,而由DAG激活的PKC通过磷酸化激活下游蛋白激酶级联而调节基因表达。PKC活化可引起MAPK,并进一步激活ERK通路中多种下游蛋白激酶的活化,从而调控细胞生长。而本研究中,PKC抑制剂Ro-31-8220对ET-1诱导的心肌肥大有抑制作用,且抑制程度与U50488H相似,但当预先应用PTX处理时,U50488H对ET-1诱导的心肌肥大的抑制作用则几乎完全消失,由此可见,阿片肽可能正是通过PTX-敏感性G蛋白抑制胞外信号调节激酶通路的上游元件PKC的激活进而抑制心肌细胞肥大。
总之,本研究表明κ-OR的激动剂U50488H对ET-1诱导的心肌肥大的抑制作用可能是通过PKC激活胞外信号调节激酶通路实现的。这为阿片肽对心肌肥厚的抑制作用指明了一个新的研究方向,也为心肌肥厚的临床实践找到了一个新的作用靶点。但是胞外信号调节激酶通路究竟如何抑制心肌肥厚的机制尚不明确。与其他通路是否有交互作用亦不明了,均有待更深入的研究以证实。
