双嘧达莫自乳化颗粒剂的制备及质量评价
2022-06-08高春华
包 品,高春华
1.大连市第三人民医院药剂部,大连 116033;2.锦州医科大学药学院,锦州 121099
双嘧达莫(DIP)具有防止血小板聚集、扩张冠状动脉的作用,临床上用于治疗中风术后并发症[1]。DIP在生物药剂学分类系统(BCS)中属于Ⅱ类药物,其在低pH值溶液中溶解度较高,随着pH值升高溶解度迅速降低[2],生物利用度较差,且个体间差异性较大(18%~43%)[3]。自乳化释药系统(SMEDDSs)具有增加药物溶解度和溶出速度[4]、提高药物口服生物利用度[5]、减小个体间差异的优势[6],且生产工艺简单,易于工业化生产,受到广泛关注[7]。本研究将DIP制备成DIP-SMEDDSs,并进一步制备成颗粒剂[8],为提高DIP的口服生物利用度、减小个体间差异提供一种有效的解决方案。
1 仪器与试药
1.1 仪器
ZNCL-BS-X19型数显磁力搅拌器(河南爱博特科技发展有限公司);Zetasizer Nano ZS 90型激光粒度仪(英国马尔文公司);TG18G高速离心机(上海赫田科学仪器有限公司);JEM-2100F型透射电镜(日本电子株式会社);RT600溶出度仪(深圳市锐拓仪器设备有限公司);SYC-A数显水浴恒温振荡器(常州金坛精达仪器制造有限公司)。
1.2 试药
双嘧达莫(台山市新宁制药有限公司);蓖麻油、聚氧乙烯蓖麻油(Cremophor EL 35)、聚氧乙烯氢化蓖麻油(Cremophor RH 40)、辛酸/癸酸三酰甘油(Miglyol 812)、聚乙二醇硬脂酸酯(Solutol HS 15)和聚乙烯聚吡咯烷酮(PVPP),均由巴斯夫应用化工有限公司惠赠;聚氧乙烯8辛酸/癸酸酯(Labrasol)、丙二醇单辛酸酯(Capryol 90)、肉豆蔻酸异丙酯(IPM)、中链三酰甘油(MCT)、二乙二醇单乙基醚(Transcutol P),单辛酸甘油酯(Capmul MCM C8)和辛酸/癸酸甘油酯(Capmul MCM),均由嘉法狮贸易有限公司惠赠;聚乙二醇400(PEG400)和甘油,均由上海化学试剂公司惠赠;吐温-80(Tween-80,南京化学试剂公司);丙二醇(四川金山制药有限公司);油酸乙酯(国药集团化学试剂公司);微晶纤维素(KG 802,日本旭化成株式会社);甘露醇(法国罗盖特公司);胶体二氧化硅(赢创特种化学有限公司);硬脂酸镁(安徽山河药用辅料股份有限公司);其他试剂均为分析纯。
2 方法与结果
2.1 DIP-SMEDDSs的处方研究
2.1.1DIP的平衡溶解度 将过量的DIP加入到装有不同溶液的小瓶中,密封,涡旋混合后置于37 ℃水浴中连续振荡48 h,静置2 h,以5 000 r·min-1离心20 min,取上清液用甲醇稀释,经高效液相色谱(HPLC)法[9]检测药物含量,计算溶解度。每份样品测定3次,取平均值。见表1。
由油类、表面活性剂、助表面活性剂和药物构成的SMEDDSs在制备与存放期间不会出现药物沉淀或分层现象,因此要求辅料对药物具有足够高的溶解能力[10]。由表1可知,DIP在Miglyol 812、Capmul MCM和Capryol 90中的溶解度高于其他油类。因此,选择这3种油相进一步研究;在所考察的表面活性剂中Solutol HS 15和Labrasol对药物的溶解性最好,因此,选择Solutol HS 15和Labrasol作为表面活性剂进一步研究;助表面活性剂可以渗透到表面活性剂界面膜中进一步降低界面张力并提高界面膜的稳定性[11],在所考察的助表面活性剂中丙二醇对DIP的溶解性最好,因此选择丙二醇作为助表面活性剂做进一步研究。

表1 双嘧达莫在不同辅料中的溶解度
2.1.2配伍实验 分别按照质量比为4∶2∶4、4∶3∶3、4∶4∶2精密称取油相(Miglyol 812、Capmul MCM和Capryol 90)、表面活性剂(Solutol HS 15和Labrasol)和助表面活性剂(丙二醇),涡旋混合5 min,静置12 h,离心后观察样品的外观;取未出现分层或浑浊的样品0.2 mL加入pH1.2盐酸溶液50 mL(37 ℃),以50 r·min-1磁力搅拌,观察澄清度和相分离情况并记录乳化时间,根据自乳化性能分为以下5个等级[12]:A.在1 min内快速形成微乳,外观为澄清或淡蓝色;B.在1 min内形成微乳,外观略不澄清,呈蓝白色;C.在2 min内形成乳液,外观为亮白色,类似牛奶状;D.超过2 min形成乳液,外观为灰白色,液面漂浮有油滴;E.很难乳化,有大量油滴漂浮在液面。见表2。
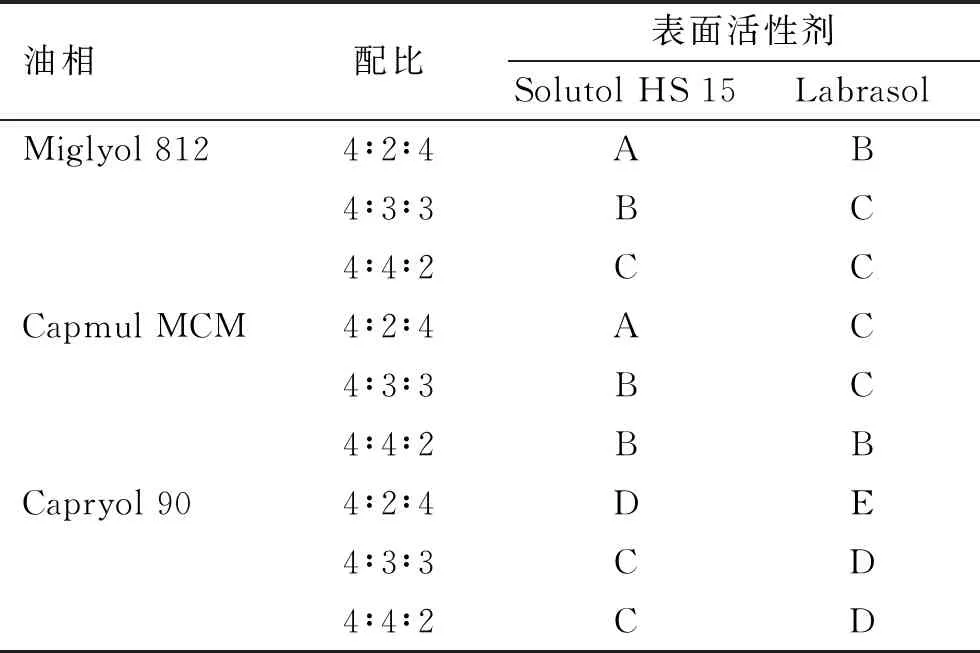
表2 配伍实验结果
实验结果显示,在所选择的配比范围内,油相Capmul MCM与表面活性剂Solutol HS 15配伍较好,自乳化后形成的微乳澄清并略呈淡蓝色,而其他油相与表面活性剂乳化效果略差,形成的乳液呈亮/灰白色,或者液面漂油。因此本研究选择Capmul MCM作为油相,Solutol HS 15作为表面活性剂,丙二醇作为助表面活性剂,采用伪三相图方法确定DIP-SMEDDSs的处方。
2.1.3伪三元相图的构建 采用水滴定法[13]绘制油/表面活性剂/助表面活性剂的伪三元相图。见图1。将表面活性剂和助表面活性剂按照质量比(Km)为1∶2、1∶1、2∶1、3∶1的比例混合,作为混合表面活性剂(Smix),取该混合物分别与油相按照9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9的比例混合,每份样品各取0.2 mL,加入pH1.2盐酸溶液50 mL(37 ℃),以50 r·min-1磁力搅拌,当溶液变为澄清时记录加入纯化水的质量。
由图1可知,随着Km的增加,自乳化区域面积逐步增大,但是继续增大Km为4∶1时,形成了黏度较大的液体,因此没有进一步研究。根据伪三元相图结果,确定表面活性剂和助表面活性剂的质量比为3∶1,DIP-SMEDDSs的处方组成为:Capmul MCM为油相,Solutol HS 15为表面活性剂,丙二醇为助表面活性剂,配比为6∶3∶1。

图1 油/混合表面活性剂/水构成的伪三元相图
2.2 DIP-SMEDDSs的制备
按照处方比例称取Capmul MCM 6 g、Solutol HS 15 3 g和丙二醇1 g,加入到具塞试管中,涡旋混合,形成透明状黏稠油性溶液;称取DIP 200 mg加入到上述溶液中,涡旋混合,直至药物完全溶解,即得DIP-SMEDDSs,备用。
2.3 DIP-SMEDDSs颗粒剂的制备
称取KG 802 100 g,置于研钵中,将DIP-SMEDDSs 10 g滴加到KG 802中,边滴加边研磨,均匀分散,20目筛网整粒,即得到DIP-SMEDDSs颗粒;另称取甘露醇50 g,PVPP 7.5 g,胶体二氧化硅1.5 g,硬脂酸镁1.0 g,与DIP-SMEDDSs颗粒剂混合均匀,分装,即得DIP-SMEDDSs颗粒剂。
2.4 DIP-SMEDDSs及颗粒剂质量评价
2.4.1粒径分布和Zeta电位测定 取DIP-SMEDDSs 0.2 mL,加入蒸馏水50 mL,磁力搅拌形成微乳液,取少量上述溶液加入蒸馏水适当稀释后置于聚苯乙烯样品池中,采用Malvern Zetasizer Nano ZS90纳米粒径分析仪测定微乳的粒径分布和Zeta电位,每份样品测定3次,取平均值。
测定结果显示,DIP-SMEDDSs自乳化可形成粒径为(127.8±6.7) nm的微乳,多聚分散系数(PDI)为(0.108±0.004),粒径分布较均匀;微乳的Zeta电位为(-26.7±0.6) mV,表面带有负电荷且绝对值较大,说明微乳间存在较大的静电斥力,有利于体系稳定[14]。

图2 DIP-SMEDDSs的粒径分布和Zeta电位
2.4.2微观形态 取DIP-SMEDDSs 0.2 mL,加入蒸馏水50 mL,磁力搅拌形成微乳液,将上述溶液加蒸馏水稀释后,用滴管滴加几滴样品到覆盖有支持膜的200目铜网上,用滤纸在边缘处吸取多余水分,红外灯下干燥,再用20 mg·mL-1磷钨酸钠复染5 min,红外灯下干燥后,在透射电镜下观察样品的微观形态,并拍摄照片。见图3。由图3可知,DIP-SMEDDSs自乳化形成的微乳大小均匀,大部分粒径在100~150 nm范围内,且分散较好,无聚集,在视野内未发现有药物沉淀。

图3 DIP-SMEDDSs自乳化形成的微乳透射电镜照片
2.4.3热力学稳定性研究 分别通过离心和冻融实验评价DIP-SMEDDSs的热力学稳定性[15]。取DIP-SMEDDSs置于离心管中,以10 000 r·min-1离心30 min,观察外观并测定DIP-SMEDDSs的乳化效果;另取DIP-SMEDDSs在-20 ℃、40 ℃之间进行3次冻融循环(每个温度下储存不少于48 h),之后将样品以3 000 r·min-1离心5 min,观察外观并测定DIP-SMEDDSs的乳化效果,结果见表3。

表3 DIP-SMEDDSs的热力学稳定性结果
实验结果显示,DIP-SMEDDSs经高速离心及冻融处理后,均未观察到相分离或任何药物沉淀现象;每组样品各取DIP-SMEDDSs 0.2 mL,加入pH1.2盐酸溶液50 mL(37 ℃),以50 r·min-1磁力搅拌,自乳化时间均小于1 min,且形成的微乳外观均呈淡蓝色澄明状,各组的微乳粒径无差异,说明DIP-SMEDDSs的热力学稳定性良好。
2.4.4DIP-SMEDDSs及颗粒剂性质比较 取DIP-SMEDDSs 0.2 mL,加入蒸馏水50 mL,磁力搅拌形成微乳液;另取DIP-SMEDDSs颗粒剂加入适量蒸馏水,磁力搅拌5 min,样品经4 000 r·min-1离心10 min,上层为微乳液。取2份微乳,采用Malvern Zetasizer Nano ZS90纳米粒径分析仪测定粒径分布和Zeta电位。每份样品测定3次,取平均值,结果见表4。

表4 DIP-SMEDDSs及颗粒剂性质比较
实验结果显示,DIP-SMEDDSs制备成颗粒剂后形成的微乳Zeta电位未发生变化,但粒径分布和PDI均出现增大趋势,这可能是由于DIP-SMEDDSs与KG 802存在一定的相互作用,颗粒剂在加水稀释时部分微乳发生融合,导致粒径增大。
2.5 体外溶出研究
使用桨法比较DIP-SMEDDSs颗粒剂和市售DIP片剂的体外溶出速率,介质分别选择pH1.2盐酸溶液、pH2.0盐酸溶液、pH4.5醋酸盐缓冲液和pH6.8磷酸盐缓冲液,介质体积为900 mL,水浴温度为37 ℃±0.5 ℃,桨板转速为(50±1) r·min-1,取DIP-SMEDDSs颗粒剂和市售DIP片剂分别加入到溶出杯中,定时取出介质溶液5 mL(同时补加同温同体积对应空白介质溶液),经0.22 μm微孔滤膜过滤,取续滤液适当稀释后用HPLC法检测药物含量,绘制药物溶出曲线。见图4。
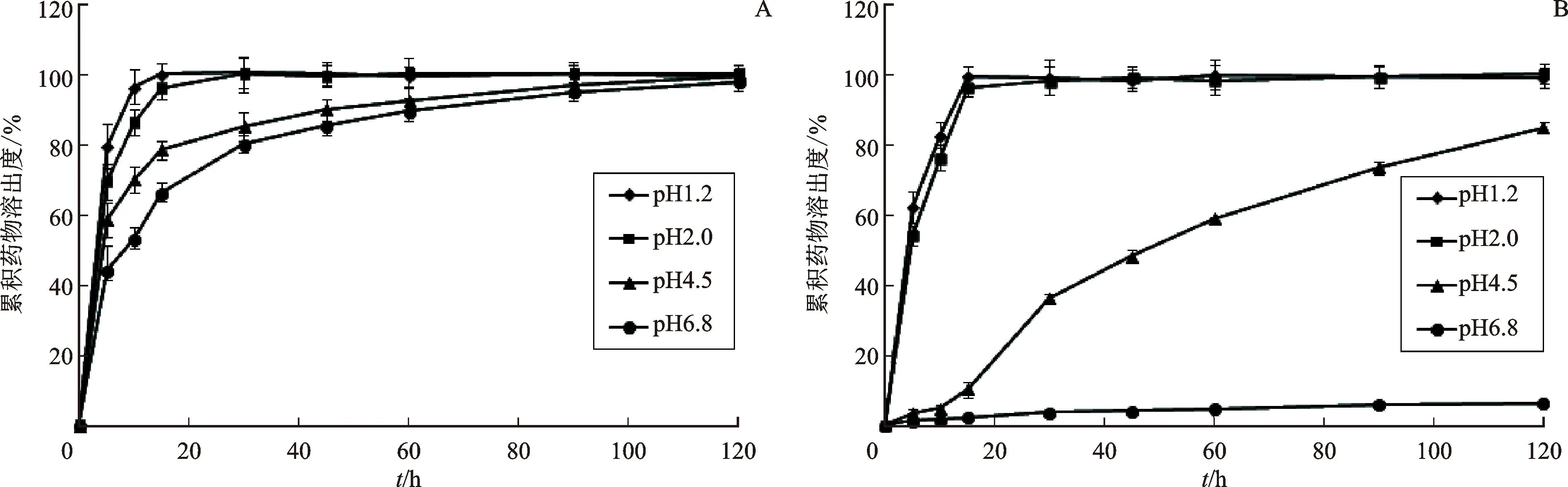
图4 DIP-SMEDDSs颗粒剂(A)和市售DIP片剂(B)在4种溶出介质中的溶出曲线
溶出实验结果显示,在pH1.2和2.0的盐酸介质溶液中,DIP-SMEDDSs颗粒剂和市售DIP片剂在10 min内均完全溶出,而随着溶出介质pH值的升高,市售DIP片剂中的药物溶出速率明显减慢,当溶出介质pH值为6.8时,药物基本不溶出;虽然DIP-SMEDDSs颗粒剂中的药物随着溶出介质pH值的升高药物溶出速率也在减慢,但是在pH 6.8溶出介质中120 min内药物能够完全溶出。
2.6 体外沉淀研究
通过体外溶出实验比较了DIP-SMEDDSs颗粒剂和市售DIP片剂的沉淀现象[16]。取pH1.2盐酸溶液700 mL,水浴温度为37 ℃±0.5 ℃,桨板转速为(50±1) r·min-1,分别将DIP-SMEDDSs颗粒剂和市售DIP片剂加入到溶出杯中,2 h后将浓度为0.2 mol·L-1的磷酸钠溶液200 mL加入到溶出杯中,并调节pH值至6.8,继续进行溶出实验,在规定的时间点取出介质溶液5 mL(同时补加同温同体积对应空白介质溶液),经0.22 μm微孔滤膜过滤,取续滤液适当稀释后用HPLC法检测药物含量,绘制药物溶出曲线。见图5。
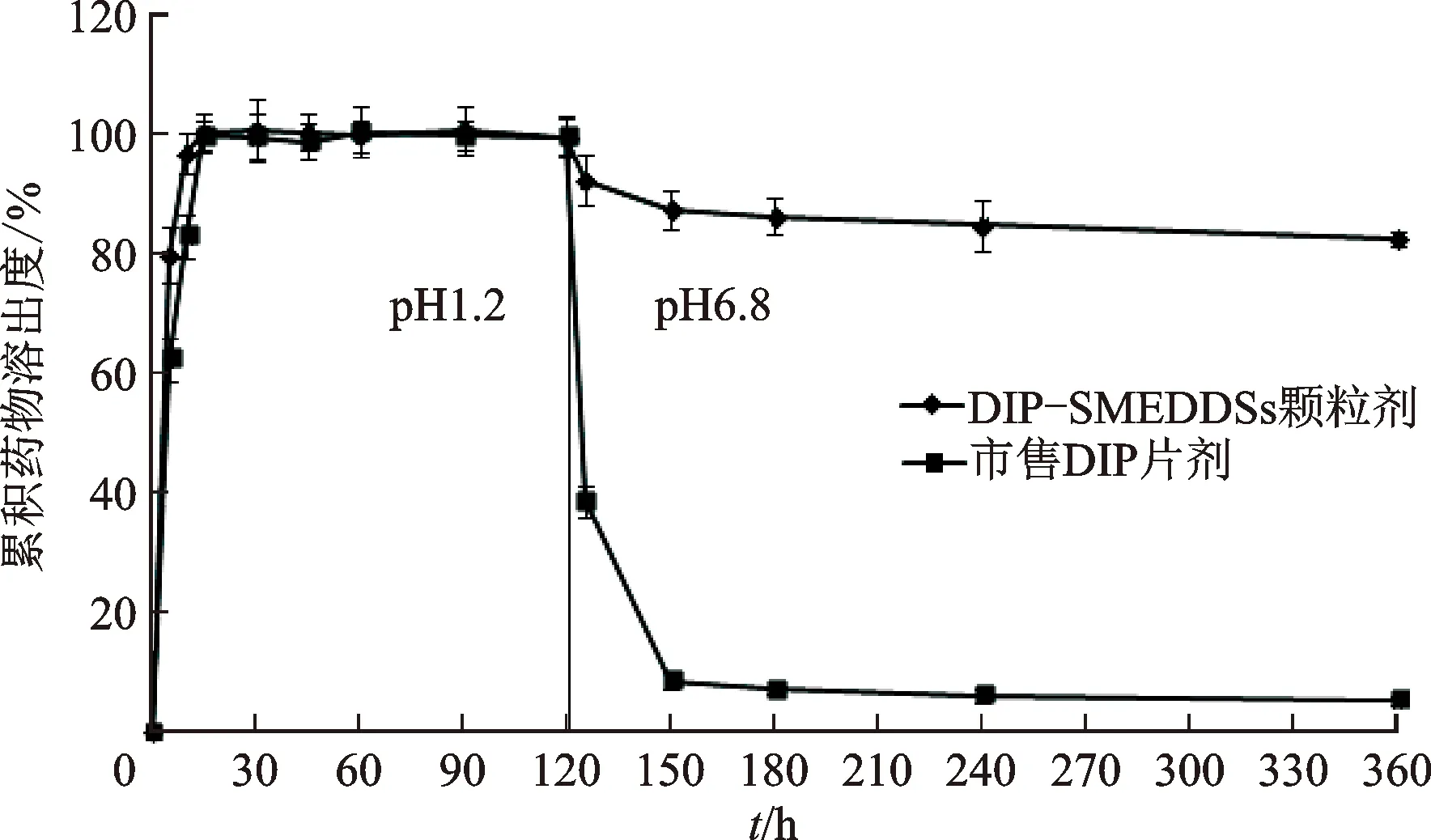
图5 DIP-SMEDDSs颗粒剂和市售DIP片剂在模拟体内介质中的药物溶出曲线
体外沉淀实验结果显示,DIP-SMEDDSs颗粒剂和市售DIP片剂在pH1.2盐酸介质溶液中的药物溶出速率基本一致,均为快速、完全溶出;但当介质溶液的pH值升高到6.8后,市售DIP片剂中的药物浓度急剧降低,说明大量药物析出沉淀;而DIP-SMEDDSs颗粒剂中的药物在溶出介质pH值升高到6.8后溶出介质中的药物浓度也出现了降低的趋势,但是药物浓度依然很高,说明只有少部分药物析出。本研究将DIP制备成DIP-SMEDDSs后可有效抑制因环境pH改变而导致的DIP析出结晶的问题,对药物吸收有利,有望提高药物的生物利用度[17]。
3 讨论
本研究根据DIP在不同油相、表面活性剂和助表面活性剂中的溶解度以及各辅料的配伍实验结果,初步确定了DIP-SMEDDSs的处方组成,并进一步通过绘制伪三元相图,最终确定DIP-SMEDDSs的处方组成为:Capmul MCM为油相,Solutol HS 15为表面活性剂,丙二醇为助表面活性剂,配比为6∶3∶1。
DIP溶解度具有pH值依赖性,是药物生物利用度低的主要原因[18]。本研究成功地将DIP制备成DIP-SMEDDSs,体外溶出研究显示,DIP-SMEDDSs在pH6.8介质溶液中的溶出度显著改善,而且在介质溶液中的pH值由低升高过程中,DIP-SMEDDSs中的药物沉淀量明显低于市售制剂,可促进药物更好地吸收。本研究也为具有DIP类似性质的药物改善其生物利用度奠定了良好的理论基础。
