白藜芦醇苷对IgA肾病大鼠炎性因子及肾功能的影响
2022-06-08于建军员文静曲矿云徐亚沛
于建军,王 慧,员文静,曲矿云,徐亚沛
1.黄河三门峡医院肾内科,三门峡 472000;2.黄河三门峡医院急诊科,三门峡 472000;3.郑州市第三人民医院肾内科,郑州 450000
IgA肾病是一种常见的原发性肾小球肾炎疾病,主要特征为多聚IgA分子及其免疫复合物在肾小球系膜沉积[1]。炎性反应与IgA肾病的发生和发展密切相关,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6和IL-1β等炎症因子可促进IgA的沉积[2]。白藜芦醇苷是广泛存在于植物内的一种多酚类化合物,具有抗氧化、抗炎等作用[3-4]。研究表明,白藜芦醇苷可通过减轻炎性反应、减少血清中肌酐和血尿素氮的含量,从而防止肾缺血再灌注损伤的发生[5]。本研究用动物实验验证白藜芦醇苷对IgA肾病大鼠肾的保护作用,以及对炎性反应的影响。
1 仪器与材料
1.1 仪器
Axio Vert.A1型光学显微镜[卡尔蔡司光学(中国)有限公司];MultiskanTMFC型酶标仪(美国赛默飞世尔科技有限公司);AU5800型生化分析仪(贝克曼库尔特商贸有限公司);化学发光成像仪(美国Invitorgen公司)。
1.2 试药
白藜芦醇苷(批号190126,上海阿拉丁生化科技股份有限公司);TNF-α、IL-6和IL-1βELISA试剂盒(批号分别为190315、190221、190417,厦门慧嘉生物科技有限公司);葡萄球菌肠毒素B(批号SYA041,北京百奥莱博科技有限公司);FITC标记的IgA抗体(批号190323,北京迈瑞达科技有限公司);兔抗大鼠Notch1、Jagged1一抗和山羊抗兔二抗(批号分别为ab167441、ab7771、ab109489,美国Abcam公司)。
1.3 动物
SPF级雄性SD大鼠48只,8周龄,体质量(220±10) g,购自北京维通利华实验动物技术有限公司。所有大鼠均饲养于温度为(25±2) ℃、湿度为50%~60%的SPF环境中,高压灭菌的水和饲料随意饮食。本实验方案经郑州市第三人民医院实验动物中心批准。
2 方法
2.1 实验动物分组和建模
将48只雄性SD大鼠随机分为4组:空白对照组、IgA肾病模型组、白藜芦醇苷组和氯沙坦组,每组12只。参照文献中的方法[6]建立IgA肾病模型。大鼠适应性饲养1周后,IgA肾病模型组、白藜芦醇苷组和氯沙坦组大鼠灌服牛血清白蛋白100 mg·kg-1·d-1。6周后,尾静脉注射经生理盐水稀释的牛血清白蛋白10 mg·kg-1,每周1次,连续注射3次。自第8周起,尾静脉注射葡萄球菌肠毒素B 0.4 mg·kg-1,每周1次,连续注射3次。自第9周起,白藜芦醇苷组以20 mg·kg-1·d-1白藜芦醇灌胃,氯沙坦组以16.8 mg·kg-1·d-1氯沙坦灌胃,2种药品均用生理盐水溶解后灌入。空白对照组和IgA肾病模型组灌入等体积的生理盐水,连续处理8周。
2.2 24 h尿蛋白检测
末次干预后,收集所有大鼠24 h的尿液,记录尿量。采用尿蛋白试剂盒(比色法)检测尿蛋白的浓度。24 h尿蛋白=尿蛋白浓度×24 h尿量。
2.3 ELISA检测血清中炎性因子IL-1β、IL-6和TNF-α的水平以及血肌酐、尿素氮的含量
各组大鼠灌胃8周后,用戊巴比妥钠麻醉,腹主动脉采血8 mL,37 ℃水浴30 min后,以3 000 r·min-1离心5 min,分离上清液,保存于-20 ℃。IL-1β、IL-6和TNF-α的检测根据ELISA试剂盒说明书进行操作,将对照品梯度稀释后,每组设置5个复孔,依次加入100 μL样品,孔板覆膜后置于37 ℃孵育。孵育1 h后,弃去上清液,依次加入抗体工作液和酶结合液,37 ℃孵育30 min。加入显色液,避光孵育10 min,加入终止液,用酶标仪检测各孔在450 nm波长处的吸光度(A)。血肌酐、尿素氮的含量用全自动生化分析仪进行检测。
2.4 HE染色观察肾组织病理学变化
取血后,剥离肾脏,取每组6只大鼠的肾脏放入福尔马林中固定24 h。经过常规脱水、浸蜡、包埋和切片(厚度4 μm)后,进行HE染色。于光学显微镜下观察各组大鼠肾组织的病理学变化。
2.5 免疫荧光法检测肾组织中IgA沉淀情况
肾切片用磷酸盐缓冲生理盐水(phosphate buffered saline,PBS)漂洗3次,每次3 min,滴加经异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的IgA抗体(1∶50),37 ℃孵育1 h后,用PBS漂洗3次,每次5 min,用甘油封片。于荧光显微镜下观察IgA沉淀情况。
2.6 Western blot检测肾组织中Notch信号通路蛋白的表达水平
将各组剩余6只大鼠的肾组织制成匀浆(90 Hz,5 min),加入放射免疫沉淀测定(radioimmunoprecipitation assay,RIPA)缓冲液和苯甲基磺酰氟(phenylmethanesulfonylfluoride or phenylmethylsulfonyl fluorid,PMSF)抑制蛋白降解液(100∶1)将样本裂解后提取各组总蛋白。用BCA试剂检测蛋白质的总浓度,将各组总蛋白的浓度调为一致后,将其于100 ℃进行变性后保存于-20 ℃。用SDS-PAGE电泳分离总蛋白后,将其转至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜。用质量浓度为50 g·L-1的脱脂牛奶封闭2 h,用TBST洗涤3次,每次10 min后,将其放入对应的一抗(Notch1、Jagged1和GAPDH)和一抗稀释混悬液(1∶1 000)中,4 ℃孵育过夜。再用TBST洗涤3次,放入二抗和二抗稀释液(1∶4 000)混悬液中,室温孵育2 h。用TBST洗涤3次,每次10 min,将超敏发光液ECL滴在PVDF膜上,放入化学发光成像仪进行蛋白显影。用Image J软件分析结果,以GAPDH为内参对蛋白表达量进行标准化。
2.7 统计学方法

3 结果
3.1 各组大鼠24 h尿蛋白的比较
与空白对照组[(37.89±1.94) μg]比较,IgA肾病模型组24 h尿蛋白[(225.37±4.84) μg]显著增加(P<0.05)。与IgA肾病模型组比较,白藜芦醇苷组[(84.37±2.51) μg]和氯沙坦组[(72.27±1.81) μg]24 h尿蛋白显著降低(P<0.05)。氯沙坦组24 h尿蛋白与白藜芦醇苷组比较,差异无统计学意义(P>0.05)。
3.2 各组大鼠血清炎性因子的比较
IgA肾病模型组大鼠血清中IL-1β、IL-6和TNF-α的水平明显高于空白对照组(P<0.05)。白藜芦醇苷组和氯沙坦组IL-1β、IL-6和TNF-α的水平均显著低于IgA肾病模型组(P<0.05);氯沙坦组IL-1β、IL-6和TNF-α的水平与白藜芦醇苷组比较,差异无统计学意义(P>0.05)。结果见表1。
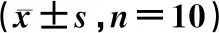
表1 大鼠血清炎性因子含量的比较
3.3 各组大鼠肾功能指标的比较
IgA肾病模型组大鼠血清中血肌酐、尿素氮的含量均明显高于空白对照组(P<0.05)。白藜芦醇苷组和氯沙坦组血肌酐、尿素氮的含量均显著低于IgA肾病模型组(P<0.05);氯沙坦组血肌酐、尿素氮含量与白藜芦醇苷组比较,差异无统计学意义(P>0.05)。结果见表2。
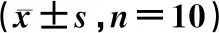
表2 大鼠血肌酐、尿素氮含量的比较
3.4 各组大鼠肾组织病理学的比较
HE染色结果见图1。由图1可见,空白对照组大鼠肾小球结构清晰,系膜细胞和基质未出现增生现象。IgA肾病模型组大鼠肾组织肾小球系膜细胞和基质发生弥漫性增生,局灶性系膜细胞增生,肾小管灶状萎缩,伴有纤维化。

注:A.空白对照组;B.IgA肾病模型组;C.白藜芦醇苷组;D.氯沙坦组。
白藜芦醇苷组和氯沙坦组肾小球系膜细胞和基质弥漫性增生情况减轻,局灶性系膜细胞增生较少,无纤维化。
3.5 各组大鼠组织IgA沉积的比较
空白对照组大鼠肾小球系膜区无明显IgA免疫复合物沉积。IgA肾病模型组、白藜芦醇苷组和氯沙坦组均可见IgA免疫复合物沉积,IgA肾病模型组荧光强度显著高于白藜芦醇苷组和氯沙坦组。结果见图2。

注:A.空白对照组;B.IgA肾病模型组;C.白藜芦醇苷组;D.氯沙坦组。
3.6 各组大鼠肾组织Notch信号通路关键蛋白表达水平的比较
Western blot结果显示,与空白对照组比较,IgA肾病模型组Notch1、Jagged1蛋白的表达量显著上升(P<0.05);与IgA肾病模型组比较,白藜芦醇苷组和氯沙坦组Notch1、Jagged1蛋白的表达量显著降低(P<0.05);白藜芦醇苷组与氯沙坦组Notch1、Jagged1蛋白的表达量差异无统计学意义(P>0.05)。结果见图3。

注:A.Western blot检测4组大鼠Notch1、Jagged1蛋白的表达量;B.4组大鼠Notch1、Jagged1蛋白表达量统计。与空白对照组比较,*P<0.05;与IgA肾病模型组比较,#P<0.05。
4 讨论
IgA肾病是临床常见的原发性肾小球疾病,发病率占原发性肾小球疾病的26%~34%[7]。IgA肾病的主要病理机制是肾小球系膜区IgA免疫复合物沉积,肾小球系膜细胞增殖导致肾功能损害,从而使肾功能指标出现异常(血肌酐、尿素氮和24 h尿蛋白增加)[8]。研究表明,炎性因子IL-1β、IL-6和TNF-α参与肾病的发生和发展,主要是由于炎性因子刺激血管内皮因子的分泌,使肾小球系膜细胞增生,增加肾小球内皮细胞通透性,加重肾功能的损伤,影响氮质代谢废物的排泄,使肌酐、尿素氮和24 h尿蛋白水平升高[9-11]。
白藜芦醇苷是具有抗氧化功能的多酚类化合物[12]。白藜芦醇苷可使肌酐、尿素氮和24 h尿蛋白的水平下降,从而延缓糖尿病肾病的进展[13]。研究表明,白藜芦醇苷能够减轻炎性反应,防止肾缺血再灌注损伤的发生[14],但白藜芦醇苷对IgA肾病的作用机制尚不清楚。基于此,本研究探究白藜芦醇苷对IgA肾病大鼠肾功能的影响。本实验结果显示,用白藜芦醇苷干预IgA肾病大鼠模型后,肾病大鼠肾功能指标肌酐、尿素氮和24 h尿蛋白含量显著降低。HE染色和IgA结果显示,白藜芦醇苷可以减轻IgA肾病大鼠肾组织的损伤,并减少IgA的沉积。藜芦醇苷组大鼠肌酐、尿素氮和24 h尿蛋白的含量以及IgA沉淀与氯沙坦组无明显差异,提示白藜芦醇苷与氯沙坦一样,具有修复肾功能的作用。
炎性反应会引起机体发生氧化应激反应,直接损伤肾小管内皮细胞,导致肾小球微血管损伤,促进系膜区异常蛋白的沉积,从而加重肾功能损伤[15-16]。白藜芦醇苷可以降低IgA肾病大鼠炎性因子IL-1β、IL-6和TNF-α的水平,且与氯沙坦组相比差异无统计学意义。为了进一步探究白藜芦醇苷对IgA肾病大鼠作用的机制,本研究检测了IgA肾病大鼠肾组织中Notch信号通路中关键蛋白的表达水平。Notch信号通路与肾病关系密切,其表达水平异常会引起肾间质纤维化和致硬化[17-18]。研究显示,Notch1可以通过促进Jagged1的表达,激活炎性因子的分泌,导致IgA肾病的加重[19-20]。本研究结果显示,白藜芦醇苷通过抑制IgA肾病大鼠肾组织中Notch信号通路中关键蛋白Notch1、Jagged1的表达水平,减轻炎症反应。
综上所述,白藜芦醇苷可抑制Notch信号通路,抑制炎性因子IL-1β、IL-6和TNF-α的表达,减轻肾组织中IgA的沉积,并降低肌酐、尿素氮和24 h尿蛋白的含量,从而发挥对肾功能的修复作用。本研究仅讨论了白藜芦醇苷在IgA肾病大鼠体内的影响,未来将探究白藜芦醇苷在体外实验中的作用,进一步验证上述结论。
