沉默lncRNA SNHG22上调miR-27a-3p增强乳腺癌细胞的耐药性
2022-06-08赵晓燕李军涛
赵晓燕,谢 竞,吴 迪,李军涛
1.郑州大学附属郑州中心医院乳腺外科,郑州 450000;2.河南省肿瘤医院乳腺科,郑州 450000
乳腺癌是女性常见的一种恶性肿瘤,多发生于年轻女性,发病率呈逐年上升的趋势。阿霉素(adriamycin,ADM)是用于治疗乳腺癌的化疗药物。长链非编码RNA(long non-coding RNA,lncRNA)是一类不被翻译成蛋白质的RNA,通过吸附于miRNA在肿瘤细胞增殖、迁移、浸润过程中发挥调控作用[1-2],此外,miRNA可增强癌细胞对化疗药物的敏感性[3-4]。长链非编码RNA核仁小RNA宿主基因22(long non-coding RNA small nucleolar RNA host gene 22,lncRNA SNHG22)与卵巢癌的预后不良和化疗耐药密切相关[5]。miR-27a作为一种致癌基因,其通过在乳腺癌细胞中表达上调,调节细胞的耐药过程[6]。本研究旨在探讨lncRNA SNHG22是否能通过miR-27a调节乳腺癌细胞对ADM的耐药性。
1 仪器与材料
1.1 仪器
超净工作台(沈阳市医疗器械二厂);培养箱(美国NAPCO公司);流式细胞仪(美国Coulter公司)。
1.2 试药
阿霉素(深圳万乐药业有限公司);MTT试剂盒、GAPDH、P-糖蛋白(P-glycoprotein,P-gp)抗体均购自美国Abcam公司;乳腺癌耐药蛋白(breast cancer resistant protein,BCRP/ABCG2)抗体(武汉博士德生物技术有限公司);含有siSNHG22、siSNHG22-NC、SNHG22、SNHG22-NC的pcDNA3.1重组质粒(上海吉玛制药技术有限公司);HRP标记的山羊抗兔二抗(美国Sigma公司);DMEM培养基(美国Gibco公司)。
1.3 细胞
人乳腺癌细胞株MCF-7,购自中国科学院上海生物所。
2 方法
2.1 建立MCF-7/ADM耐药细胞株
将MCF-7细胞培养于含体积分数10%胎牛血清、100 u·mL-1青霉素和100 u·mL-1链霉素的培养基中,置于37 ℃、体积分数5%二氧化碳、饱和湿度的培养箱中培养。待细胞达到90%融合时,用胰蛋白酶消化,传代。
采用ADM低质量浓度加量持续诱导的方法[7]建立MCF-7/ADM耐药细胞株,ADM的质量浓度依次为100、200、300、400、500 ng·mL-1。取处于对数生长期的MCF-7细胞,制成细胞悬液,细胞密度为5×107个·mL-1,取10 mL细胞悬液接种于培养瓶中,24 h后,加入质量浓度为100 ng·mL-1的ADM,置于培养箱中孵育48 h,弃去培养基,用PBS清洗2次,加入新鲜不含ADM的培养基培养48 h,按照上述步骤反复培养,最终MCF-7/ADM耐药细胞系可耐受质量浓度为500 ng·mL-1的ADM。所有耐药实验需在撤去ADM 2周后进行。
2.2 耐药指数测定
分别取处于对数生长期的MCF-7细胞和经不同质量浓度ADM处理的MCF-7/ADM细胞,制成单细胞悬液,细胞密度为1×105个·mL-1,接种于96孔板,每组设置5个复孔,每孔加入细胞悬液100 μL,另设空白组(仅加入培养基)。将细胞置于培养箱中培养24 h后,空白组每孔加入培养基200 μL,MCF-7/ADM组每孔加入含不同质量浓度ADM的培养基200 μL,继续培养72 h,取出96孔板,每孔加入MTS单溶液20 μL,将96孔板置于酶标仪上,于波长490 nm处测得吸光度(A),计算细胞增殖抑制率。细胞增殖抑制率=(1-实验孔A值/对照孔A值)×100%。用50%抑制浓度(IC50)计算软件得出各组IC50值。
耐药指数=耐药细胞IC50值÷亲本细胞IC50
2.3 细胞转染
取处于对数生长期的MCF-7/ADM细胞(用质量浓度为500 ng·mL-1的ADM处理),随机分为MCF-7/ADM组、si-NC组、si-SNHG22组、SNHG22 -NC组和SNHG22组。制成细胞密度为1×105个·mL-1的细胞悬液,接种于96孔板,每孔加入细胞悬液1 mL。置于培养箱中培养,待细胞贴壁生长后,si-NC组转染阴性对照质粒,si-SNHG22组转染SNHG22沉默质粒,SNHG22-NC组转染SNHG22过表达阴性对照质粒,SNHG22组转染SNHG22过表达质粒。24 h后,在显微镜下观察转染效果,当转染成功率达到85%时,进行后续实验。
2.4 MTT法检测细胞存活率
转染成功后继续培养24 h,加入质量浓度为5 mg·mL-1的MTT 20 μL,37 ℃避光振荡10 min,置于酶标仪上,测定490 nm波长处的吸光度(A),计算细胞存活率。细胞存活率=(药物组A值/空白组A值)×100%。
2.5 流式细胞仪检测细胞凋亡率
转染成功后继续培养24 h,用胰蛋白酶消化,以3 000 r·min-1离心10 min,离心半径为8 cm,收集细胞。用500 μL binding buffer重悬细胞,加入annexin V-FITC结合液5 μL,混匀,再加入碘化丙啶10 μL混匀,避光冰浴15 min,用流式细胞仪检测细胞凋亡率。
2.6 双荧光素酶报告基因检测lncRNA SNHG22和miR-27a-3p的靶向关系
通过生物信息学分析软件检测到SNHG22与miR-27a-3p存在结合位点。将该结合位点的序列片段进行克隆,插入荧光素酶报告基因质粒中,构建野生型SNHG22报告基因质粒(SNHG22-wt)和突变型SNHG22报告基因质粒(SNHG22-mut)。将2种质粒分别与miR-27a-3p mimic和miR-27a-3p mimic-NC共转染到MCF-7/ADM细胞,培养24 h后,以3 000 r·min-1离心15 min,离心半径为8 cm,用荧光素酶试剂盒检测各组细胞荧光素酶的活性。以海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值反映SNHG22与miR-27a-3p的结合强度。
2.7 qRT-PCR检测miR-27a-3p和lncRNA SNH G22的表达
转染成功后继续培养24 h,用胰蛋白酶消化,以3 000 r·min-1离心15 min,离心半径8 cm,收集细胞。用Trizol试剂盒提取细胞中的总RNA,按照反转录试剂盒说明书中的步骤逆转录出cDNA,配制荧光定量PCR反应体系,95 ℃ 2 min;95 ℃ 30 s;58 ℃ 40 s;共40个循环。用荧光定量PCR仪测定lncRNA SNHG22和miR-27a-3p的表达水平,所有组均进行5次重复操作。分别以GAPDH和U6为内参,用2-CT法计算lncRNA SNHG22和miR-27a-3p相对表达水平。引物序列见表1。

表1 lncRNA SNHG22和miR-27a-3p引物序列
2.8 蛋白印迹法检测耐药蛋白的表达
转染成功后继续培养24 h,收集细胞,加入裂解液,于冰上静置30 min。用BCA试剂盒测定蛋白浓度,加入蛋白上样缓冲液,100 ℃煮沸10 min,使蛋白变性,配制浓缩胶和分离胶,每个样品上样20 μL。120 V恒压电泳1.5 h后,取下凝胶进行湿转,0.3 A恒流湿转2 h。室温封闭1 h,加入P-gp、BCRP、GAPDH一抗(1∶1 000),置于4 ℃孵育过夜,用TBST洗膜3次,每次5 min,加入二抗(1∶5 000)室温孵育2 h,用TBST洗膜3次,每次5 min。用ECL法显色,用Image J软件分析各蛋白条带灰度值,以目的蛋白条带灰度值与GAPDH条带灰度值的比值作为目的蛋白的表达量。
2.9 统计学方法
3 结果
3.1 耐药指数测定结果
MCF-7细胞经不同质量浓度ADM处理后,均出现耐药性,且耐药指数随ADM质量浓度的增大而升高。结果见表2。

表2 各组耐药指数比较
3.2 lncRNA SNHG22相对表达量检测结果
lncRNA SNHG22相对表达量组间比较,差异有统计学意义(P<0.05);与MCF-7/ADM组和si-NC组比较,si-SNHG22组lncRNA SNHG22的相对表达量降低(P<0.05);与MCF-7/ADM组和SNHG22-NC组比较,SNHG22组lncRNA SNHG22的相对表达量升高(P<0.05);与si-SNHG22组比较,SNHG22组lncRNA SNHG22的相对表达量升高(P<0.05)。结果见表3。

表3 各组细胞lncRNA SNHG22表达水平比较
3.3 细胞存活率检测结果
与MCF-7/ADM组比较,si-NC组、si-SNHG22组、SNHG22-NC组细胞存活率的差异无统计学意义(P>0.05);与si-SNHG22组比较,SNHG22组细胞的存活率降低(P<0.05)。结果见表4。

表4 各组细胞存活率比较
3.4 细胞凋亡率检测结果
与MCF-7/ADM组和si-NC组比较,si-SNHG22组细胞的凋亡率降低(P<0.05);与MCF-7/ADM组和SNHG22-NC组比较,SNHG22组细胞的凋亡率升高(P<0.05);与si-SNHG22组比较,SNHG22组细胞的凋亡率升高(P<0.05)。结果见表5。

表5 各组细胞凋亡率比较
3.5 双荧光素酶报告基因检测结果
转染miR-27a-3p mimic可明显抑制SNHG22-wt相对荧光素酶活性,对SNHG22-mut无明显影响。结果见图1、表6。
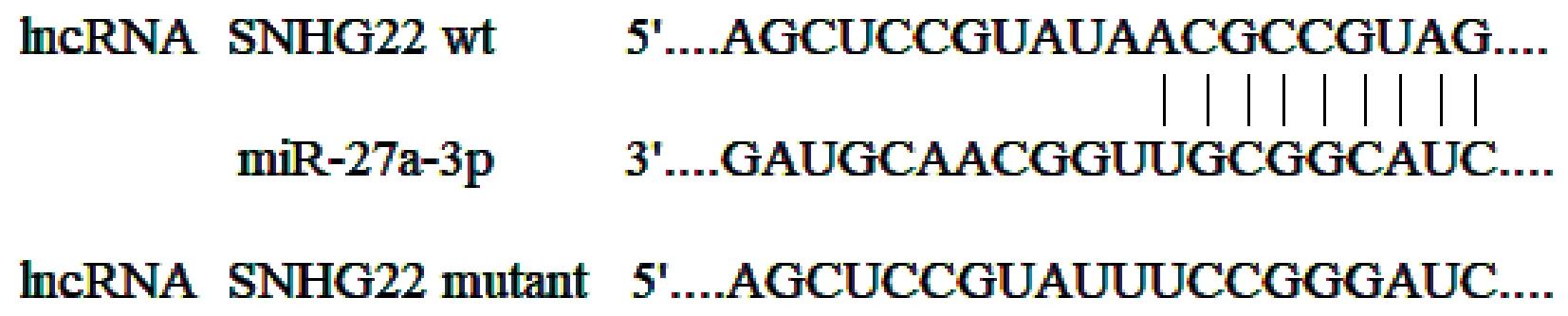
图1 lncRNA SNHG22与miR-27a-3p的结合位点

表6 各组相对荧光素酶活性比较
3.6 miR-27a-3p相对表达量检测结果
miR-27a-3p相对表达量组间比较,差异有统计学意义(P<0.05);与MCF-7/ADM组和si-NC组比较,si-SNHG22组miR-27a-3p的相对表达量升高(P<0.05);与MCF-7/ADM组和SNHG22-NC组比较,SNHG22组miR-27a-3p的相对表达量降低(P<0.05);与si-SNHG22组比较,SNHG22组miR-27a-3p的相对表达量降低(P<0.05)。结果见表7。

表7 各组细胞miR-27a-3p表达量的比较
3.7 耐药蛋白P-gp、BCRP表达量检测结果
P-gp、BCRP蛋白相对表达量组间比较,差异有统计学意义(P<0.05);与MCF-7/ADM组和si-NC组比较,si-SNHG22组P-gp、BCRP蛋白的相对表达量升高(P<0.05);与MCF-7/ADM组和SNHG22-NC组比较,SNHG22组P-gp、BCRP蛋白的相对表达量降低(P<0.05);与si-SNHG22组比较,SNHG22组P-gp、BCRP蛋白的相对表达量降低(P<0.05)。结果见表8、图2。

表8 各组细胞P-gp、BCRP蛋白相对表达量比较

注:A.MCF-7/ADM组;B.si-NC组;C.si-SNHG22组;D.SNHG22-NC组;E.SNHG22组。
4 讨论
乳腺癌是一种高度异质性的恶性肿瘤,在组织形态、生物学行为及免疫表型等方面存在巨大差异,给医疗系统和个人带来了沉重的负担[8]。目前,对于癌症的治疗常以手术切除为主,化疗为辅,但长时间应用化疗药物,导致癌细胞出现耐药性,极大降低化疗药物的治疗效果。癌细胞多药耐药机制复杂,多种因素可导致癌细胞出现耐药性,多药耐药蛋白高表达是主要原因,参芪扶正注射液通过降低多药耐药相关蛋白7增强非小细胞肺癌对紫杉醇和吉西他滨的敏感性[9]。
通过将质量浓度递增的ADM持续作用于乳腺癌MCF-7细胞,建立MCF-7/ADM耐药细胞株,检测耐药指数。结果显示,MCF-7/ADM细胞的耐药性随ADM质量浓度的提高逐渐增强。lncRNA CASC9促进非小细胞肺癌对吉非替尼的耐药性[10];lncRNA ZXF1表达水平升高促进肺癌细胞顺铂耐药[11];lncRNA PCAT-1沉默增强非小细胞肺癌细胞对吉非替尼的敏感性[12]。lncRNA SNHG22已被报道通过结合miRNA,促进骨肉瘤细胞、食管癌细胞及甲状腺癌细胞的增殖和迁移[13-15]。本实验的结果表明,沉默lncRNA SNHG22对细胞生存率无影响,过表达可降低细胞生存率,沉默lncRNA SNHG22细胞凋亡率降低,过表达后凋亡率升高。实验结果提示lncRNA SNHG22参与调控MCF-7/ADM细胞的耐药性。
miR-27a是细胞内高度保守的非编码RNA,在前列腺癌、肝癌以及骨肉瘤的耐药过程中具有调节作用,靶向调控miR-27a的表达或作用于其上、下游信号可逆转肿瘤耐药性[16-18]。荧光素酶报告基因检测法证明lncRNA SNHG22与miR-27a-3p具有结合位点,沉默lncRNA SNHG22能够使MCF-7/ADM细胞中miR-27a-3p的表达水平上调。P-gp和BCRP蛋白是与耐药性密切相关的蛋白质。P-gp是一种多药耐药泵,具有同时结合多种药物分子的能力,它的混杂性是癌细胞产生多药耐药性的主要原因,通过外转运机制将多种药物分子泵出细胞外,从而降低肿瘤细胞对药物的敏感度[19]。BCRP作为一种ATP依赖性药物外排转运蛋白,广泛存在于细胞膜上,其可能主要通过参与膜内、外药物转运发挥作用[20]。本研究中,沉默lncRNA SNHG22后,P-gp和BCRP蛋白的表达量升高,而lncRNA SNHG22过表达则降低P-gp和BCRP蛋白的表达量。实验结果表明,lncRNA SNHG22可调节P-gp和BCRP蛋白的表达水平。
综上所述,沉默lncRNA SNHG22增强乳腺癌MCF-7细胞的耐药性,其可能的机制是上调miR-27a-3p,提高P-gp和BCRP蛋白的表达水平,为临床治疗乳腺癌提供潜在的治疗靶点。
