组织因子微粒、内皮细胞微粒及血小板微粒在急性髓细胞白血病中检测意义*
2022-06-07许玉玲董海群刘振芳赵卫华
戴 益,许玉玲,刘 莹,孙 娜,董海群,刘振芳,赵卫华,程 鹏
(广西医科大学第一附属医院,南宁 530021)
急性髓细胞白血病(acute myeloid leukemia,AML)尤其是急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)在治疗早期容易合并出凝血的紊乱[1-2]。微粒(micorparticle,MPs)是细胞在活化、损伤或凋亡过程中释放的直径为0.1~1 μm 亚微米大小的囊泡[3]。到目前为止,许多血栓前状态都有循环MPs 增多的报道,血栓形成的几个因素,如凝血酶、活化蛋白C、炎性细胞因子和高剪应力,都是诱导MPs 形成的因素[4-5]。MPs 作为一种被膜包裹的小囊泡,从各种类型的细胞中脱落出来。它广泛存在于血液、尿液、唾液、乳汁、精液、关节液或脑脊液中[6]。由于MPs 稳定性高,已有部分研究表明,MPs 可作为新的血栓标志物联合D-二聚体(Ddimer,DD)检测能显著提高深静脉血栓的诊断[7]。尽管已有较多文献报道MPs 水平升高与实体肿瘤血栓前状态之间存在关联[8-9],但迄今为止,在血液系统肿瘤尤其在AML 中关于MPs 的报道仍较少[10-11]。本文采用流式细胞术(flow cytometry,FCM)检测AML 患者血浆中组织因子微粒(tissue factor microparticles,TF+MPs)、内皮细胞微粒(endothelial cell microparticles,EMPs)、血小板微粒(platelet microparticles,PMPs)水平;免疫浊比法检测DD、纤维蛋白降解产物(fibrin degradation product,FDP)水平,观察上述指标在初治AML 患者血浆中的表达状态,并初步探讨在AML凝血之间的关系。
1 材料与方法
1.1 一般资料 选取2021年2月至2021年10月在广西医科大学第一附属医院收治的62例初治AML患者,其中男28 例,女34 例,年龄18~74 岁,平均(48.53±13.94)岁。将64例初治AML患者分为APL组和非APL 组;其中APL 组16 例;非APL 组46 例。病例纳入标准:通过细胞形态学、免疫学、细胞遗传学和分子生物学确诊的初治急性髓细胞白血病患者。排除标准:(1)既往发生过血栓或有血栓家族遗传史;(2)其他疾病,如严重肝病、严重感染、其他实体肿瘤导致的凝血紊乱。选取同期相匹配28 例健康志愿者作为对照(正常组);其中男17 例,女11例,平均(49.50±7.82)岁。本研究已取得医院伦理委员会批准,样本采集均征求受试者及患者家属知情同意。
1.2 主要试剂及仪器 藻红蛋白标记的组织因子特异性荧光CD142 单克隆抗体(CD142-PE)、藻红蛋白标记的内皮细胞特异性荧光CD62e 单克隆抗体(CD62e-PE)、藻红蛋白标记的血小板特异性荧光CD61 单克隆抗体(CD61-PE)和藻红蛋白标记的鼠抗人IgG 单克隆抗体(IgG-PE)均为BD 公司产品。流式细胞系校准微球(0.5 μm;1 μm;2 μm)购自Themo Fisher 公司。DD、FDP 配套检测试剂(购自沃芬公司)。流式细胞仪FC500 为美国Beckman Coulter公司产品。
1.3 标本收集 清晨静息空腹状态下,抽取患者、健康对照者肘静脉血4 mL,枸橼酸钠抗凝,标本置于冰盒中,运输过程中避免剧烈摇晃震动。4 ℃,3 000 r/mim,15 min,取上清1/2重复上述离心,再取1/2 得到乏血小板血浆(platelet-poor plasma,PPP),立即储存于-80 ℃冰箱中。
1.4 免疫荧光标记 冻存样本从-80 ℃的超低温冰箱中取出,37 ℃恒温水浴箱中解冻。采用单染色标记法,向流式检测管中各加入50 μL PPP,分别加入5 μL PE 标记的CD142 单克隆抗体、CD62e 单克隆抗体、CD61单克隆抗体分别标记TF+MPs、EMPs、PMPs,充分混匀,避光孵育30 min。加入445 μL 磷酸盐缓冲液(PBS)将体积调整至0.5 mL,充分混匀后上流式细胞仪检测。选用鼠抗人IgG-PE 抗体作为阴性对照。
1.5 FCM的检测 用0.5 μm、1 μm、2 μm的标准微球设定前向检测区,根据0.5 μm、1 μm、2 μm标准校准微球确定1 μm 的位置,使用流式细胞仪对0~1 μm的微粒进行分析。目的微颗粒的界定:直径在0~1 μm之间的,且PE标记特异性抗体阳性的微颗粒。
1.6 DD、FDP 的检测 DD、FDP 均采用免疫浊比法检测。使用美国Instrumentation Laboratory 的ACL TOP 型全自动凝血分析仪及配套试剂盒检测DD、FDP水平。
1.7 统计学方法 采用SPSS 26.0统计软件分析数据,正态分布计量资料均以均数±标准差()表示,两组均数比较采用t检验,多组间比较采用方差分析,组间两两比较采用LSD-t检验;偏态分布计量资料以M(P25~P75)表示,两组间比较采用Mann-Whitney U 检验;正态分布的计量资料间的相关分析采用Pearson相关分析,非正态分布的计量资料间的相关性分析采用Spearman 相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 TF+MPs、EMPs、PMPs 3 种微粒在FCM 检测方法的建立 根据0.5 μm、1 μm、2 μm 标准校准微球确定1 μm的相对位置,见图1。选用鼠抗人IgG-PE抗体确定阴性组对照所在位置,见图2。用PE标记的CD142单克隆抗体、CD62e单克隆抗体、CD61单克隆抗体分别标记TF+MPs、EMPs、PMPs。共读取20 000 个微粒,对0~1 μm 内的颗粒进行分析,图3A~3C 分别代表落在0~1 μm 内表面标记CD142、CD62e、CD61阳性的微粒。

图1 荧光微球校准珠进行微粒圈门
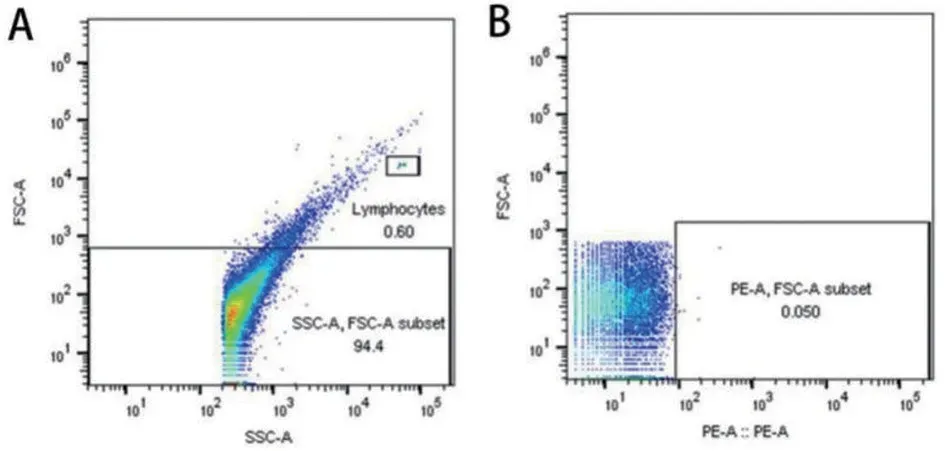
图2 AML组阴性对照检测结果
2.2 AML组与对照组TF+MPs、EMPs、PMPs检测结果的比较 将AML 组分为APL 组和非APL 组,APL 组、非APL 组、正常组TF+MPs、EMPs、PMPs 检测结果见图1~图3、表1。APL 组患者TF+MPs、EMPs、PMPs 高于非APL 组、正常组(均P<0.05),见表1。
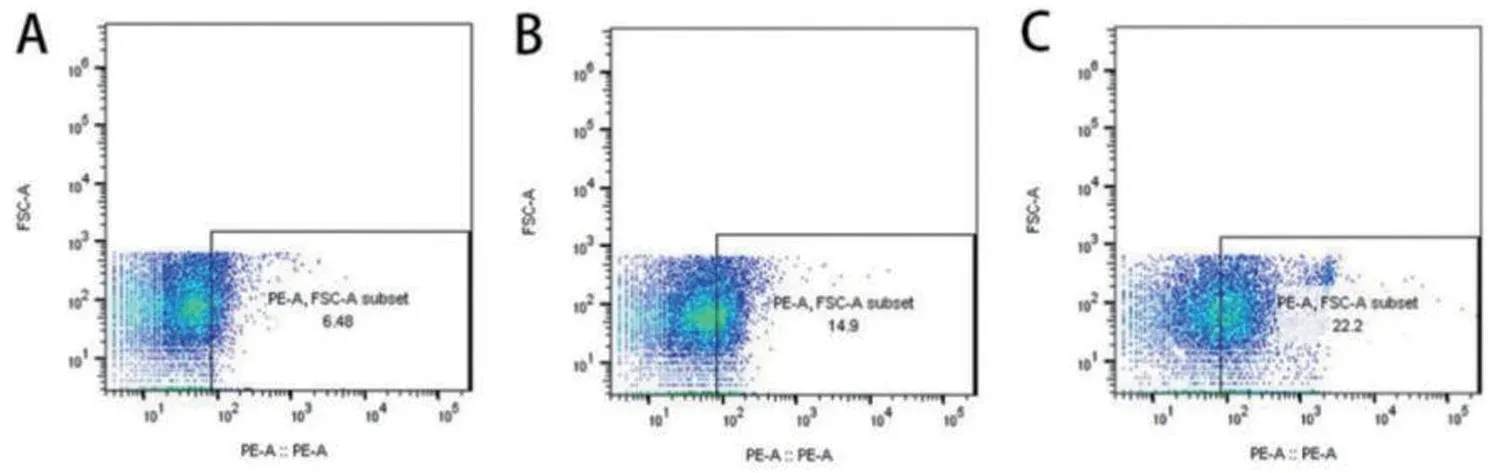
图3 AML组微粒检测结果
表1 不同组别TF+MPs、EMPs、PMPs检测结果%,

表1 不同组别TF+MPs、EMPs、PMPs检测结果%,
与APL组比较,△P<0.05。
2.3 AML 组和对照组DD、FDP 检测结果 APL 组患者DD、FDP 水平高于非APL 组、正常组(均P<0.05),见表2。
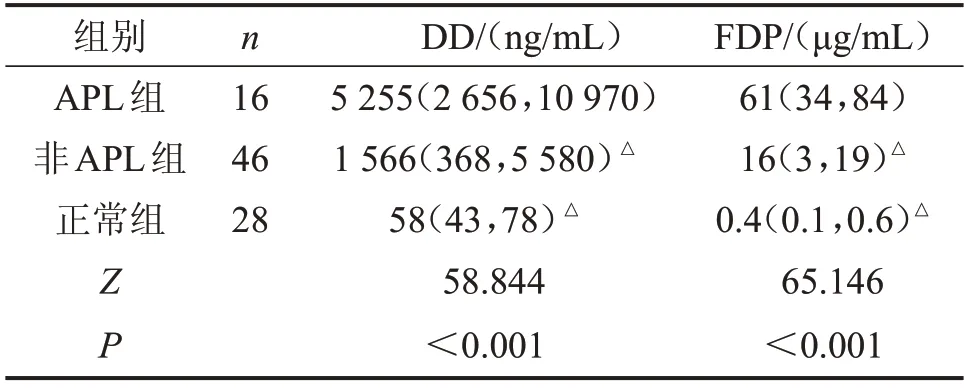
表2 不同组别DD、FDP检测结果M(P25~P75)
2.4 相关性分析 相关分析表明,DD 与TF+MPs(r=0.728,P<0.001)、EMPs(r=0.790,P<0.001)、PMPs(r=0.615,P<0.001)呈正相关关系。
3 讨论
在本研究中,笔者纳入了62例初治AML患者,28例健康对照,主要采用FCM检测患者血浆中TF+MPs、EMPs、PMPs 3 种微粒水平。观察它们在初治AML 患者治疗早期的表达情况。笔者发现APL 组患者血浆中的3 种微粒、DD、FDP 水平高于非APL组和正常组(均P<0.05)。APL是AML的一个特殊的亚型,其特征是在15~17号染色体之间易位。大约至少80%的APL 患者在发病时存在明显的临床凝血障碍[1,12]。一项34 例APL患者的单中心回顾性分析显示,APL 患者其致命性出血发生率为29%,同时12%患者发生了严重血栓栓塞事件。这些事件不仅可发生于诱导治疗过程中,而且可以发生于治疗开始之前[13]。
MPs 是一种小的促凝血膜囊泡,在急性静脉血栓栓塞症(VTE)患者血液中TF+MPs 水平显著升高。Thaler等[14]在它们研究中发现,TF+MPs 的活性在AML相关的弥漫性血管内凝血(DIC)期间升高,证明了TF+MPs 在AML 患者DIC 的发病中可能发挥重要作用。在本次研究中,根据CDSS评分系统,笔者发现62例AML 患者中有3例在治疗早期发生DIC,并对患者血浆MPs 水平进行了检测,发现TF+MPs 的研究结果与上述Thaler 等[14]的报道一致,与他们不同的是笔者还发现EMPs、PMPs 在AML 相关DIC 中也升高,可能与DIC 的发生过程中内皮细胞、血小板的损伤与活化有关。笔者的研究表明TF+MPs、EMPs、PMPs 3 种不同的MPs 在AML 相关DIC 患者血浆中均升高,此外DIC 相关参数DD、FDP 也升高比较明显(均P<0.05)。Campello 等[15]调查了一组癌症相关VTE 患者与健康对照人群循环MPs的定量和定性特征,发现癌症相关VTE患者血浆TF+MPS、EMPs、PMPs 水平均高于健康人。近来研究发现:MPs可作为静脉血栓形成的危险标志物联合P-选择素和DD 可提高检测DVT 的敏感性和特异性[7]。由于本研究病例数相对较少,血栓的发生率相对较低,因此需要在更大的患者群体中进行进行一步的研究,来评估在AML 患者MPs 升高导致血栓的风险。
本研究探讨了血浆中TF+MPs、EMPs、PMPs 3 种微粒在AML 凝血中的作用,FCM 简单快捷,为AML 患者凝血监测提供了新的选择。但本实验也存在一些不足之处:(1)该研究为单中心小样本研究,病例数相对较少。(2)与之匹配的健康人群样本收集难度较大。(3)考虑到患者的经济原因,入院后只对一小部分患者进行了双下肢静脉B 超检测,实际的血栓发生率可能更高。总之,MPs稳定且广泛存在于人的体液中,微粒的分离和检测方法多种多样,只有使用标准化的定量和定性检测微粒水平,通过前瞻性的多中心研究,将MPs与其他生物标记物(例如DD)和一些临床变量整合到评分系统中,以便提高它们在AML 血栓栓塞中作为诊断生物标记物的能力。
