钆塞酸二钠增强MRI影像组学对肝血管瘤腹腔镜肝切除术后疗效的预测价值
2022-06-06崔金涛许建生
崔金涛,许建生
(张家口市第一医院 放射科,河北 张家口 075000)
肝血管瘤是一种肝脏良性肿瘤,瘤旁肝组织呈受压改变,肝窦扩张,病灶大小不一,肉眼呈紫红色,肿瘤质地较软,其内血供丰富[1]。目前,外科手术仍是肝血管瘤的主要治疗措施,但由于肝血管瘤患者临床特征不明显,故对其精确诊断具有一定难度,导致临床治疗效果及预后均较差。随着我国医疗影像技术的发展,临床诊断小肝癌的技术较多,其中准确性较高的检查方式之一是MRI。钆塞酸二钠(Gd-EOB-DTPA)是一种新型的肝胆MRI特异性对比剂,可进入肝细胞内,再排泄入胆系[2]。由于在肝胆特异期肝血管瘤不吸收对比剂,呈低信号影,而肝脏背景吸收对比剂,呈高信号,可使肝血管瘤病灶分割更加准确[3]。影像组学主要是利用相关软件对影像学图像进行更进一步挖掘,将肉眼不可见的图像信息转换为可见的计算机信息,并结合诊断医师的主观诊断,进行高通量运算,从而获得更精确的影像学信息[4]。已有研究报道,Gd-EOB-DTPA增强MRI可较好显示肝血管瘤,对肝血管瘤诊断具有优越性[5]。但MRI增强是否可以用于预测肝血管瘤患者术后疗效尚未确定。在本研究中,我们旨在评估基于Gd-EOB-DTPA增强MRI的影像组学技术,获取MRI图像的高通量特征,并结合临床资料,通过构建机器学习模型,探讨Gd-EOB-DTPA增强MRI影像组学对肝血管瘤术后疗效的预测价值。
1 资料和方法
1.1 一般资料
选取2018年2月至2020年10月在张家口市第一医院行腹腔镜肝切除术治疗的肝血管瘤患者131 例作为研究对象。纳入标准:(1)无其他恶性肿瘤病史;(2)术后病理可明确诊断肝血管瘤;(3)术前10 d内接受Gd-EOB-DTPA增强MRI检查;(4)年龄≥18岁。排除标准:(1)近期服用过肝毒性药物;(2)合并其他系统恶性肿瘤;(3)合并高血糖、高血压、高血脂;(4)精神病患者。本研究经我院伦理委员会审核,入选患者及家属均知情并签署知情同意书。
1.2 观察指标
收集患者年龄、性别、体质量指数(body mass index,BMI)、伴发慢性疾病(肝硬化、慢性乙型肝炎)、血管瘤发生部位、类型、数目、血管瘤最大径、瘤供血动脉支数,以及肝切除大小、术中出血量、手术时间。
1.3 MRI检查方法
使用德国Siemens Magnetom Skyra 3.0 T MRI成像系统和16通道腹部线圈。检查前空腹6 h以上,受检者仰卧位以便行上腹部扫描。MRI扫描参数如下:(1)T1WI,重复时间(time of repeatation,TR)为 4.11 ms,回波时间(time of echo,TE)为1.24 ms,层厚3.6 mm,视野(field of vision,FOV)为260 mm× 320 mm;(2)脂肪抑制T2WI,FOV为310 mm× 330 mm,TE为75.40 ms,TR为5 000 ms,层厚6 mm;(3)DWI,FOV为260 mm×320 mm,TE为55 ms,TR为1 600 ms,矩阵为256×170;(4)T1WI增强扫描,使用3D VIBE T1WI序列,FOV为310 mm×330 mm,TR为4.26 ms,TE为1.85 ms。增强扫描前,使用高压注射器经肘静脉注射对比剂Gd-EOB-DTPA(德国拜耳医药保健有限公司),注射流率为1 mL/s,注射剂量为0.025 mmoL/kg。分别于注射对比剂后18~21 s采集动脉期图像、60 s采集门静脉期图像、180 s采集平衡期图像、20 min采集肝胆期图像。见图1。
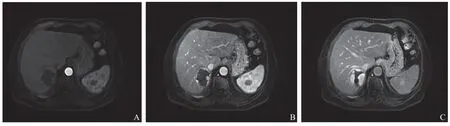
图1 患者女性,53岁,肝血管瘤,Gd-EOB-DTPA增强MRI影像学表现
1.4 影像组学分析方法
(1)本研究使用图像处理软件(ITK-SNAP Version 3.4.0,http://www.itksnap.org/)对肝胆期图像进行图像分割。先以随机数字法提取20 例肝血管瘤患者,由分别有6、7年上腹部影像学诊断临床经验的2名放射科医师(本文第一作者A、本文第二作者B)分别进行图像分割,1 周后医师A再次勾画该20例患者,并完成剩余病例。(2)纹理特征提取:使用PyRadiomics软件提取肝胆期MRI图像定量特征,包括领域灰度差矩阵、灰度区域大小矩阵、灰度共生矩阵、灰度依赖矩阵、灰度游程长度矩阵、形状特征、一阶特征。分别提取小波变换图像、高斯拉普拉斯过滤图像和原始图像的特征。(3)特征筛选:使用最小绝对收缩和选择算子(the least absolute shrinkage and selection operator,LASSO)回归5折交叉验证方法筛选纳入的影像组学特征和临床特征,选择调优参数lambda.1se时对应的特征,获取最优特征子集,绘制相关性热图。
1.5 预测模型构建
研究采用机器学习算法,利用提取的最优特征子集进行学习,建立和训练一个预测模型。将131例肝血管瘤患者采用计算机产生随机数法以7:3的比例分为训练集(92例)和验证集(39例),分别用于构建和验证预测模型效能。
Logistic回归属于概率型非线性回归,多用于鉴别诊断、评价治疗措施以及分析疾病的预后因素,是处理二分类反应数据的标准方法[6]。
XGBoost是将损失函数通过二阶泰勒扩展推导,为避免模型拟合过度,在目标函数中加入控制模型复杂度的正规化项,具有与决策树相同的决策规则,支持回归和分类[7]。
CatBoost采用对称树的方式,通过特殊的方式处理类别特征编码,从而避免过度拟合,提升模型的泛化能力和鲁棒性[8]。
LightGBM是基于决策树算法的梯度提升算法框架,利用弱分类器迭代训练得到最优模型,并采用梯度提升算法减少结构分数的计算量,可以准确提高计算能力[9]。
1.6 术后随访
患者手术当天为随访开始日期,截止时间2021年9月,术后每2~3个月进行1次随访和复查,随访方式为上门或电话随访。根据患者术后是否出现并发症分为预后不良组和预后良好组。训练集中预后良好64例,预后不良28例;验证集中预后良好25例,预后不良14例。
1.7 统计学分析
2 结果
2.1 训练集和验证集的临床资料比较
训练集和验证集患者的一般临床资料、病变相关因素、操作相关因素等比较,差异均无统计学意义(P>0.05),具有可比性。见表1。
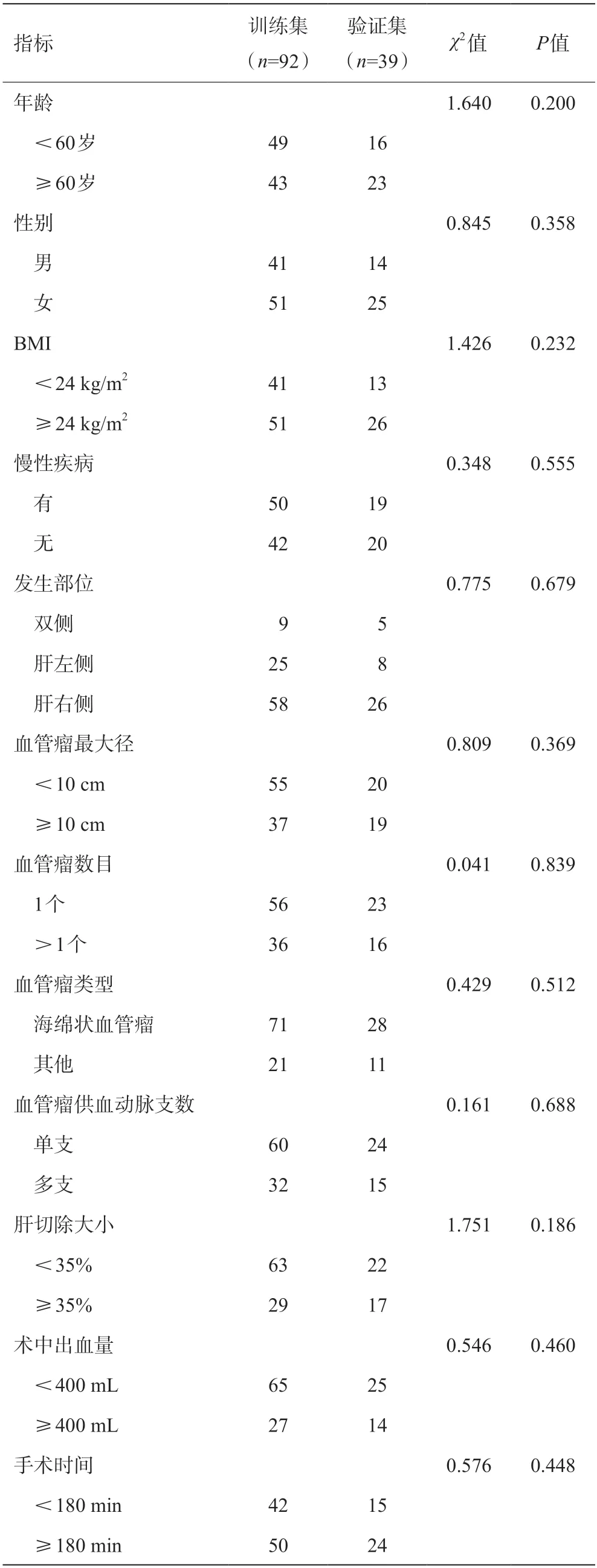
表1 训练集和验证集患者的临床资料比较(例)
2.2 训练集临床特征比较
训练集中预后不良的患者有28例,其中感染19例(19/92,20.65%),胆漏5例(5/92,5.43%),腹腔积液4例(4/92,4.35%)。比较训练集肝血管瘤患者预后不良组和预后良好组间的临床特征,结果发现,两组在慢性疾病、血管瘤最大径、血管瘤数目、血管瘤供血动脉支数、肝切除大小、术中出血量方面,差异均有统计学意义(P<0.05)。两组在年龄、性别、BMI、血管瘤发生部位、血管瘤类型、手术时间方面无统计学差异(P>0.05)。见表2。
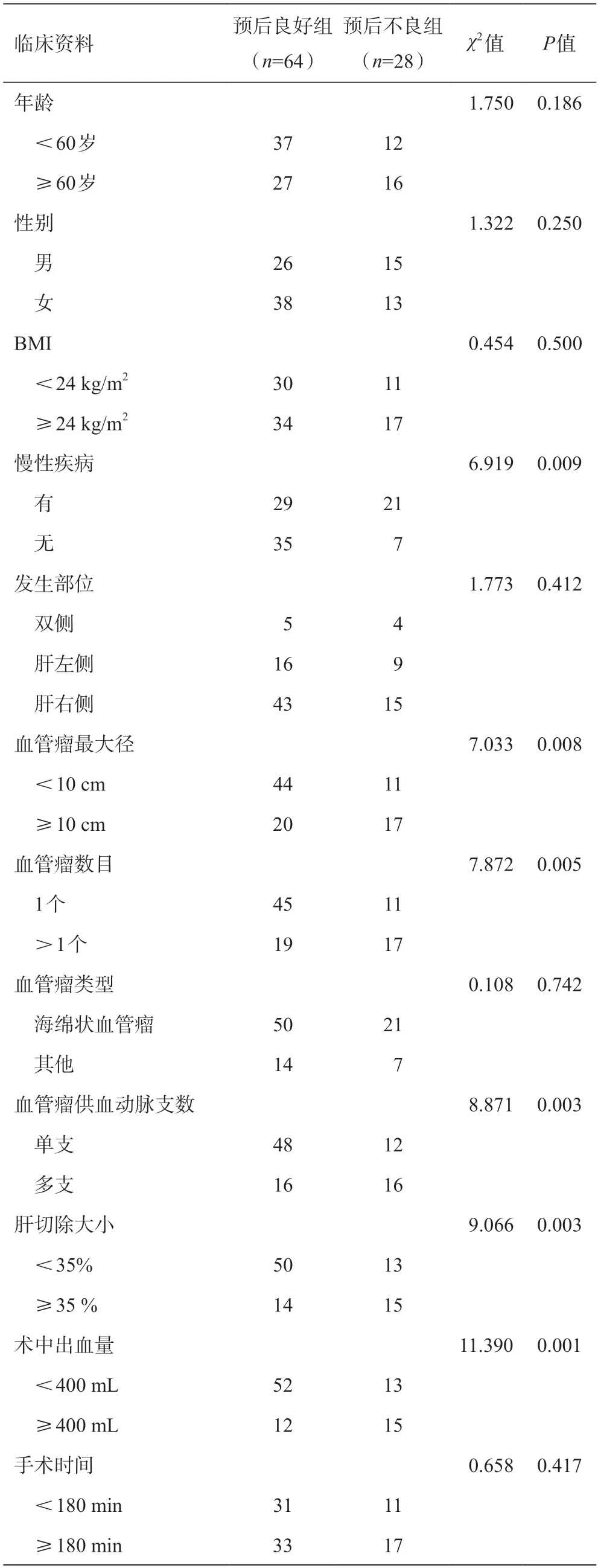
表2 训练集临床资料比较(例)
2.3 影像组学的一致性分析
A医师与B医师第1次图像分割结果进行比较发现,组间ICC值为0.862~0.934;对A医师2次图像分割结果进行比较发现,组内ICC值为0.839~0.922。图像分割组内和组间比较均具有较好的一致性。
2.4 影像组学纹理特征筛选
基于训练集肝胆期MRI图像共提取1 068个影像组学特征,再利用LASSO回归,通过5 折交叉验证确定LASSO回归中的最佳λ取值,基于最佳λ值从12个临床特征和1 068 个影像组学特征中筛选出14 个非零系数特征,构成最优特征子集,其中包括12个影像组学特征和2个临床特征(见图2、表3)。
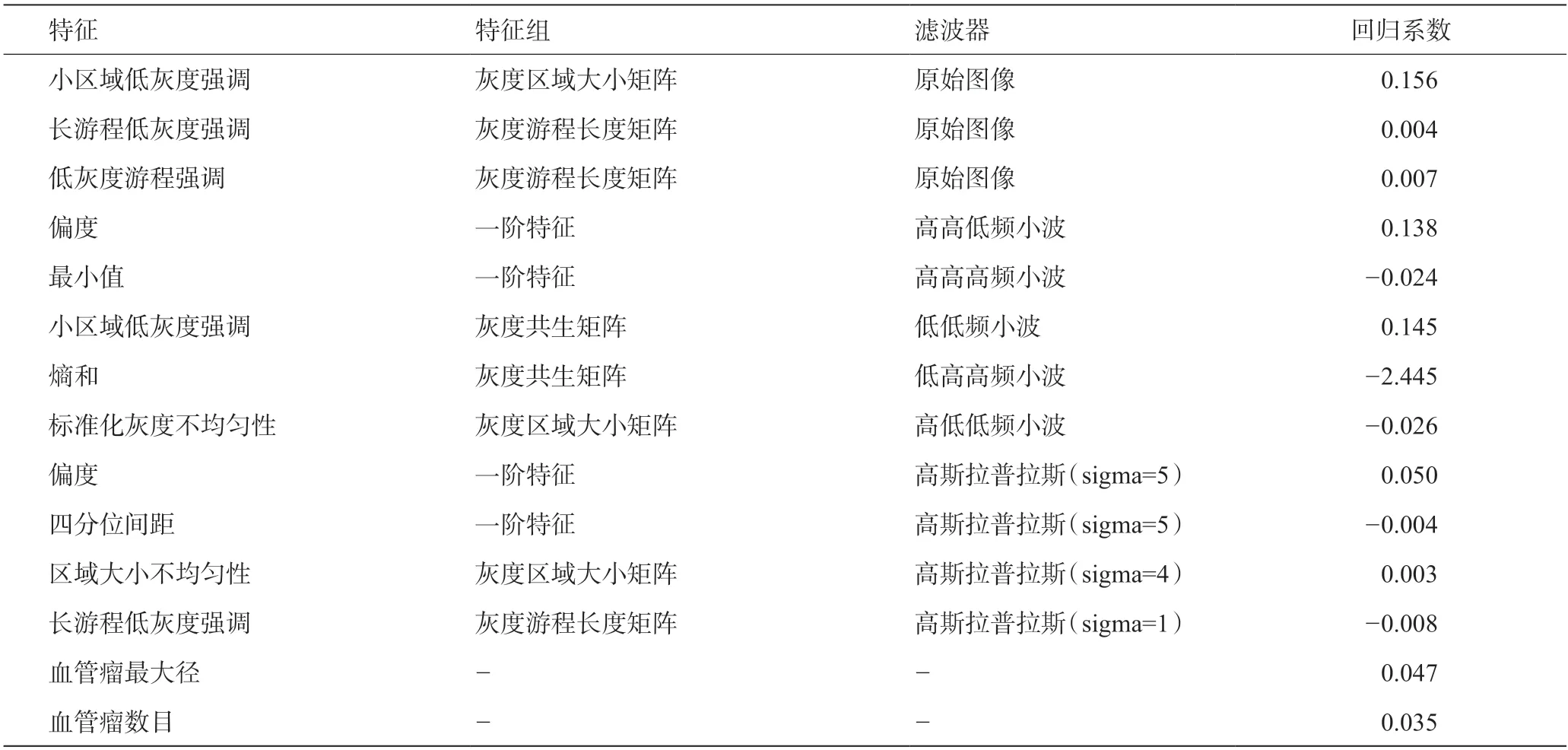
表3 肝血管瘤影像组学和临床特征及回归系数
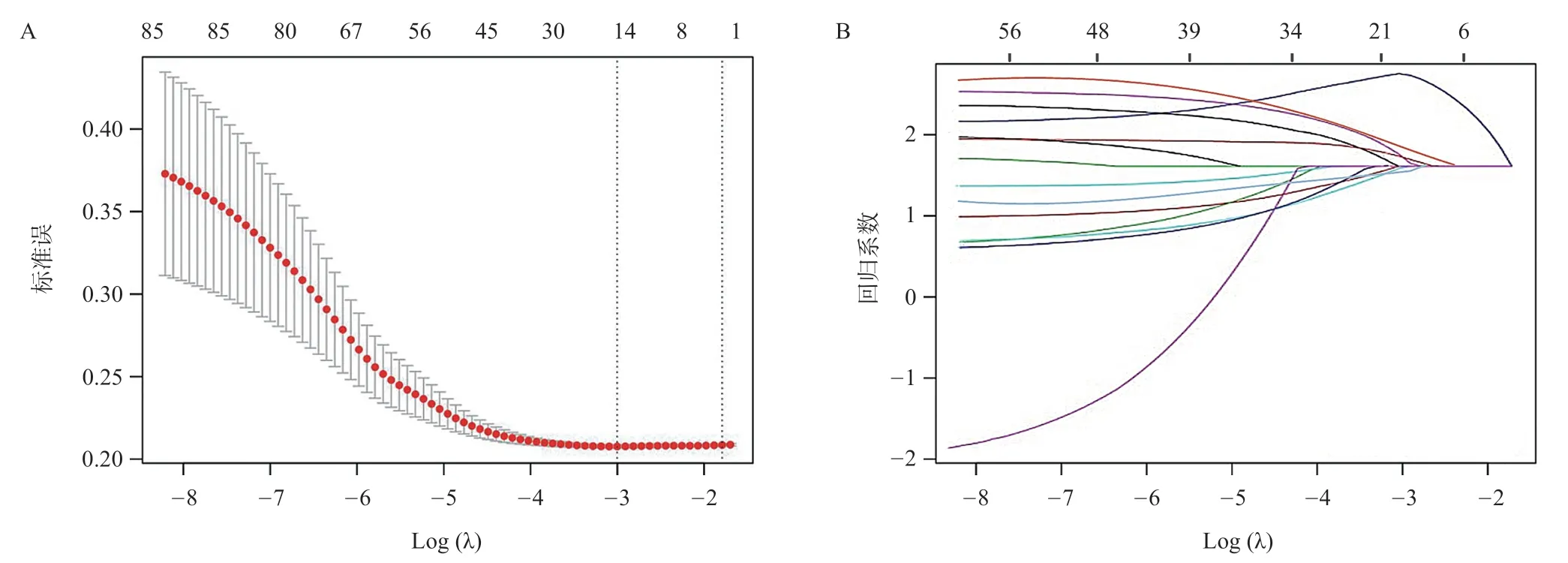
图2 影像组学纹理特征筛选
2.5 最优特征子集的相关性热图
绘制最优特征子集的相关性热图,14个最优特征的相关性较弱,相对独立,可全部纳入机器学习模型。见图3。
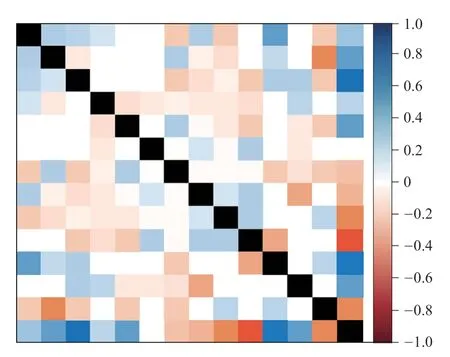
图3 最优特征子集的相关性热图
2.6 基于机器学习模型的构建及评价
基于最优特征子集建立预测肝血管瘤术后疗效的Logistic回归模型、CatBoost模型、XGBoost模型、LightGBM模型,然后利用验证集病例对训练集建立的模型进行验证,使用ROC曲线比较4 种模型的预测价值。
在训练集中,Logistic回归模型、XGBoost模型、CatBoost模型、LightGBM模型的ROC曲线下面积(AUC)分别为0.820(95%CI0.746~0.881)、0.784(95%CI0.729~0.864)、0.722(95%CI0.651~0.803)、0.693(95%CI0.618~0.752),Logistic回归模型的敏感性和特异性均高于其他3 种模型。在验证集中,Logistic回归模型、XGBoost模型、CatBoost模型、LightGBM模型的AUC分别为0.814(95%CI0.732~0.861)、0.785(95%CI0.735~0.850)、0.706(95%CI0.619~0.769)、0.684(95%CI0.607~0.763),Logistic回归模型的敏感性和特异性均高于其他3种模型。见表4。
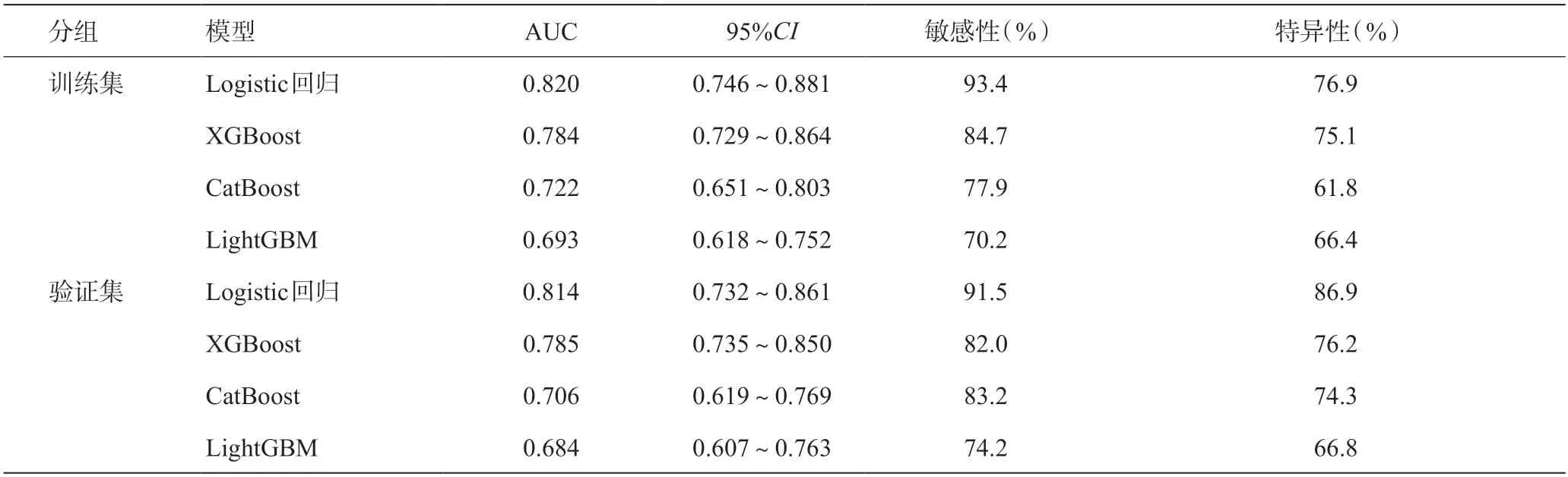
表4 ROC曲线评价4种模型的预测价值
根据训练集和验证集结果,4种机器学习算法的预测效果良好,其中Logistic回归的预测效果优于其他3种,预测更加准确。见图4。
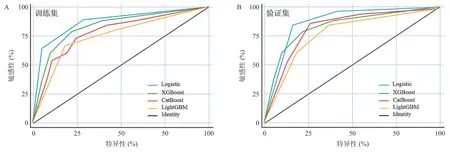
图4 ROC曲线评估训练集(A图)和验证集(B图)中4种模型对术后疗效的预测价值
3 讨论
肝血管瘤是一种良性肿瘤,腹腔镜肝切除术是治疗肝血管瘤的常用术式,术后瘤体残留和复发率极低,因此本研究以患者术后发生并发症为预后不良。本研究发现,训练集中预后不良患者有28 例,其中感染19 例,胆漏5 例,腹腔积液4 例,比例分别为20.65%、5.43%、4.35%。以往研究显示,肝血管瘤经腹腔镜肝切除术治疗术后感染率约为19%~33%[10],与本研究结果相符。本研究进一步比较预后良好组和预后不良组临床资料发现,预后不良组患者中,血管瘤供血动脉多支、血管瘤数目>1个、合并慢性疾病、血管瘤最大径≥10 cm、肝切除≥35%,术中出血量≥400 mL者占比均明显较大,提示上述因素可能与预后不良有关。本研究又利用LASSO回归筛选最优特征发现,血管瘤最大径和血管瘤数这两个临床特征被纳入最优特征子集,提示二者与肝血管瘤术后疗效相关。已有研究发现,血管瘤数目>1 个是肝血管瘤预后不良的危险因素之一,原因可能是由于瘤体数量越多,分布越广,术中需切除的肝脏也越大,从而扩大手术切口,增加手术风险[11]。而血管瘤最大径≥10 cm也会增加手术预后不良风险,这是由于肿瘤直径越大,术中所需切除的体积越大,受损组织越多。
影像组学通过自动化数据的特征化算法,从感兴趣区提取大量特征数据,进行筛选,获取定量特征,有助于对肿瘤异质性进行分析[12]。Gd-EOB-DTPA是一种新型肝胆磁共振对比剂,经静脉注射后,约50%能够被正常肝细胞膜上的有机阴离子转运多肽摄取,并可完整通过胆道排泄,而不会被肝细胞代谢,剩余的50%会被肾脏代谢[13]。在正常肝脏组织中,Gd-EOB-DTPA在肝胆特异期呈等信号或高信号表现,而在肝脏恶性肿瘤中,Gd-EOB-DTPA在肝胆特异期呈低信号表现[14]。李亮杰等[15]和Takao等[16]分别报道了Gd-EOB-DTPA增强MRI在肝硬化和慢性肝炎患者中,肝胆特异期影像学的变化与患者肝功能损害具有相关性。报道Gd-EOB-DTPA增强MRI预测肝血管瘤术后疗效较少。已有研究报道,包含影像组学和临床参数的回归模型的评估能力明显优于单独的临床参数模型[17]。也有研究证实,提取肝癌患者术前MRI影像组学特征后建立的模型可准确预测术后肿瘤变化[18]。本研究基于肝血管瘤患者术前肝胆期MRI图像共提取1 068个影像组学特征,再利用LASSO回归,通过5折交叉验证确定LASSO回归中的最佳λ取值,基于最佳λ值从12个临床特征和1 068个影像组学特征中筛选出14个非零系数特征,构成最优特征子集,其中包括12个影像组学特征和2个临床特征。
机器学习算法在人工智能领域属于一种比较新颖的方法,其可以通过庞大的电子医疗记录获得从实践中得出的数据集,通过自动改进的计算机算法对数据进行整合分析,为患者临床的精准预测提供新的思路和方法[19]。既往关于肝血管瘤术后疗效的预测研究主要根据传统的Logistic回归进行危险因素分析,鲜有结合影像组学数据进行预测。本研究将基于LASSO回归和5 折交叉验证筛选出的2 个临床特征和12 个影像组学特征纳入Logistic回归、CatBoost、XGBoost和LightGBM 4种机器学习算法中,通过对训练集进行数据分析,验证集进行预测验证,其最高AUC可达0.8 以上,规避了传统方法数据处理量大、人工操作繁杂、指标纳入局限性等问题,此研究方法可供医师临床诊断和术后疗效预测提供理论支持。另外,本研究比较了4 种机器学习算法在预测模型上的预测效能,发现Logistic回归和XGBoost的AUC均大于0.75,说明预测效果具有很大的潜力;而CatBoost和LightGBM的AUC均在0.60~0.75,就本实验而言预测效果欠佳。整体看来,Logistic回归算法优于另外3种。
综上所述,血管瘤最大径和血管瘤数结合钆塞酸二钠增强MRI肝胆期图像的影像组学特征构建的机器学习模型可用于对肝血管瘤术后疗效进行预测,其中Logistic回归算法构建的模型更加精准,可为肝血管瘤患者的个体化预测提供理论依据。
