微波消融治疗原发性肝癌的单中心回顾性研究
2022-06-06周江敏陈琳张志伟陈孝平
周江敏,陈琳,张志伟,陈孝平
(华中科技大学同济医学院附属同济医院 肝脏外科中心,湖北 武汉 430030)
肝细胞癌(hepatocellular carcinoma,HCC)是全球最常见的恶性肿瘤之一,其病死率居恶性肿瘤的第三位[1]。临床上,对中国肝癌分期(China liver cancer staging,CNLC)Ⅰa、Ⅰb,即肿瘤数目<3个、肿瘤最大径<5 cm、肝功能分级为Child-Pugh A/B级的早期肝癌患者,肝移植、肝切除或者微波消融(microwave ablation,MWA)治疗均是有效的治疗方法[2],治疗方案的选择主要受肿瘤部位、大小、肝硬化程度、肝储备功能等因素的影响。目前对于肝储备功能良好,剩余肝体积足够的患者肝切除仍作为临床上主要的治疗方法[3]。然而,肝癌患者多伴有不同程度的肝硬化、肝功能不良等,大范围切除肝组织会增加术后肝衰竭风险,同时肝切除对术后肝功能影响明显,因此肝切除并不适用于所有早期肝癌患者。对于高龄、严重肝硬化、肝储备功能不足患者,MWA治疗因创伤小、对肝功能影响小等特点,可作为肝切除的替代治疗。临床研究表明,对于早期肝癌,尤其是最大径≤2 cm的肿瘤,MWA治疗效果与肝切除效果相近[4]。此外,MWA治疗主要适用于肝脏深面肿瘤或中央型肝癌,对于周围型肿瘤或近大血管、重要脏器肿瘤,MWA的安全性和消融效果仍存在争议。研究表明,消融的效果受到肿瘤部位的影响,靠近大血管的病灶有消融不完全的风 险[5-6],因为肿瘤靠近大血管,部分热量会因“热沉效应”被带走,导致靠近血管一侧的肿瘤组织无法达到额定温度而发生不完全坏死[7]。消融靠近重要脏器,如胆囊、结肠、胃等部位的病灶,可能会发生脏器热损伤的风险[8-9]。本研究分析本中心接受MWA原发性肝癌患者的一般临床特征,明确影响患者长期生存的独立危险因素,探究特殊部位病灶消融的可行性和安全性。
1 资料和方法
1.1 一般资料
回顾性分析2010年1月至2018年5月华中科技大学同济医学院附属同济医院肝脏外科中心收治的所有诊断为原发性肝癌并接受MWA治疗的患者,通过筛选纳入254例合格的病例。
排除标准:(1)不符合原发性肝癌的临床诊断;(2)MWA术前接受其他抗癌治疗;(3)肝切除术后复发行微波消融;(4)CNLC分期非Ⅰa、Ⅰb期;(5)肿瘤最大径>5 cm;(6)肝功能Child-Pugh C级,且凝血功能正常;(7)术前吲哚菁绿15 min滞留率>30%;(8)微波术后的3个月内未行CT或MRI检查,无法评估病灶消融情况者。
1.2 特殊部位病灶和消融不完全的界定
特殊部位病灶:肝癌距门静脉一或二级分支、肝静脉主支及下腔静脉小于5 mm,或距离胆囊、结肠、胃、膈肌等小于5 mm[10]。
消融不完全:患者在MWA治疗后5天内行超声造影检查,如病灶内有明显的造影剂填充,则认定为消融不完全,或者术后3 个月内的任何一次增强 CT或MRI提示消融区内或边缘有异常强化,也被认定为消融不完全[11]。对于消融不完全患者,可再次行MWA治疗。
1.3 仪器设备
超声仪器:Esaote MyLab 90 彩色多普勒超声诊断仪,配置超声造影功能,选用腹部凸阵探头CA431及CA541,频率1~8 MHz。微波治疗仪:南京亿高医疗器械有限公司生产,型号ECO-100A。微波针有效长度18 cm,直径14 G。
1.4 微波消融治疗
术前超声造影确定病灶部位。局麻或静脉麻醉,超声引导确定最佳穿刺部位,在超声实时引导下微波针经皮缓慢刺入肿瘤至针尖位于肿瘤底部以下0.2~0.4 cm,使微波针的发射部位覆盖肿瘤底部,治疗时输出功率设定为60 W。
经皮微波消融:对于最大径≤2 cm的肿瘤,单针单点一次性消融完成;对于最大径>2 cm肿瘤,采用单针多点多次消融。判断消融完成的指标如下:在超声实时监测下,消融区表现为一个清晰可辨的高回声区,这与既往研究的经超声证实的病理坏死区域一致[12]。在对邻近大血管或肝外器官的病灶进行消融时,通过电极尖端周围产生的微气泡来确定消融区,微气泡在超声上表现为清晰的高回声。一旦微气泡的范围到达大血管或肝外器官边界,即刻停止消融,以避免损伤相应组织器官。
腹腔镜微波消融:肉眼直视下经皮插入微波针,对于最大径≤2 cm的肿瘤,刺入肿瘤中心,单针单次完成消融;对于最大径>2 cm肿瘤,微波针插入肿瘤包膜,多点消融肿瘤周围,最后插入肿瘤中心,完成瘤体消融,缺血带超过肿瘤周围1 cm停止消融,视作消融完成。
1.5 术后随访
术后半年每月随访一次,监测肝脏彩超和(alpha-fetoprotein,AFP)、异常凝血酶原(protein induced by vitamin K absence or antagonist-Ⅱ,PIVKA-Ⅱ)水平,必要时行超声造影检查。前3个月至少行增强CT或MRI检查一次,评估消融效果。术后半年至2年每3个月随访一次,之后每半年随访一次。随访截止2020 年10 月10 日。无复发生存时间(recurrence free survival,RFS)为微波消融治疗至肝内病灶进展或最后一次随访的时间。总体生存时间(overall survival,OS)为微波消融治疗至患者死亡或最后一次随访时间。采用电话、门诊、住院等随访方式来确定患者的生存状况。
1.6 统计学分析
采用SPSS 19.0软件进行统计学分析,计量资料符合正态分布采用()表示,不符合正态分布,采用中位数四分位间距[M(IQR)]描述;分类变量采用频数和百分比描述。采用Kaplan-Meier法绘制生存曲线,生存曲线的绘制采用RStudio 4.1.0软件。Log-rank(Mantel-Cox)检验比较组间复发率和生存率的差异。采用Cox风险比例模型确定生存的危险因素,采用Logistic回归分析确定消融不完全的危险因素。P<0.05认为差异具有统计学意义。
2 结果
2.1 临床病理特征
纳入的254 例原发性肝癌患者的年龄、性别等临床和病理资料详见表1。本组82.3%(209/254)患者乙肝表面抗原阳性,89.8%(228/254)患者有肝硬化,16.1%(41/254)患者AFP>400 ng/mL。肿瘤最大径(2.1±0.7)cm,85.8%(218/254)患者肿瘤单发。Child-Pugh评分为B级的患者接受短期护肝治疗后均转为A级。61例特殊部位肿瘤中46例肿瘤靠近大血管,15例肿瘤靠近肝外器官,具体分布见表2。本组82.7%(210/254)肿瘤经皮微波,17.3%(44/254)肿瘤经腹腔镜微波消融。随访29~129个月,平均随访(57±22)个月[52(38~70)个月]。

表1 254例微波消融患者临床病理资料
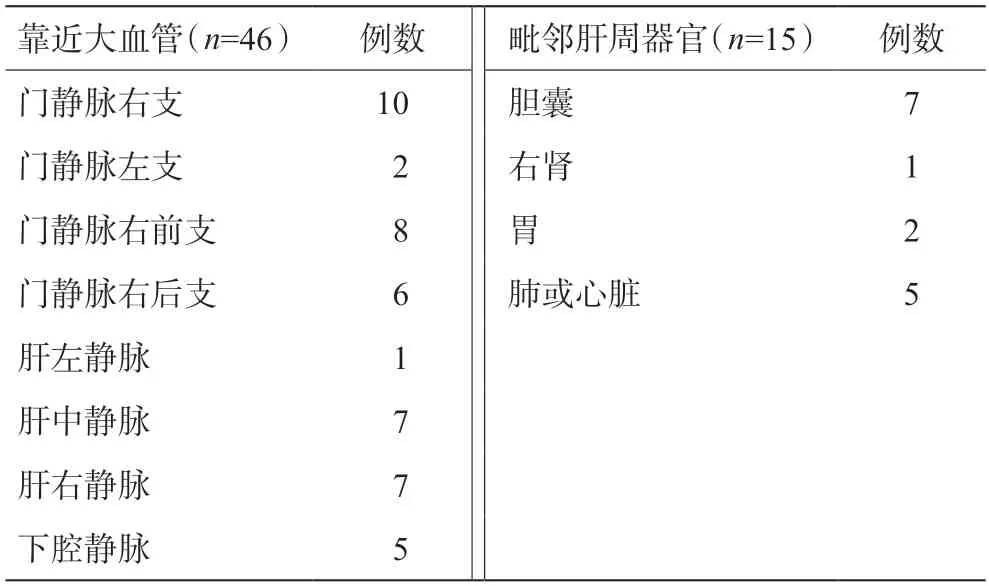
表2 特殊部位肝癌的分布
2.2 生存情况
随访截止时69.7%(177/254)患者复发,44.9%(114/254)患者死亡。所有接受微波治疗的患者的中位RFS为39(95%CI29~50)个月(图1);中位OS为68(95%CI55~80)个月(图2)。肿瘤在特殊部位的患者(61例)中位OS为62(95%CI34~90)个月,非特殊部位患者(193例)OS为70(95%CI59~81)个 月,两组生存时间无统计学差异(P=0.160)(图3)。
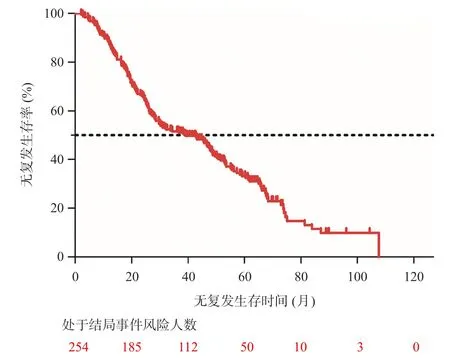
图1 254例微波消融患者的无复发生存时间曲线
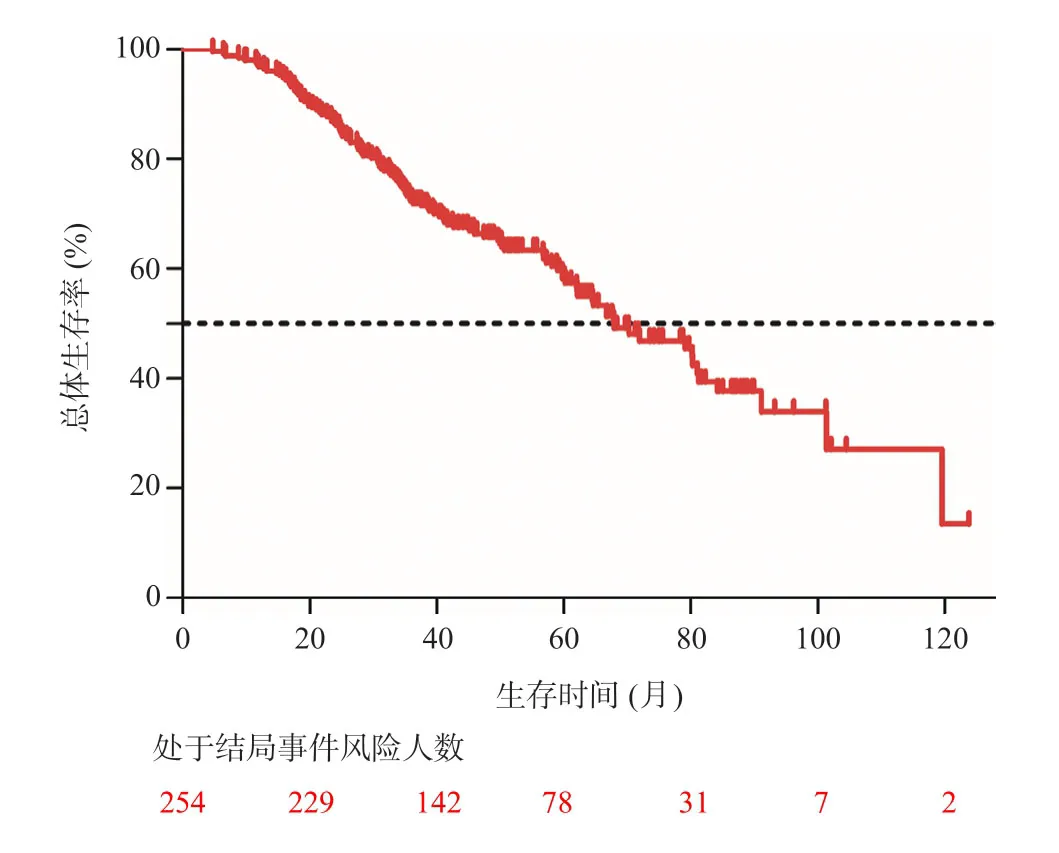
图2 254例微波消融患者的总体生存时间曲线
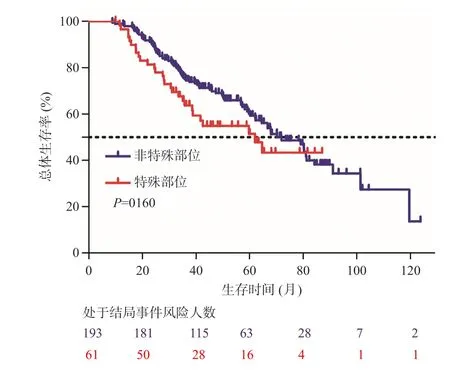
图3 特殊部位和非特殊部位微波消融患者总体生存时间曲线
2.3 生存相关危险因素分析
表3 显示了影响微波患者长期生存的危险因素分析。单因素和多因素分析表明,肿瘤最大径>3 cm [风险比(hazard ratio,HR)1.954,95%CI1.276~2.992]、Child-Pugh B级(HR2.183,95%CI1.481~3.217)、血小板计数(platelet,PLT)<50×109/L(HR4.344,95%CI2.878~6.555)是影响患者长期生存的独立危险因素。
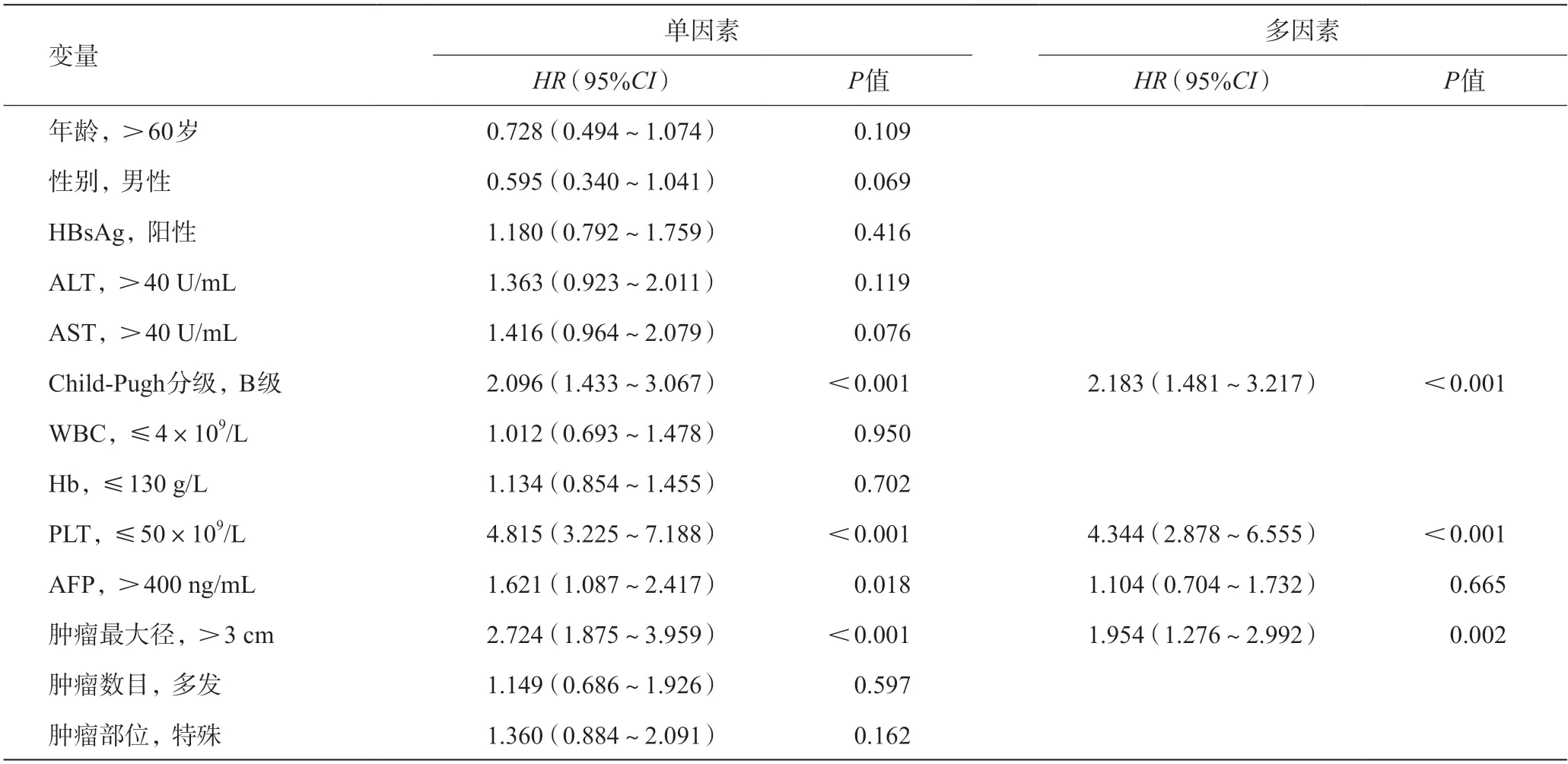
表3 与生存相关的单因素和多因素Cox比例回归分析
2.4 并发症情况
根据Clavien-Dindo分级系统对并发症严重程度的分类,Ⅲ、Ⅳ级并发症包括大量的胸腹腔积液、肝脓肿、胆漏、空腔脏器损伤、呼吸衰竭、肾衰竭、肝衰竭,需要外科处理或需ICU管理。本研究254例患者中,发生Ⅲ、Ⅳ级并发症16例(6.3%)。其中大量的胸腹腔积液8 例,肝脓肿3 例,肝衰竭1 例,肺部感染2 例,腹腔出血1 例,结肠损伤1 例。特殊部位与非特殊部位患者Ⅲ、Ⅳ级并发症发生率无统计学差异[9.8%(6/61)vs5.2%(10/193),P=0.226]。
2.5 不完全消融的危险因素分析
254例患者中21例患者为不完全消融,占8.3%。其中,14 例经历了至少1 次的重复消融,6 例重复消融后行经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)治疗,1例行肝移植。纳入 消融方式(经皮)、术前AFP(>400 ng/mL)、肿瘤最大径(>3 cm)、肿瘤数目(多发)、肿瘤部位(特殊部位)共5个变量。Logistic回归分析显示,只有肿瘤最大径>3 cm是肿瘤消融不完全的独立危险因素[比值比(odd ratio,OR),8.841 95%CI3.322~23.527],肿瘤部位并不会导致病灶消融不完全,见表4。
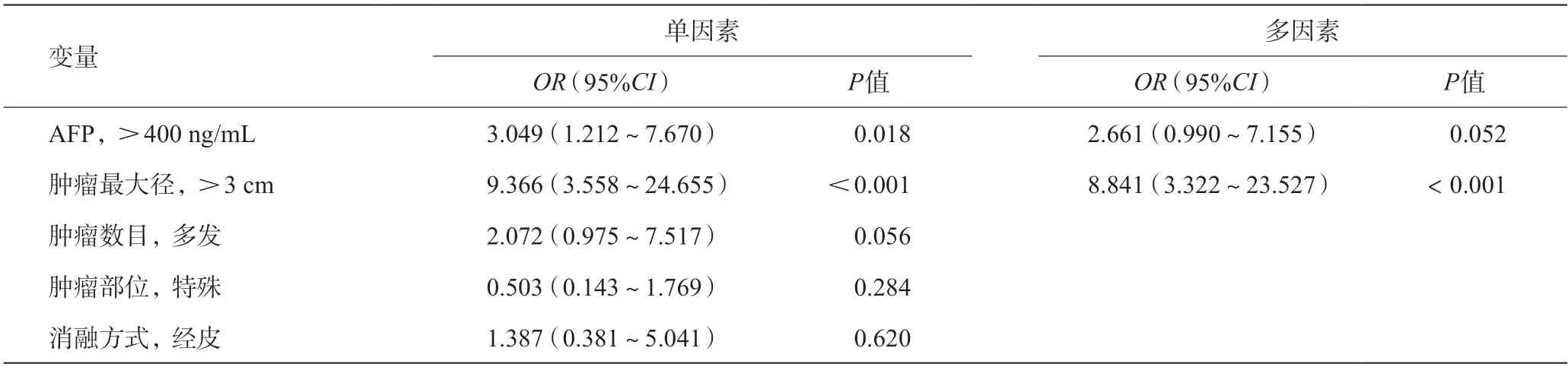
表4 消融不完全的单因素和多因素分析
3 讨论
接受MWA的患者多数存在肝功能不良、肝硬化严重,肝储备功能较差、年龄较大、合并基础疾病等诸多问题[13]。本研究纳入的患者中,术前肝功能Child-Pugh分级为B级的比例达到了20.9%,肝硬化比例达到了89.8%。这些既是患者接受微波治疗而不选择肝切除的原因,同时也是导致患者预后不良的因素之一。
本研究通过Cox回归分析发现肝功能Child-Pugh B级、PLT<50×109/L是影响患者长期生存的独立危险因素。首先,术前肝功能Child-Pugh B级的患者往往存在明显的肝损害,术前短期的护肝治疗并不能完全改善肝功能,虽然微波消融对肝功能影响较肝切除小,但对于肝硬化严重患者,多次的MWA、TACE等局部治疗难以避免地会损伤肝功能,最终患者可能会因肝功能衰竭而死亡。其次,脾功能亢进患者往往血小板多低于50×109/L。既往研究表明,脾功能亢进时机体免疫细胞数量和功能均不足,抑制性的免疫微环境有利于肿瘤的复发和转移[14-16],而且脾功能亢进往往伴随明显的肝硬化,对于微波术后复发的患者,多采用再次MWA、TACE、靶免治疗或局部治疗联合全身治疗等,而上述治疗手段在控制肿瘤进展的同时会不可避免地会损伤正常肝组织,患者最终可能会因肝功能恶化而死亡。本研究在随访过程中也发现,接受多次MWA或合并TACE治疗的患者,肝脏体积缩小,尤其是对伴有严重肝硬化的患者,肝脏体积缩小会加重肝功能恶化,因为合并肝硬化的肝脏再生能力弱,且增生的形态结构和功能均不完整[17],随着损伤的加重,部分患者出现慢性肝功能衰竭,最后因大量腹水、黄疸等肝衰竭死亡。但相比肿瘤进展所带来的死亡风险而言,MWA在控制肿瘤进展、延长患者生存时间方面意义更为重大。我们认为,良好的肝功能是患者获得持续治疗机会和长期生存的前提。MWA具有微创、损伤小、对肝功能影响小等特点,是肝功能不良患者肝切除理想的替代治疗方法,但每次MWA、TACE等治疗造成的肝脏组织的损伤不可忽视。
在本研究中,我们发现消融特殊部位的病灶与非特殊部位病灶的近、远期生存率并不存在统计学差异,消融的成功率与肿瘤位置无关。既往部分研究认为,MWA靠近大血管周围肿瘤,由于血流的“热沉效应”而出现消融不完全的现象,近大血管周的消融治疗是术后复发的独立危险因素[18]。同样,对于靠近肝外器官的病灶,由于脏器内气体的干扰,超声定位欠佳[19];或者为避免脏器损伤等严重后果而减少消融时间,最终可能会导致病灶消融不完全[20]。但多数研究却认为,MWA靠近血管、脏器的病灶消融大体上是安全且消融效果确切,消融效果并未受到肿瘤部位影响[21-25]。本研究也发现,特殊部位肿瘤与其他部位肿瘤在消融安全性和效果不存在统计学差异。本研究也并未发现消融毗邻肝外脏器的肿瘤导致脏器损伤的风险增高的现象,原因可能是多数肿瘤大小在2 cm左右,MWA的时间通常较短,大部分在6 min以内,加之超声精准的定位,微波的绝大部分热量均作用于肿瘤组织,并不会对空腔脏器造成不可逆的损伤。此外,也并未发现消融靠近血管肿瘤而导致消融不完全和肝梗死、胆漏、门静脉血栓、出血等严重并发症的情况。本研究中的16例Ⅲ、Ⅳ级并发症的发生多是由于术前肝功能不良、营养状态差导致术后出现胸腹水、肝脓肿、肺部感染、肝衰竭等情况。故总体上,MWA是安全有效的且与肿瘤部位无关。然而,消融的效果却与肿瘤大小相关。Logistic回归分析显示,肿瘤最大径>3 cm是不完全消融的独立危险因素。通常认为,消融的范围需覆盖整个瘤体同时覆盖到瘤周正常组织至少0.5 cm 才能保证完全消融[5]。微波的有效工作范围大约为一个3 cm的球体,当肿瘤最大径>3 cm,消融往往很难一次完成,但单针多点多次消融也并不适用于所有患者。因为肿瘤的消融需考虑微波针的入路问题,微波针在穿刺路径上需避开大血管、重要脏器,故当肿瘤过大同时穿刺入路的选择受限时,单针单次消融可能会导致肿瘤消融不完全。
既往研究表明,消融不完全的病灶,肿瘤的侵袭性会增强,肿瘤进展加快[26-28]。本研究254例患者21例消融不完全患者中14例经历了重复消融,随访过程中有11例出现肝外转移,其中7例肺转移,2例骨转移,2例肺转移合并骨转移。但本研究尚未发现重复消融与肝外转移之间存在相关性。故本研究认为,重复消融一个病灶并不会增加肿瘤肝外转移风险,但本研究样本较少,结论尚需大样本数据的验证。
总之,原发性肝癌的MWA总体上是安全、有效的,且适用于特殊部位的肿瘤。消融最大径>3 cm肿瘤存在消融不完全的风险。肿瘤最大径>3 cm、Child-Pugh B级、PLT<50×109/L是影响MWA术后患者长期生存的危险因素。
