IGF2基因第2外显子多态性与牛生长性状相关性分析
2022-06-06丁燕玲王鹏飞杨朝云张岩峰周小南史远刚康晓龙
丁燕玲,王鹏飞,杨朝云,张岩峰,周小南,史远刚,康晓龙
(宁夏大学农学院,银川 750021)
【研究意义】在肉牛产业中,生长性状是重要的经济性状,直接影响养殖经济效益。生长性状属于数量性状,受饲料类型、饲养管理、温度等环境因素影响,但遗传因素起最重要作用。动物个体生长性状的最终表现型主要受到与其相关的基因影响[1]。因此,利用分子标记辅助育种技术鉴定出与生长性状相关的分子标记,可节约养殖场生产成本,为优良性状的选育提供遗传素材。【前人研究进展】胰岛素生长因子(Insulin-like Growth Factors,IGFs)对内分泌系统起主要调控作用,最初被描述为生长激素的体液介质,这个信号网络参与调节人及动物的发育[2]、能量平衡及细胞功能[3-4],在葡萄糖、蛋白质和脂质代谢中发挥重要作用[5]。构成IGF系统的蛋白质IGF1/IGF2、表面受体和IGF结合蛋白通过丝氨酸/苏氨酸蛋白激酶1(Serine/threonine-protein kinase 1,AKT1)、丝裂原活化蛋白激酶(Mitogen Activated Protein Kinase,MAPK)和磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)调节与生长发育相关的功能[6]。研究发现IGF家族成员之一的胰岛素样生长因子2(Insulin-like Growth Factor 2,IGF2)在肌肉细胞发育中起主要作用,其作用机制为IGF2作为生长激素发挥作用的中间信使,即生长激素首先作用于IGF2基因,再由IGF2基因作用于靶器官,进而发挥促进机体生长发育的作用[7]。Van等[8]研究发现猪的IGF2基因内含子3-G3072A突变是影响肌肉生长和脂肪沉积的关键数量性状位点;Yan等[9]研究认为IGF2基因中2个SNP(g.281766 G>A 和 g.291322 C>T)与德州母驴的体长和臀高显著相关(P<0.05);Huang等[10]研究认为IGF2基因SNP1(内含子8-G17A)、SNP2(内含子8-C220T)、SNP3(内含子8-A221G)及SNP4(内含子8-A1393G)4个SNPs位点突变与秦川牛体重、体长、胸围、胸深显著相关(P<0.05);国外肉牛品种中,IGF2基因SNPs位点c.-292C>T、g.73A>g以及g.751A>g与西门塔尔牛胴体重和眼肌面积显著相关(P<0.05),且IGF2:c.-292C>T单核苷酸多态性与西门塔尔公牛群体中脂肪百分比的影响有关[11]。【本研究切入点】大量的研究表明IGF2基因在不同物种中SNP位点的突变与脂肪沉积,体重、体长、胸深等体尺性状密切相关,说明IGF2基因对家畜生长性状和肌肉生长发育具有重要作用。【拟解决的关键问题】本研究采用PCR-RFLPs技术探究IGF2第2外显子多态位点与秦川牛、西门塔尔牛、安格斯牛及新疆褐牛四种品种牛群体的多态性及与生长性状的相关性,以期为肉牛的育种和遗传改良提供依据。
1 材料与方法
1.1 试验动物及DNA提取
随机抽取宁夏地区某牛场月龄相近(12月龄左右)的4个肉牛品种共91头(秦川牛29牛,安格斯牛15头,西门塔尔牛28头,新疆褐牛19牛),其中秦川牛分别在12、18、24及30月龄测定收集了体重、体尺相关数据,依据标准方法测定牛体重、体斜长、体高、胸围、管围、腰角宽等生长性状[12]。每头牛尾根采血3~6 mL放入EDTA真空采血管中,摇匀后迅速放入冰盒中带回试验室,-80 ℃冷冻保存备用。牛血液基因组 DNA提取利用天根生化科技(北京)有限公司的血液/细胞/组织基因组DNA提取试剂盒(DP304)。
1.2 引物设计与PCR反应体系
本试验采用PCR-RFLPs技术,参考Goodall等[13]设计的引物,扩增IGF2基因第2外显子全长217 bp,然后用限制性内切酶BsrⅠ(NEB,北京)酶切。引物由生工生物工程(上海)股份有限公司合成,引物序列信息为:上游,5′-CCTCAGCCTCATCCCCTCCTTTGC-3′;下游,5′-CTGTGCTCTATTTGCTGTGTTGTCT-3′。PCR扩增体系为20 μL:其中2×Taq酶(5 U/μL)10 μL、血液DNA模板(50 ng/μL)2.5 μL、上下游引物各(10 pmol/μL)0.4 μL、ddH2O 6.7 μL。反应条件:95 ℃预变性30 s;95 ℃变性10 s,63.8 ℃退火30 s,72 ℃延伸30 s,共40个循环;4 ℃保存,共40个循环。
1.3 酶切
酶切总体积为20 μL,其中PCR扩增产物6 μL,限制性内切酶BsrⅠ(5 U/μL)0.4 μL、10×Buffer 2 μL、剩余体积加ddH2O 11.6 μL补充,混匀后,根据说明书指定的条件于65 ℃酶切30 min,待酶切完全后,用4%的琼脂糖凝胶电泳检测。
1.4 数据分析
利用Excel 2018软件统计各基因型在群体中的基因型频率和等位基因频率,并进行Hardy-Weinberg平衡检验及多态信息含量(PIC)、群体纯合度(Ho)、群体杂合度(He)和有效等位基因数(Ne)分析。采用SAS统计软件的一般线性模型(GLM)分析基因型效应对生长性状的影响,采用固定模型:Yij=u+Gi+Eij,式中Yij为个体表型记录,u为群体均值,Gi为标记基因型效应,Eij为随机误差。
2 结果与分析
2.1 IGF2基因的PCR-RFLPs结果
对不同群体牛IGF2基因第2外显子进行PCR扩增,扩增片段长度为217 bp,琼脂糖凝胶电泳检测结果见图1。扩增条带明亮清晰,目标片段大小与预期结果一致,可用于PCR-RFLPs分析。

M:50 bp DNA ladder;1~6: PCR扩增产物
在IGF2基因第2外显子的185 bp 处, 有一个固有的BsrⅠ酶切位点,突变型在150 bp处又有一个酶切位点,从而得到3种基因型,分别为AA型、BB型、AB型。如图2所示,用限制性内切酶BsrⅠ对扩增产物进行酶切,4%琼脂糖凝胶电泳检测,发现AA基因型包括185、32 bp 2个片段,BB基因型包括150、35、32 bp 3个片段,AB基因型具有185、150、35、32 bp 4个片段,酶切产物电泳条带清晰,片段大小与预期一致。
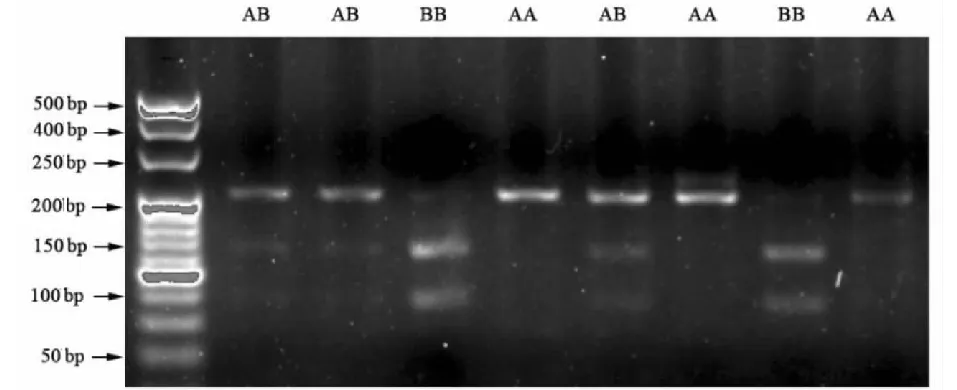
M: 50 bp DNA ladder; AA、AB和BB为不同的基因型
2.2 不同肉牛群体IGF2基因遗传多态性分析
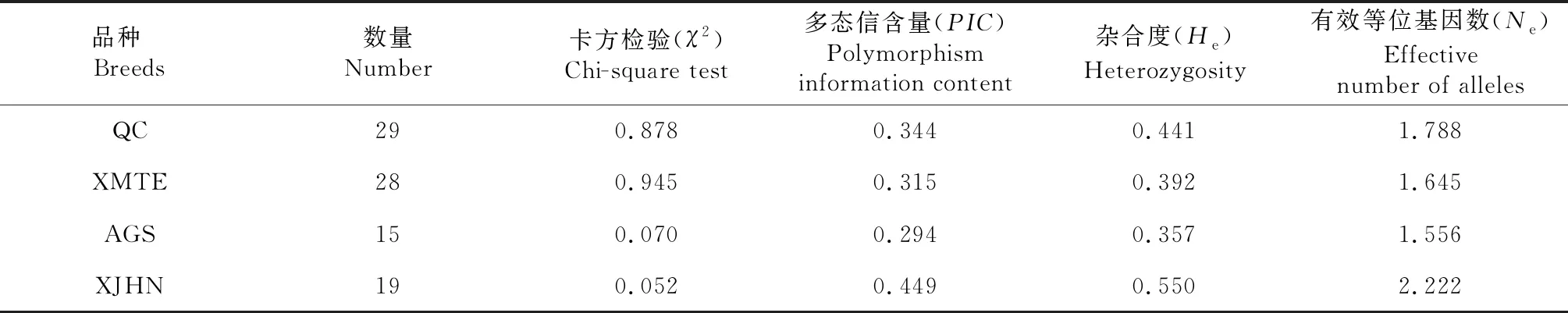
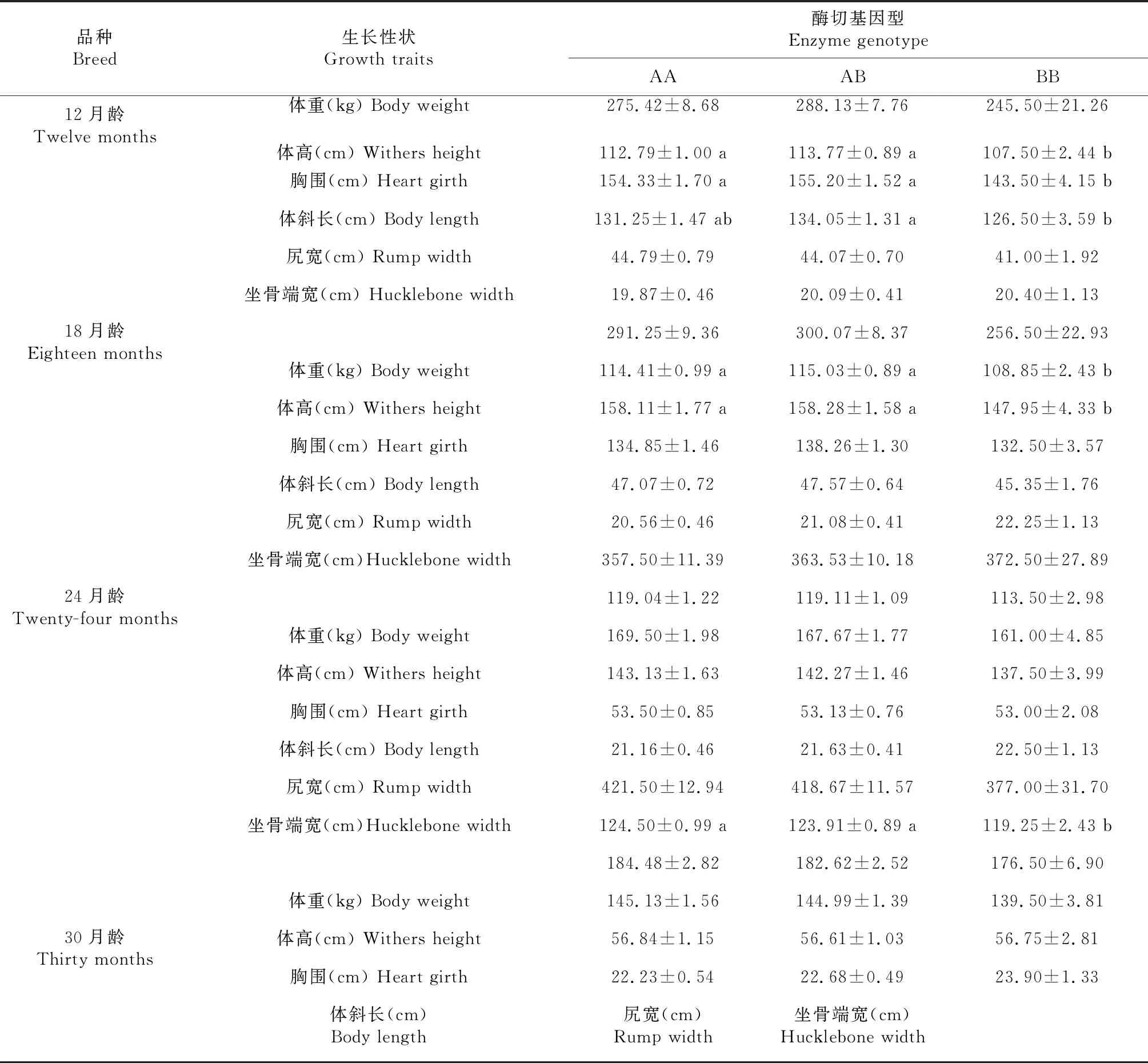
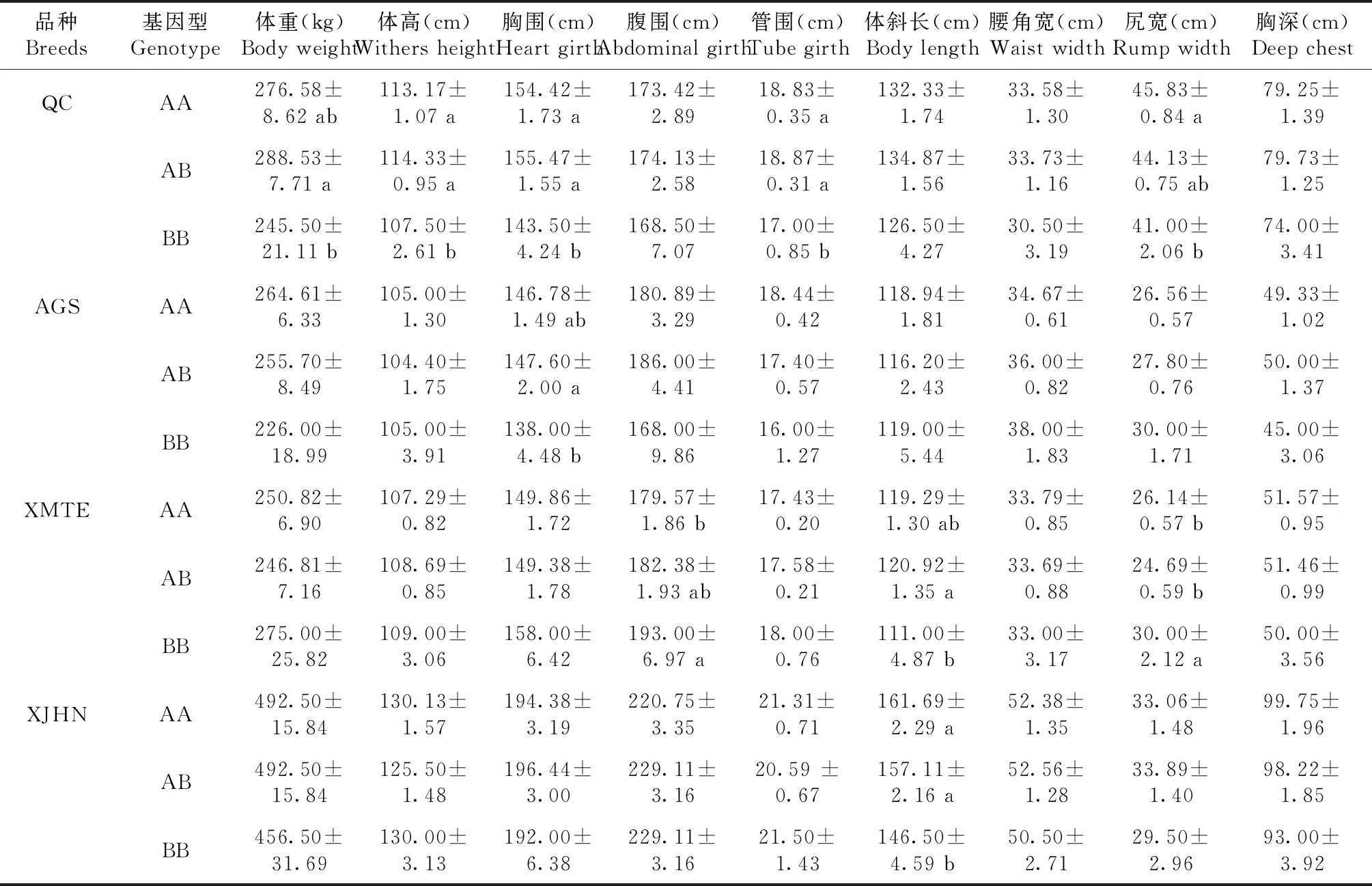
根据PCR-RFLPs电泳图谱进行基因分型,并计算各基因型频率和等位基因频率(表1)。结果显示:秦川牛中AA基因型频率为0.414,AB基因型频率为0.517,BB基因型频率为0.069,A等位基因频率为0.672,B等位基因频率为0.328;西门塔尔牛AA基因型频率(0.500)高于AB、BB基因型频率(0.464、0.036),A等位基因频率为0.732,B等位基因频率为0.268;安格斯牛AA、AB、BB基因型频率分别为0.600、0.333和0.067,A等位基因频率为0.767,B等位基因频率为0.233;新疆褐牛AA、AB、BB基因型频率分别为0.421、0.474、0.105,A等位基因频率为0.658,B等位基因频率为0.342;在所有检测品种中,A为优势等位基因。χ2检验(表2)表明,在研究的所有牛品种中,IGF2基因第2外显子SNP位点处于Hardy-Weinberg平衡状态(P>0.05),该位点在秦川牛、西门塔尔牛及安格斯牛中的纯合度高(分别为0.559、0.608、0.643),杂合度低(分别为0.441、0.392、0.357),而在新疆褐牛中则相反,其纯合度低(0.450),杂合度高(0.550);IGF2基因第2外显子SNP位点的PIC分别为:秦川牛0.344、西门塔尔牛0.315、安格斯牛0.294、新疆褐牛0.449,4个群体都具有多态性且均属于中度多态(0.25 表1 不同牛品种IGF2基因频率 表2 不同牛品种IGF2基因群体遗传参数 秦川牛IGF2基因第2外显子多态性与生长性能相关性分析表明(表3),AA、AB型个体12月龄体斜长显著高于BB型(P<0.05),其他月龄体斜长无显著影响(P>0.05);12、18月龄AA、AB型个体胸围显著优于BB型个体(P<0.05),其余各项指标基因型间差异不显著(P>0.05)。 表3 秦川牛IGF2基因第2外显子SNP多态性与生长性状相关性分析 为了进一步探究不同品种间IGF2基因第2外显子对不同基因型个体生长性状的相关性,利用最小二乘法对IGF2基因第2外显子不同基因型与不同品种生长指标进行显著性检验。如表4所示,IGF2基因第2外显子PCR-RFLPs多态位点对秦川牛和安格斯牛胸围、西门塔尔牛和新疆褐牛体斜长以及秦川牛和西门塔尔牛尻宽有显著影响(P<0.05),其中秦川牛AA、AB基因型个体体重、体高、管围及尻宽显著优于其余品种BB型个体(P<0.05);AA、AB型个体秦川牛和安格斯牛的胸围显著优于西门塔尔牛及新疆褐牛(P<0.05);而腰角宽和胸深在各品种间差异不显著(P>0.05),说明该位点在肉用牛品种间基因型分布存在显著差异,即各个肉牛品种的选育程度不同。 表4 IGF2基因位点对五个品种牛不同基因型生长性状差异性分析 IGF2基因参与调控胆固醇合成[14-15]、葡萄糖代谢[15]及体重的增长[16],沉默IGF2基因能显著减缓出生胎儿的生长速度[17],且在2-型糖尿病患者中,IGF2基因的低表达与体重增加的风险有关,因此IGF2已经成为研究人类2-型糖尿病及肥胖等代谢性疾病的重要候选基因之一[18];成年转基因小鼠肝脏中过表达IGF2基因可增加胰岛素刺激的葡萄糖摄取,降低脂肪沉积[19],该基因也可作为肌肉特异性增强子,通过雷帕霉素信号通路调节成肌细胞的增殖、分化、迁移等,最终影响肌肉生长发育[20]。此外,有研究发现,IGF2基因第2外显子SNP位点与秦川牛、南阳牛、夏洛莱牛等部分生长性状显著相关[21]。因此,研究IGF2基因遗传变异对肉牛生长发育的影响至关重要。 IGF2基因的多态性在不同畜禽中均有报道,如Wang等[22]发现IGF2基因第2外显子存在G-C的突变,该SNP位点突变与鸡生长性状关联分析发现AA基因型鸡与BB基因型鸡的3周龄体重、胸宽差异显著(P<0.05),BB基因型鸡的腹部脂肪显著高于AA基因型鸡(P<0.05);利用高分辨率溶解曲线(HRM)技术检测90头天祝白牦牛IGF2基因外显子10的基因型,并对基因型与生长性状进行关联分析,发现AA基因型在体重、体斜长、胸围方面明显高于BB基因型(P<0.05)[23];Huang等[24]对秦川牛IGF2基因SNPs检测及其与生长性状相关性分析时,发现SNP1 AA(内含子8 G17A)基因型个体的体重、体斜长及胸宽显著高于BB基因型个体;本研究中,秦川牛AA基因型个体体高、体斜长、胸围也显著高于BB基因型个体(P<0.05),这与Huang等[6]的实验结果相同。对IGF2基因第2外显子基因型与不同品种牛生长指标进行比较,得出秦川牛AA、AB基因型个体体重、体高、管围及尻宽显著优于其余品种BB型个体(P<0.05);AA、AB型个体秦川牛和安格斯牛的胸围显著优于西门塔尔牛及新疆褐牛(P<0.05),但与西门塔尔牛品种相比,秦川牛具有生长发育缓慢的特征,本实验结论却与此不符,这可能是由于采样时其他品种牛为新引进个体,受到环境迁移、饲料改变等应激,导致生长发育缓慢,也可能是样本量差异所致。Hardy-Weinberg平衡定律可揭示群体基因频率和基因型频率的遗传规律,据此使群体的遗传性能保持相对稳定,这是畜禽保种的理论依据。本研究中,χ2检验表明IGF2基因第2外显子多态性在所研究的牛品种中均处于Hardy-Weinberg平衡状态(P>0.05),说明人工选育、遗传漂变、迁移和自然选择等各种干扰因素间相互抵消,使群体依然保持动态平衡状态。安格斯牛作为优质肉牛品种,受选择强度较大,但从该角度考虑,其产肉性能未得到很好的选择,说明群体经人工选育使这一基因座的选择压力较小,因此可以通过必要的人工选育来提高突变基因型在群体中的频率。群体内的遗传变异程度通常用He、Ne和PIC来衡量,其值的高低体现出群体内的均匀度,值越高,表明存在的遗传变异和选择潜力越大[24]。通过遗传多态性分析发现,该位点在所研究群体中均属于中度多态(0.25 IGF2基因第2外显子具有中度多态性,秦川牛、安格斯牛、西门塔尔牛及新疆褐牛在该位点存在遗传多态性。生长性状相关性分析发现,所有品种中A为优势等位基因;秦川牛AA、AB基因型个体在体斜长、胸围上显著优于BB型个体(P<0.05);不同品种相比,AA、AB基因型秦川牛和安格斯牛的胸围显著优于西门塔尔牛及新疆褐牛(P<0.05);A等位基因能增加肉牛的生长速度,有利于肌肉的生长发育,因此该位点可作为肉牛生长性状选育的潜在分子遗传标记,可将IGF2基因作为影响肉牛生长性状的候选基因。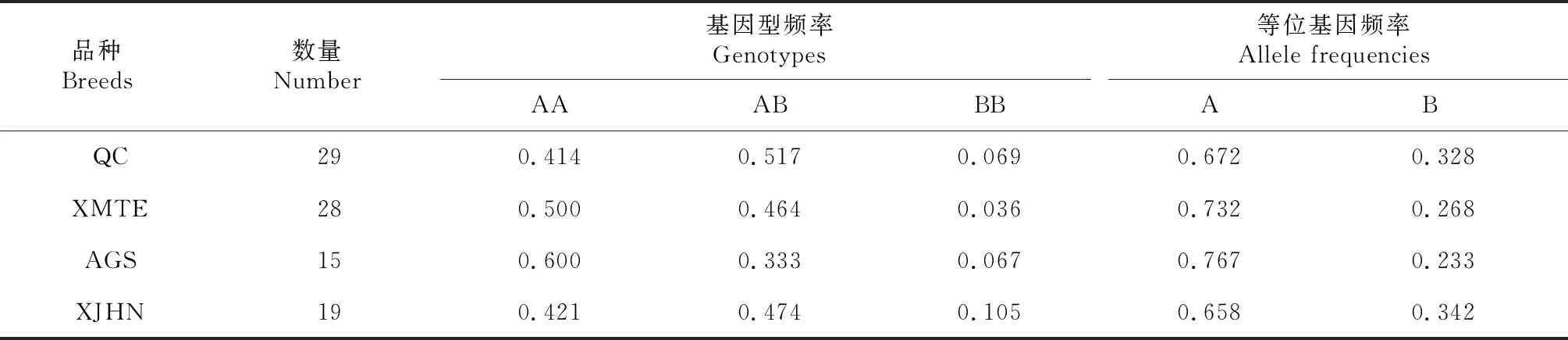
2.3 IGF2基因SNP位点多态性与生长性状的相关性分析
3 讨 论
4 结 论
