阿里牦牛经济性状相关遗传标记基因型频率研究
2022-06-06洛桑顿珠鲜莉莉平措占堆索朗多吉旦巴加参巴桑旺堆
张 强,洛桑顿珠,鲜莉莉,平措占堆,索朗多吉,巴 多,旦 巴,旦巴加参,支 张,巴桑旺堆
(1.省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,拉萨 850000;2.西藏自治区农牧科学院畜牧兽医研究所,拉萨 850009;3.西藏阿里地区农业农村局,西藏 阿里 859000;4.西藏阿里改则县农业农村局,西藏 阿里 859200)
【研究意义】牦牛(Bosgrunniens)广泛分布于中国青藏高原海拔3000 m以上的地区,其不仅可作为农耕和高原运输工具,还可以为当地牧民提供奶、肉、毛、役力、燃料等生产生活必需品,是青藏高原牧民重要的生活和经济支柱。目前,由于受到不同自然生态条件的自然选择塑造,我国青藏高原牦牛资源形成了大量适应性强和生产力各具特色的优秀地方资源群体[1]。故而对不同地理分布的牦牛新资源进行种质资源保护状态评价及遗传改良评估是提升区域牦牛产业健康发展的重要途径[2]。【前人研究进展】单核苷酸多态位点(Single nucleotide polymorphism, SNP)作为基因组中分布最广泛的遗传变异类型,被广泛用于物种起源进化、种群迁徙等领域研究。特别是在家养动物育种方面也扮演着重要的角色,如利用全基因组重测序技术对重要经济性状的受选择区域进行候选基因挖掘[3-5];全基因高密度SNP芯片(DNA chip)用于家养动物经济性状全基因组关联分析进而筛选相关关键候选遗传标记[6-7]。与高成本的全基因组高通量测序技术和微阵列芯片相比,单个重要候选基因的SNP标记与经济性状间关联分析在经济性状重要候选基因定位中应用更为广泛。如,通过单基因SNP关联分析研究发现在家鸡上大量来自MyOD,IGF-I,IGFBP-3,ESM1和Smad3等基因的SNPs与多种屠宰、繁殖和生长性状相关[8-12],对黄牛和水牛的研究也发现一系列与生长性状相关的候选基因,如CDC10[13],MOGAT1[14],SPARC[15],PLAG1[16],IGF2[17]。另外发现GH和GHR基因与水牛的生长和产奶量相关[18-19]。尽管由于牦牛的生活环境限制而导致针对牦牛的经济性状相关候选基因挖掘的研究较少,但仍有一些列与牦牛的经济性状相关的候选基因的分子标记被鉴定。如研究发现一个来自MC4R基因的SNP (1069GC)与麦洼牦牛18 月龄体重显著相关(P<0.01)[20]。位于LPL基因编码区域中的外显子7的错义突变位点SNP(19913CT)与牦牛的体重相关(P<0.01),平均日增重、腰眼面积和内脏脂肪重量都具有显著相关性[21]。【本研究切入点】阿里地区位于西藏西部,平均海拔4500 m,有“世界屋脊之屋脊”、“世界第三极”、“生命之禁区”的称号。当地天然草场数量充沛,是良好的牦牛生产基地,阿里牦牛作为阿里地区特有的牧业资源,牦牛种群数量巨大,为当地牧民提供了肉、奶、役力等重要生产资料。本研究通过对阿里牦牛多种经济性状的分析,从而获得期望的结果。【拟解决的关键问题】本研究根据已报道的与牦牛多种经济性状具有显著相关性的候选遗传标记在西藏阿里牦牛生态类群内优势基因型分布情况,以期评估种群遗传改良的潜力。其次,对该群体的遗传多样性和群体结构进行评估,为今后牦牛的遗传资源保护工作提供理论参考。
1 材料与方法
于2020年5月赴阿里地区改则县牦牛牧场(81°59′86″N;31°30′35″E)收集无血缘关系的青年健康阿里牦牛62头(年龄为3~5岁),每只牦牛收集静脉血液5 mL。利用GNTTM血液DNA提取试剂盒(吉恩生物,中国)提取牛血液全基因组DNA。DNA浓度利用NanoDrop2000DNA微量核酸蛋白测定仪检测,1%琼脂糖凝胶电泳检测DNA质量和完整性。
根据位点对应牦牛参考基因组(BosGru_v2.0)序列信息,使用PrimerPlex 2软件设计PCR反应引物(表1~2),单碱基延伸引物使用primer3plus(http://www.primer3plus.com/)设计,并交由武汉天一华煜基因科技有限公司(武汉,中国)合成引物。
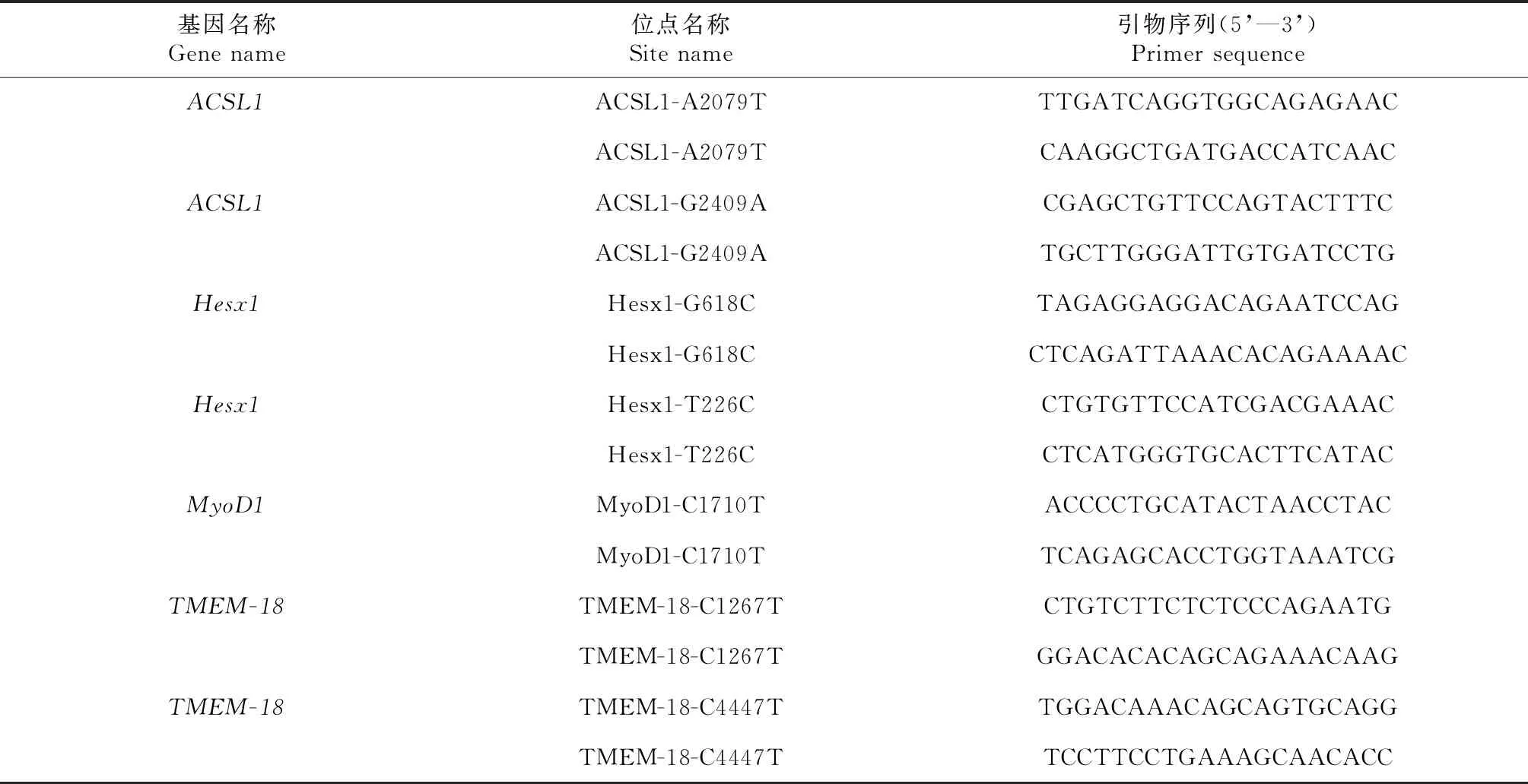
表1 7个牦牛生长性状相关SNP标记扩增引物信息
PCR扩增体系:5 μL 2×TaqPCR Mix,上下游引物各0.5 μL,1 μL DNA(20 ng/μL),3 μL ddH2O补足体系至10 μL。PCR 扩增程序:95 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸80 s,循环40次;72 ℃延伸 10 min。SAP消化体系对PCR产物进行纯化,详细步骤如下:使用虾碱酶纯化法将残余dNTPs去磷酸化,降解游离单链引物。取4 μL PCR产物,加入2 μL EX-SAP酶[其中包含ddH2O 0.75 μL,SAP(1 U/μL) 0.5 μL,ExoI(5 U/μL) 0.15 μL,10×SAP buffer 0.6 μL]。孵育程序:37 ℃ 40 min,85 ℃ 5 min,4 ℃保存。
将混合PCR产物模板纯化后进行电泳鉴定,根据浓度定量稀释。将稀释后的PCR产物作为模板进行SNaPshot反应。反应体系:SNaPshot Mix 0.5 mL,Pooled PCR Products 3 mL,Pooled Primers 1 mL,ddH2O 0.5 mL,即配制成5.0 mL的反应体系;SNaPshot反应程序:95 ℃ 2 min;95 ℃ 10 s,52 ℃ 5 s,60 ℃ 30 s,40个循环,4 ℃ 保存。
SNaPshot产物纯化体系:直接向SNaPshot反应产物中加入2 μL SAP Mix[包含H2O 0.9 μL,SAP (1 U/μL) 0.5 μL,10×SAP buffer 0.6 μL)];SNaPshot产物消化反应程序:37 ℃ 40 min,75 ℃ 15 min,4 ℃ 保存。
取2 μL消化后的SNaPshot反应产物加入到含有0.4% LIZ120 8 μL去离子甲酰胺中,95 ℃变性5 min,然后放-20 ℃骤冷,PCR产物由武汉天一华煜基因科技有限公司(武汉,北京)利用ABI3130XL(美国AB应用生物系统公司,美国)完成测序,并利用Genemarker进行SNP位点的基因型判定。
原始分型数据利用Microsatellite Toolkit软件包计算各遗传位点及群体的等位基因数(NA)、多态信息含量(PIC)、观察杂合度(HO)和期望杂合度(HE)等。用Arlequin 3.5软件[22]进行群体内各位点哈代温伯格平衡检验(HWE)。
2 结果与分析
从表3可知,Hesx1_G618C标记在所在的全部个体中都为纯合子G/G型。而来自于相同HesxI基因的另一个标记(Hesx1_T226C)在阿里群体内具有一定多态性,但高频率为T/T(82.2581%),等位基因T频率为91.1300%。另外,ACSL1_A2079T 位点在群体内最高频率基因型为A/A(67.7419%),最低为T/T型(3.2258%),其中等位基因A和T频率分别为82.2600%和17.7400%。ACSL1_G2409A位点的最高基因型为G/G型(58.0645%),最低为A/A型(11.2903%)。MyoD1_C1710T位点50%的个体携带C/T基因型,C/C 和T/T的频率仅为25.8065%和24.1935%,其中等位基因C和T的频率基本相当(C=49.1900%,T=50.8100%)。来自TMEM-18基因的2个位点(TMEM-18_C1267T,TMEM-18_C4447T)在群体内携带的最高频率基因型均为C/C,且T/T为稀有等位基因型(1.6129%~3.2258%)。

表2 7个牦牛生长性状相关SNP标记单碱基延伸测序引物信息

表3 阿里牦牛群体内7个牦牛生长性状相关SNP标记基因型频率及遗传多样性信息
由于Hesx1_G618C全部个体都为G/G型,故而其HE、PIC和HO均为0,且无法进行哈代—温伯格平衡检验。剩余位点中HO最高为MyoD1_C1710T(HO=0.5000)和ACSL1_G2409A(HO=0.3065),最低是TMEM-18_C4447T和TMEM-18_C1267T,均为0.1452。HE值高低排序与HO规律一致,且在群体内各位点的HO和HE间存在分歧,但差距较小。PIC结果显示,其值分布范围为0.3749(MyoD1_C1710T)~0.1486(TMEM-18_C4447T和Hesx1_T226C),即全部位点中仅有2个(MyoD1_C1710T和ACSL1_G2409A)具有中度多态位点(0.25 本研究利用SNaPshot基因分型技术对已明确与牦牛经济性状相关的7个候选SNPs标记在阿里牦牛群体内基因型分布开展进行评价,发现阿里牦牛群体携带大量重要经济性状标记相关标记的优势基因型。众所周知,垂体作为性腺轴成员,其在调控多种生长相关激素过程中起了至关重要作用,尤其是垂体前叶分泌的生长激素(Growth hormone, GH)在影响动物生长的作用被广泛证实[23-24]。研究表明,ES细胞表达同源异型盒基因(Homeobox expressed in ES cells, HesxI)是参与胚胎早期垂体发育的重要基因,影响肾上腺皮质激素和甲状腺素刺激素分泌[25-27],尤其是HesxI基因对垂体前叶分泌生长激素具有调控作用[24,28-29]。 在HesxI基因的内含子1区域发现的SNP标记与南阳牛日增重有显著相关,在外显子4的突变位点与南阳牛胸围、6月龄平均日增重、秦川牛的胸围和体质量等指标都存在显著相关[30]。在对山羊的研究中,HesxI基因中一些SNP位点被证实与山羊体质量有显著联系,且A/A为优势基因型[31]。尤其是在青海大通牦牛的无角牦牛群体中发现,多个来自HexsI基因的SNPs与其生长性能相关,如HesxI_G-618C与6月龄和12月龄无角牦牛体质量、体高、胸围均有极显著相关(P<0.01),另外,HesxI_T226C与12月龄无角牦牛的体重、体高、胸围均有显著相关(P<0. 05)[32]。本研究发现阿里无角牦牛群体中HesxI_G-618C位点为纯合G/G型,但在无角牦牛群体内该位点位G/G:76.4000%,G/C:23.6000%。且G/G型为6月龄体质量和胸围、12月龄体斜长和体质量、18月龄体质量的非优势基因型[32]。表明HesxI_G-618C位点在阿里牦牛群体内不具备分子遗传改良与评估价值。另外,尽管约82.0000%阿里牦牛个体携带HesxI_T226C位点的T/T型,但仍有17.7419%的个体携带T/C型频率,已有研究表明其与青海无角牦牛12月龄体质量、体高和胸围的关联分析研究中确定T/C为优势基因型[32],故阿里牦牛在HesxI_T226C位点内具有一定改良潜力。 来自于肌肉调节因子(Muscle Regulatory Factors, MRFS)家族的生肌决定因子(Myostatin 1, MyoD1)是调控骨骼肌生成的重要转录因子,它能够激活肌肉基因转录,使非肌细胞转变为肌细胞,调控肌细胞的融合,促进成肌细胞分化为肌管,进而融合为肌纤维,是调控脊椎动物胚胎期肌肉发育过程的主调控因子[33-34],同时有研究证实该基因也与坏损组织修复存在密切关联[34]。在家养动物方面,目前大量在MyoD1基因区域的遗传变异与家养动物的生长和肉品质经济性状呈显著相关,如筛选获得MyoD1基因内含子1区的位点突变(T→A)在高邮鸭的49日龄的体重、胸肌重、胸肌横截面积、胸肌纤维直径以及胸肌纤维密度均显著相关(P<0.05)[35]。猪MyoD1基因外显子4上发现一个同义突变SNP(c.783 GA)与天府黑兔、伊拉兔和香槟兔的全净膛重、半净膛重间呈显著相关(P<0.05)[36]。在长白猪和大白猪的MyoD1基因第1内含子第257位存在1个A/C颠换被证实与肉色评分和失水率相关(P<0.05或P<0.01)[37]。在多个新疆地方绵羊群体中发现MyoD1基因第一外显子的突变与其产肉性能有关[38-39]。在牛上同样也发现在MyoD1基因内存在大量与其生长和屠宰性状相关的遗传标记[40-41]。尤其,研究发现申扎牦牛MyoD1基因外显子3上的SNP(MyoD1_C1710T)与体尺性状显著(P<0.05)相关,C/T为优势基因型[42]。本研究发现这个位点优势基因型在阿里牦牛群体中频率为50%,暗示利用该标记在此群体内进行分子选育的潜力巨大。 大量研究表明跨膜蛋白18(Transmembrane protein, TEME18)影响癌细胞的代谢和调节[43-44]并参与神经元干细胞的迁移[45]。尤其是近些年研究发现TEME18可通过神经调节而参与脂肪细胞的分化,从而影响机体肥胖[46-47]。通过人的全基因组关联分析(GWAS)发现TMEM18基因存在与人类食欲及生长发育相关的遗传变异标记[48-49]。在家养动物中也发现TMEM18基因中多个SNP与猪和牛的多个生长经济性状相关[50-51]。尤其是新近在天祝牦牛中发现TMEM18基因SNP标记(C1267T)位点与牦牛的体高、体重和屠宰率差异显著(P<0.05)。另外,TMEM18_C4447T位点与牦牛的体斜长、管围、胸围、体重、胴体重、净肉重、净肉率和屠宰率均存在显著性差异(P<0.05)[52]。本研究发现,两个来自于TMEM18基因的SNP位点在阿里牦牛群体中都主要携带C/T和C/C,而T/T型稀少。据已有研究报道称TMEM18_C4447T的C/T和C/C较T/T基因型在胸围、管围及体斜长指标上均具有优势,其性能均高于T/T型个体携带者[52]。 长链酰基辅酶A合成酶1(Long chain acyl-CoA synthetase 1, ACSL1)被证实广泛参与甘油三酯、磷脂、胆固醇酯的合成及脂肪酸氧化作用[53-55]。众所周知,鲜乳中最重要指标之一的乳脂,其98%~99%是甘油三酯,主要由甘油和长链脂肪酸组成。有研究表明小鼠肝脏细胞及脂肪细胞中过表达ACSL1可增加长链脂肪酸转化为甘油三酯[56],故而理论上该基因能够间接提高乳脂率。在家养动物中也发现ACSL1被定位到影响猪(Sus scrofa)肉中脂肪酸组成的QTL区域[57]。另外,有研究发现ACSL1基因多态性与肉牛骨骼肌中脂肪酸组成和比例呈显著相关[58]。尤其,新近研究发现ACSL1基因区域的大量遗传变异与荷斯坦奶牛的产奶量的性状呈显著相关,包括日产奶量(TDMY)、脂肪含量(FC)、蛋白质含量(PC)和体细胞评分(SCS)[31]。 牦牛上,已有报道称位于ACSL1基因启动子区存在2个SNP位点(ACSL1_A2079T和ACSL1_G2409A)并被证实与甘南牦牛的乳蛋白率及总固体物质含量、乳脂率等乳性状显著相关,且携带ACSL1_A2079T的T/A基因型个体的乳白蛋白率高于A/A型个体,携带ACSL1_G2409A位点的A/A型个体乳脂率和总固体含量指标优于其他基因型个体[59]。本研究的阿里牦牛群体中CSL1_A2079T位点携带T/A者占总群体的29.0323%,另外阿里牦牛携带ACSL1_G2409A位点的A/A基因型个体占种群11.2903%。这表明暗示阿里牦牛群体内具有较高频率ACSL1基因与产乳性能及乳品质候选标记的优势基因型。最后,本研究中全部个体均未在阿里牦牛群体内显著偏离哈代—温伯格平衡,暗示了阿里牦牛历史上没有经历强烈的人工选择。 研究结果显示阿里牦牛群体在与生长及泌乳性状相关基因的候选标记座位上携带高比例优势基因型,如Hesx1-T226C、MyoD1-C1710T及TMEM-18-C4447T,表明阿里牦牛具有优秀的分子遗传改良潜力。3 讨 论
4 结 论
