鸭产蛋循环中IP3R1、SLC4A4基因的组织表达及其对子宫Ca2+浓度的影响
2022-06-06张才在王丹丹刑文昊廖朝美张依裕
吴 燕, 龙 霞, 张才在, 王丹丹, 刑文昊, 廖朝美, 张依裕
(贵州大学动物科学学院高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025)
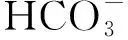
1 材料与方法
1.1 材料
选取饲养于贵州大学家禽研究所科研农场30周龄产蛋高峰期的三穗鸭20只,要求体质相近、产蛋率一致.
1.2 样品采集
观察鸭个体的产蛋时间,并掌握其产蛋规律,按产蛋时间的集中程度分为4组,每组5只,分别于卵位于卵巢(产蛋后0 h)、膨大部(产蛋后2 h)、峡部(产蛋后5 h)、子宫(产蛋后16 h)时对供试鸭进行全部宰杀,并迅速采集心脏、肝脏、脾脏、肺脏、肾脏、大肠、小肠、十二指肠、胰脏、肌胃、腺胃、子宫、胸肌.采集后的组织置于冻存管中,置冰箱(-80 ℃)中保存备用.
1.3 总RNA的提取与cDNA的合成
采用Trizol法提取鸭各组织样品的总RNA,用琼脂糖凝胶电泳检测RNA的完整性.采用反转录试剂盒(赛默飞世尔科技公司)将RNA逆转录合成cDNA,用超微量紫外分光光度计检测cDNA的浓度和完整性,置冰箱(-20 ℃)中保存备用.
1.4 引物的设计与合成
根据GenBank公布的鸭IP3R1基因(NC_051784.1)和SLC4A4基因(NC_040049.1)CDS区序列,进行三穗鸭IP3R1、SLC4A4基因实时荧光定量PCR扩增.以β-actin(GenBank登录号:EF667345)作为内参基因,运用Primer Premier 5.0软件设计3对引物,引物信息如表1所示.所有引物均由上海生工生物工程有限公司合成.
1.5 实时荧光定量PCR检测
采用实时荧光定量PCR技术检测鸭各组织样品中IP3R1、SLC4A4基因的相对表达量.PCR反应体系(10 μL):5 μL 2×Taq Master Mix,上、下游引物各0.5 μL,1 μL cDNA模板,最后加双蒸水至10 μL.每个样品设置3个重复.PCR反应程序:50 ℃下激活尿嘧啶DNA糖基酶(UDG)2 min;95 ℃预变性2 min;95 ℃变性15 s,退火(温度如表1所示)15 s,72 ℃延伸1 min,40个循环;4 ℃保存.

表1 三穗鸭IP3R1、SLC4A4基因的引物信息Table 1 Primer sequences information for the IP3R1 and SLC4A4 genes of the Sansui duck
1.6 子宫Ca2+浓度的测定
采用总蛋白定量测试盒测定子宫组织的总蛋白浓度,再用钙测试盒测定子宫组织的Ca2+浓度.准确称取产蛋循环不同时期子宫组织重量,并分为4个组,每组按重量(g)∶体积(mL)=1∶9的比例加入9倍体积的去离子水,冰水浴匀浆后,于2 500 r·min-1离心.离心结束后,每组取10%上清液到96孔板中,每组设3个重复,同时在96孔板中设置空白组和标准组,分别加入与试验组等体积的去离子水和钙标准液,每组设3个重复,静置5 min,以波长为610 nm的酶标仪测定各孔的光密度(D),并运用公式计算组织中的Ca2+浓度.

1.7 数据处理
运用Excel 2019软件对实时荧光定量PCR数据进行统计分析;参照文献[11]的方法采用2-ΔΔCt法计算IP3R1、SLC4A4基因在三穗鸭各组织中的相对表达量,数据以“平均数±标准误差”表示,用SPSS 22.0软件的单因素方差分析和双变量相关分析的方法分析其差异显著性和相关性.
2 结果与分析
2.1 产蛋循环不同时期IP3R1基因的组织表达差异
表2显示,IP3R1基因在三穗鸭产蛋循环中各组织均能检测到表达.以胸肌为对照,产蛋后0 h,IP3R1基因在肾脏中的表达量达到极显著最大值(P<0.01),其次是胰脏,而在心脏、肝脏、脾脏、肺脏、大肠、小肠、十二指肠、肌胃、腺胃、子宫中的表达量都较低;产蛋后2 h,IP3R1基因在肺脏中的表达量达到极显著最大值(P<0.01),其次是十二指肠,而在心脏、肝脏、脾脏、肾脏、大肠、小肠、胰脏、肌胃、腺胃、子宫中的表达量都较低;产蛋后5 h,IP3R1基因在子宫中的表达量达到极显著最大值(P<0.01),其次是心脏,而在肝脏、脾脏、肺脏、肾脏、大肠、小肠、十二指肠、胰脏、肌胃、腺胃中的表达量都较低;产蛋后16 h,IP3R1基因在肾脏中的表达量达到极显著最大值(P<0.01),其次是肝脏、胰脏、子宫,而在心脏、脾脏、肺脏、大肠、小肠、十二指肠、肌胃、腺胃中的表达量都较低.
表2还显示,各组织IP3R1基因的表达量在鸭产蛋循环不同时期存在显著差异.心脏、肝脏、脾脏、肾脏、大肠、胰脏、子宫IP3R1基因的表达量在16 h达到最大值,极显著高于0~5 h(P<0.01).心脏IP3R1基因在2 h的表达量极显著高于0、5 h(P<0.01);肾脏、胰脏在0 h的表达量极显著高于2、5 h(P<0.01),胰脏在2 h的表达量极显著高于5 h(P<0.01);子宫在5 h的表达量极显著高于0、2 h(P<0.01);肺脏在2 h的表达量极显著高于0、5、16 h(P<0.01),在16 h的表达量极显著高于0、5 h(P<0.01);十二指肠在2 h的表达量极显著高于0、5、16 h(P<0.01),在0 h的表达量极显著高于5、16 h(P<0.01);小肠在5 h的表达量显著低于0、2、16 h(P<0.05);肌胃在0 h的表达量极显著高于2、5、16 h(P<0.01);腺胃在2、16 h的表达量极显著高于0、5 h(P<0.01).其他指标间的差异不显著(P>0.05).

表2 产蛋循环不同时期IP3R1基因的组织表达差异1)Table 2 Expressions of IP3R1 gene in various duck tissues during different time points of egg-laying cycle
2.2 产蛋循环不同时期SLC4A4基因的组织表达差异
表3显示,SLC4A4基因在三穗鸭产蛋循环中各组织均能检测到表达.以胸肌为对照,产蛋后0 h,SLC4A4基因在十二指肠中的表达量达到极显著最大值(P<0.01),其次是肺脏,而在心脏、肝脏、脾脏、肾脏、大肠、小肠、胰脏、肌胃、腺胃、子宫中的表达量都较低;产蛋后2 h,SLC4A4基因在肺脏中的表达量达到极显著最大值(P<0.01),其次是肝脏、腺胃,而在心脏、脾脏、肾脏、大肠、小肠、胰脏、肌胃、子宫中的表达量都较低;产蛋后5 h,SLC4A4基因在肺脏中的表达量达到极显著最大值(P<0.01),其次是子宫,而在心脏、肝脏、脾脏、肾脏、大肠、小肠、十二指肠、胰脏、肌胃、腺胃中的表达量都较低;产蛋后16 h,SLC4A4基因在肺脏中的表达量达到极显著最大值(P<0.01),其次是心脏、大肠、胰脏、子宫,而在肝脏、脾脏、肾脏、小肠、十二指肠、肌胃、腺胃中的表达量都较低.
表3还显示,各组织SLC4A4基因的表达量在鸭产蛋循环不同时期存在显著差异.心脏、肺脏、肾脏、大肠、胰脏、子宫SLC4A4基因的表达量在6 h极显著高于0~5 h(P<0.01).肾脏、大肠SLC4A4基因的表达量在0 h极显著高于2、5 h(P<0.01);肝脏在0、2 h的表达量极显著高于5、16 h(P<0.01);脾脏在0、16 h的表达量极显著高于2、5 h(P<0.01);小肠在2 h的表达量显著高于0、5、16 h(P<0.05);十二指肠、肌胃在0 h的表达量极显著高于2~16 h(P<0.01);肌胃在5 h的表达量极显著高于2、16 h(P<0.01);腺胃在2 h的表达量极显著高于0、5、16 h(P<0.01),在16 h的表达量极显著高于0、5 h(P<0.01).其他指标间的差异不显著(P>0.05).

表3 产蛋循环不同时期SLC4A4基因的组织表达差异1)Table 3 Expression of SLC4A4 gene in various duck tissues during different time points of egg-laying cycle
2.3 产蛋循环不同时期子宫Ca2+浓度的变化
图1显示:产蛋后0~2 h,子宫Ca2+浓度较低;产蛋后5 h,子宫Ca2+浓度逐渐升高,与0~2 h相比,差异达到极显著水平(P<0.01);产蛋后16 h,子宫Ca2+浓度达到最大值,极显著高于0~5 h(P<0.01).

附不同大写字母表示差异极显著(P<0.01).图1 产蛋循环不同时期子宫Ca2+浓度的变化Fig.1 Dynamics of uterine Ca2+ concentration during egg-laying cycle of duck
2.4 产蛋循环不同时期IP3R1基因在各组织的表达量与子宫Ca2+浓度的相关性
鸭产蛋循环不同时期IP3R1基因在各组织的表达量与子宫Ca2+浓度之间的相关性(表4~7)显示:产蛋后0 h,肝脏IP3R1基因的表达量与子宫Ca2+浓度呈显著正相关(P<0.05);胰脏的表达量与子宫的表达量呈显著正相关(P<0.05),与心脏的表达量呈显著负相关(P<0.05);小肠的表达量与肝脏、脾脏的表达量呈显著正相关(P<0.05).产蛋后2 h,胸肌IP3R1基因的表达量与十二指肠的表达量呈显著正相关(P<0.05),与小肠的表达量呈显著负相关(P<0.05);小肠的表达量与十二指肠的表达量呈显著负相关(P<0.05);子宫的表达量与胰脏的表达量呈显著正相关(P<0.05);肝脏的表达量与腺胃的表达量呈极显著负相关(P<0.01).产蛋后5 h,胸肌IP3R1基因的表达量与子宫Ca2+浓度呈显著负相关(P<0.05);小肠的表达量与腺胃的表达量呈显著正相关(P<0.05).产蛋后16 h,小肠IP3R1基因的表达量与子宫Ca2+浓度呈极显著负相关(P<0.01);肾脏的表达量与胸肌的表达量呈显著正相关(P<0.05),肝脏的表达量与十二指肠的表达量呈极显著正相关(P<0.01).其他指标间无相关性(P>0.05).
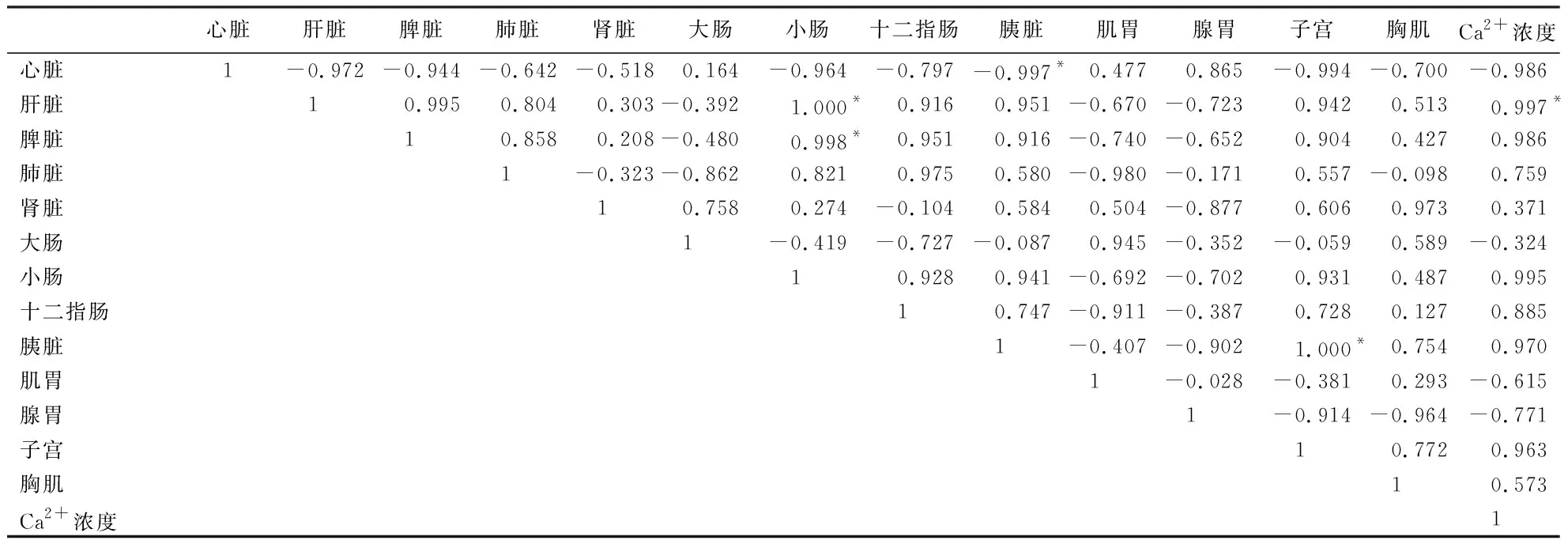
表4 产蛋后0 h,各组织IP3R1基因的表达量与子宫Ca2+浓度的相关系数1)Table 4 Correlation coefficient between the expression of IP3R1 gene in various duck tissues and uterine Ca2+ concentration at 0 h after egg laying
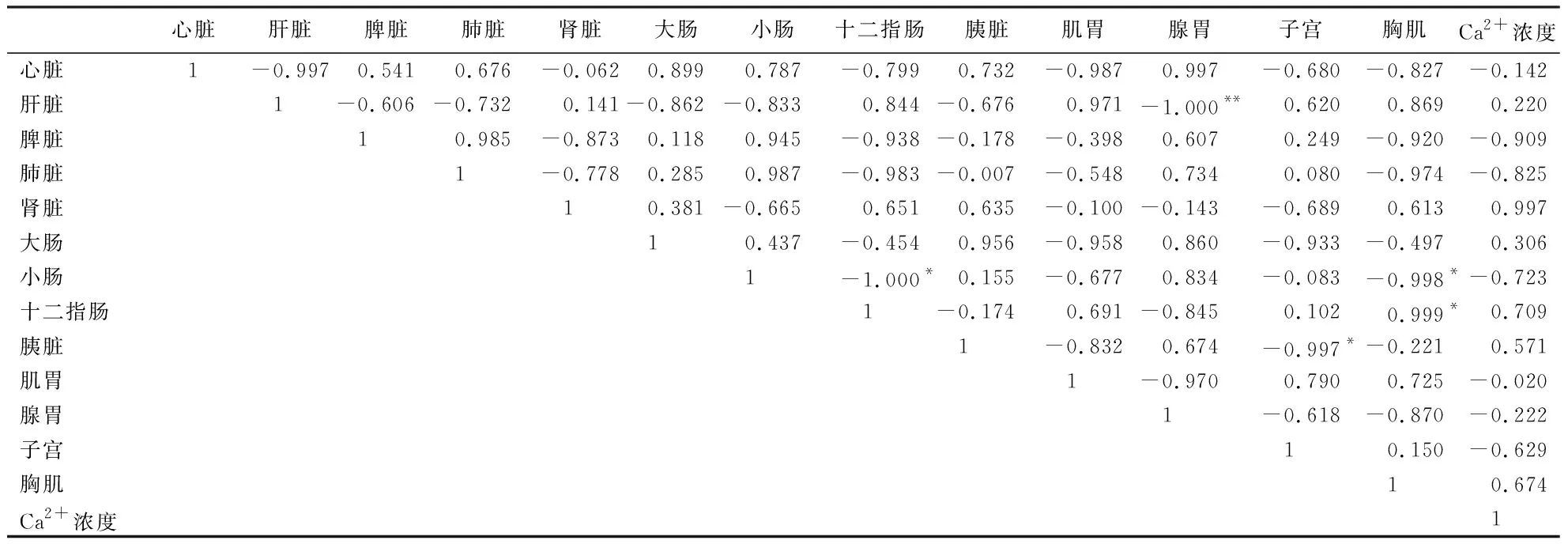
表5 产蛋后2 h,各组织IP3R1基因的表达量与子宫Ca2+浓度的相关系数1)Table 5 Correlation coefficient between the expression of IP3R1 gene in various duck tissues and uterine Ca2+ concentration at 2 h after egg laying

表7 产蛋后16 h,各组织IP3R1基因的表达量与子宫Ca2+浓度的相关系数1)Table 7 Correlation coefficient between the expression of IP3R1 gene in various duck tissues and uterine Ca2+ concentration at 16 h after egg laying
2.5 产蛋循环不同时期SLC4A4基因在各组织的表达量与子宫Ca2+浓度的相关性
鸭产蛋循环不同时期SLC4A4基因在各组织的表达量与子宫Ca2+浓度之间的相关性(表8、表9)显示:产蛋后0 h,十二指肠SLC4A4基因的表达量与大肠、小肠的表达量呈显著负相关(P<0.05);胰脏的表达量与肺脏的表达量呈显著负相关(P<0.05).产蛋后2 h,肝脏SLC4A4基因的表达量与腺胃的表达量呈显著正相关(P<0.05);大肠的表达量与脾脏的表达量呈显著负相关(P<0.05);小肠的表达量与胰脏的表达量呈显著正相关(P<0.05).

表8 产蛋后0 h,各组织SLC4A4基因的表达量与子宫Ca2+浓度的相关系数1)Table 8 Correlation coefficient between the expression of SLC4A4 gene in various duck tissues and uterine Ca2+ concentration at 0 h after egg laying

表9 产蛋后2 h,各组织SLC4A4基因的表达量与子宫Ca2+浓度的相关系数1)Table 9 Correlation coefficient between the expression of SLC4A4 gene in various duck tissues and uterine Ca2+ concentration at 2 h after egg laying
表10、表11显示:产蛋后5 h,脾脏SLC4A4基因的表达量与子宫Ca2+浓度、胸肌的表达量呈显著负相关(P<0.05),与胰脏的表达量呈显著正相关(P<0.05);胰脏的表达量与子宫Ca2+浓度呈极显著负相关(P<0.01);肺脏的表达量与小肠的表达量呈显著负相关(P<0.05),与肌胃的表达量呈极显著正相关(P<0.01);肾脏的表达量与十二指肠的表达量呈极显著正相关(P<0.01);小肠的表达量与肌胃的表达量呈显著负相关(P<0.05);心脏的表达量与肝脏的表达量呈显著负相关(P<0.05).产蛋后16 h,大肠SLC4A4基因的表达量与小肠的表达量呈极显著负相关(P<0.01);十二指肠的表达量与肌胃的表达量呈显著负相关(P<0.05),与脾脏的表达量呈显著正相关(P<0.05).其他指标间无相关性(P<0.05).

表10 产蛋后5 h,各组织SLC4A4基因的表达量与子宫Ca2+浓度的相关系数1)Table 10 Correlation coefficient between the expression of SLC4A4 gene in various duck tissues and uterine Ca2+ concentration at 5 h after egg laying
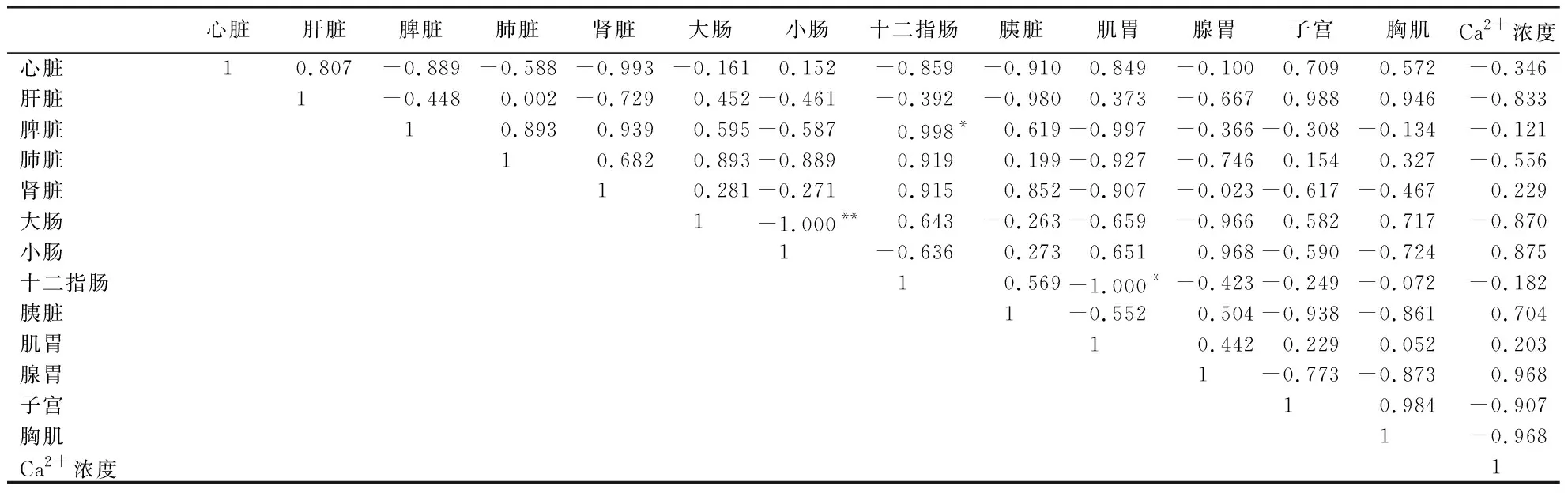
表11 产蛋后16 h,各组织SLC4A4基因的表达量与子宫Ca2+浓度的相关系数1)Table 11 Correlation coefficient between the expression of SLC4A4 gene in various duck tissues and uterine Ca2+ concentration at 16 h after egg laying
3 讨论
前人研究表明:在鸭产蛋中期,IP3R1基因在肾脏、小肠、子宫中均存在不同程度的表达[9];IP3R1基因在人类精子的顶体膜中存在表达,在受精过程中的表达量会减少[17];SLC4A4基因在大鼠的许多组织中具有非常广泛的表达,包括肾小管、十二指肠、小肠上皮细胞、子宫内膜、输卵管上皮组织等[18-20].上述前人研究结果与本研究结果“鸭产蛋循环中,IP3R1、SLC4A4基因在各组织均有不同程度的表达”相似.蛋壳钙主要来源肠道,肠道必须保持高效的运转才能满足连续高产的要求,一旦发生肠道Ca2+转运障碍,极易引起蛋鸡产蛋率的下降,诱发骨质疏松等疾病[21].本研究结果表明:16 h的IP3R1基因在肾脏、大肠的表达量极显著高于0~5 h,2 h的IP3R1基因在十二指肠的表达量极显著高于0、5、16 h,0 h的IP3R1基因在十二指肠的表达量极显著高于5、16 h,5 h的IP3R1基因在小肠的表达量显著低于0、2、16 h;16 h的SLC4A4基因在肾脏、大肠的表达量极显著高于0~5 h,0 h的SLC4A4基因在肾脏、大肠的表达量极显著高于2、5 h,2 h的SLC4A4基因在小肠的表达量显著高于0、5、16 h,0 h的SLC4A4基因在十二指肠的表达量极显著高于2~16 h.由于蛋壳钙化大多发生在夜晚,钙主要来源于肠道,大量的钙会被转运至子宫,而肠道的钙来源于白天时,产蛋后0~2 h,此时鸭正处于进食状态,肠道会增加对食物中Ca2+的吸收[12].家禽钙的吸收主要发生在小肠前段和十二指肠[22].由于0~2 h的IP3R1、SLC4A4基因在小肠、十二指肠的表达量极显著高于其他时期,且在蛋壳钙化过程中(产蛋后16 h),IP3R1、SLC4A4基因在大肠、肾脏的表达量达到极显著的最大值,故推测IP3R1、SLC4A4基因在蛋鸭肾脏、肠道Ca2+的吸收中起重要作用.本研究结果表明:产蛋后0 h,肝脏IP3R1基因的表达量与子宫Ca2+浓度呈显著正相关;产蛋后5 h,胸肌IP3R1基因的表达量与子宫Ca2+浓度呈显著负相关;产蛋后16 h,小肠IP3R1基因的表达量与子宫Ca2+浓度呈极显著负相关;产蛋后5 h,脾脏SLC4A4基因的表达量与子宫Ca2+浓度呈显著负相关,胰脏SLC4A4基因的表达量与子宫Ca2+浓度呈极显著负相关.上述结果与杨俊花[23]的研究结果“家禽肠道Ca2+的吸收主要发生在小肠前段(十二指肠、空肠),在蛋壳钙化开始前,大量的Ca2+被转运到子宫参与蛋壳钙化”相似.推测在蛋壳钙化时期大量的Ca2+被转运到子宫中参与蛋壳的形成,此时的小肠已完成Ca2+的转运,使IP3R1基因的表达量反而较低.本试验结果为今后研究IP3R1、SLC4A4基因在鸭蛋壳形成过程中影响Ca2+转运的调控机理提供了新的参考.
