枇杷MADS-box全基因组鉴定及其在果实成熟过程中的潜在作用
2022-06-06李小婷高欢欢郑嘉敏郑国华
刘 楠, 寇 燕, 李小婷, 陈 旭, 高欢欢, 张 晶, 王 超, 郑嘉敏, 郑国华
(1.福建农林大学园艺学院;2.福建农林大学园艺产品贮运保鲜研究所,福建 福州 350002)
MADS-box蛋白广泛存在于真核生物中,是一类重要的转录因子.MADS-box蛋白的共同特点是N端均含有一段由58~60个氨基酸组成的高度保守结构域——MADS结构域,该结构域负责与靶基因调控区域中CArG盒[CC(A/T) 6GG]序列结合.根据其进化谱系,MADS-box基因家族主要分为Ⅰ型和Ⅱ型.鉴于编码蛋白的MADS结构域,Ⅰ型MADS-box基因可分为Mα、Mβ和Mγ共3个亚类,而只有少数Ⅰ型基因具有生物学功能[1].在植物体中,被广泛研究的MADS-box基因主要属于Ⅱ型.与Ⅰ型相比,Ⅱ型基因多出3个结构域:Keratin-like(K)域(约30个氨基酸)、Intervening(Ⅰ)域(约70个氨基酸)和C-terminal(C)域,因此,Ⅱ型基因也被称作MIKC型基因.根据结构差异又可进一步分为MIKCC型和MIKC*型两个亚类.
MADS-box基因参与了植物从根到花、果实生长发育的调控.最初,MADS-box基因被鉴定扮演花器官识别基因的角色,它的缺失会导致花器官的同源异型转化.Coen et al[2]根据金鱼草和拟南芥花器官的同源异型突变,于1991年提出了ABC模式假说.随着研究的深入,发现此模式无法解释所有现象,最终将花发育ABC模型扩展为ABCDE模型.D类基因被证明与矮牵牛胚珠形成有关,E类基因在拟南芥中被证明协同其他基因调控花轮同步发育[3].除了提供花的同源异型功能外,MADS-box基因还参与了种子和果实的发育.1998年,Gu et al[4]发现拟南芥果实的果满基因(FRUITFULL,FUL)突变后无法长大,进而导致果实不正常发育;2002年,Vrebalov et al[5]发现在成熟抑制基因(RIPENINGINHIBITOR,RIN)突变的番茄上,即使有外源乙烯作用,果实也无法正常成熟.这是继乙烯之后,在果实成熟机理相关因子研究上的又一重大发现.一些与果实成熟相关的MADS-box基因在桃[6]、苹果[7]和草莓[8]等肉质果实中也相继展开了报道.由此,MADS-box基因也被认为是跃变型和非跃变型果实的共同成熟调控网络.
截至目前,MADS-box基因已经在拟南芥[9]、番茄[1]、水稻[10]、苹果[11]和梨[12]等物种中被鉴定出来,但关于枇杷(EriobotryajaponicaLindl.)MADS-box基因的鉴定研究尚未进行.枇杷是南方特色常绿果树,属蔷薇科枇杷属,在我国福建和四川等省份的果树产业中占有重要经济地位.果实成熟直接影响到果品的商品价值、采后寿命和市场竞争力;同时,成熟期的早晚直接影响供应期和市场售价.果实成熟过程涉及一系列生理生化变化,是大量基因表达和调控的结果,其中,转录因子扮演重要角色.MADS-box是研究最多的一类参与调控果实成熟和衰老的重要转录因子,尤其是属于SEP亚族的MADS-box转录因子.最近,枇杷基因组测序成功,为枇杷MADS-box基因的分析提供了机会.本研究利用生物信息学方法,从全基因组水平对已公布的枇杷基因组进行MADS-box基因鉴定,并对其系统进化关系、保守结构域、基因结构、基因复制和启动子顺式作用元件进行分析.此外,结合本课题组所测转录组数据和qRT-PCR结果,分析MADS-box基因在枇杷果实成熟过程中的表达模式,旨在为MADS-box基因的功能鉴定,特别是在果实成熟过程中作用的分析提供参考.
1 材料与方法
1.1 材料
供试样品选自福建枇杷栽培示范基地莆田市宏耕农业发展有限公司种植的枇杷,采集两个白肉枇杷品种‘三月白’和‘白梨’的果实作为试材.取样的枇杷树为9年生,且立地条件、生长势、管理水平均一致.第一次采果取样时间为谢花后第80天,然后每隔10 d取样一次,共取5次.每次取样是在每株树冠腰部的东西南北4个方向各取5个果,摘取大小一致、着色一致、无病虫害的健康果实共60个,采后装入冰盒保鲜并立即运回实验室.从每个时期采集的60个果实中随机取出20个,将这20个果实的腰部果肉切碎混匀并称量,用锡箔纸包装置冰箱(-80 ℃)保存,用于RNA提取.
1.2 RNA提取和逆转录
使用多糖多酚植物总RNA提取试剂盒(天根生物技术有限公司)提取枇杷总RNA.采用紫外分光光度计进行RNA浓度的检测,利用1%琼脂糖凝胶电泳进行RNA质量与完整性的检验.采用PrimeScript®RT reagent Kit With gDNA Eraser试剂盒(宝日医生物技术有限公司)合成第一链cDNA,用于后续的qRT-PCR检测.
1.3 枇杷MADS-box基因的鉴定
枇杷基因组数据下载于国家基因库(CNGB)核酸序列档案(https://db.cngb.org/cnsa),登记号为CNP0001531.拟南芥MADS-box蛋白序列下载于拟南芥信息资源网站(https://www.arabidopsis.org/index.jsp).从Pfam数据库中下载MADS-box基因的DNA结合和二聚化结构(SRF-TF, PF00319)的隐马尔可夫模型(HMM).利用HMMER 3.0软件对枇杷基因组数据库进行检索,以寻找可能的MADS-box基因.检索过程采用默认参数,E值为0.001.为进一步核实序列的可信度,将获得的所有候选序列上传至Pfam(http://pfam.xfam.org)和NCBI Conserved Domain Search (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行检验.利用ExPASY-Prot在线工具(https://web.expasy.org/protparam/)计算枇杷MADS-box蛋白的分子质量和等电点.通过Wolfpsort在线网站(https://wolfpsort.hgc.jp/)进行枇杷MADS-box蛋白的亚细胞定位.
1.4 序列比对和系统进化分析
利用枇杷和拟南芥的MADS-box蛋白序列分别构建两株(Ⅰ、Ⅱ型基因)系统发育树.在MEGA 6.06软件上,用ClustalW工具对获得的枇杷和拟南芥的MADS-box蛋白序列进行多重序列比对,比对采用默认参数.采用邻近法构建系统发育树,参数设置如下:自展法系数校正,设置1 000次重复检验;缺口或缺失数据采用成对删除.最后用iTOL在线网络工具(https://itol.embl.de/login.cgi)可视化及美化枇杷系统发育树.
1.5 枇杷MADS-box蛋白的保守基序和基因结构分析
利用在线网站MEME(https://meme-suite.org/meme/tools/meme)分析枇杷MADS-box蛋白的保守基序,参数设置如下:每种基序在每条序列中最多出现一次;基序数量最大值为10;每个基序的最佳宽度为6~50个残基.采用TBtools软件生成系统发育树、内含子/外显子结构和保守基序图.
1.6 染色体定位和共线性分析
根据枇杷基因组注释文件,获取MADS-box基因的染色体位置信息.从Ensembl Plants数据库(https://plants.ensembl.org/index.html)下载拟南芥、葡萄、水稻、菠萝的基因组数据和注释文件.利用TBtools软件中的MCScanX功能对枇杷MADS-box基因以及枇杷与拟南芥、葡萄、水稻、菠萝之间的基因片段进行了比对和分析.使用TBtools软件的Circos功能绘制共线性关系和染色体定位图.
1.7 枇杷MADS-box基因启动子顺式作用元件分析
利用TBtools软件,从枇杷基因组中提取MADS-box基因编码区(CDS)上游2 000 bp的序列,将获得的数据上传至顺式作用元件在线预测网站PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),利用Excel软件整理和简化结果,只保留响应类元件,最终在TBtools软件上可视化MADS-box基因启动子顺式作用元件.
1.8 MADS-box基因在枇杷成熟期间的表达模式
利用本课题组所测的枇杷果实转录组数据,分析枇杷MADS-box基因在果实不同成熟时期的表达.利用TBtools软件制作表达量热图.为了验证转录组数据的可行性,本研究对成熟期间差异表达的MADS-box基因做qRT-PCR验证.使用在线网站Real-time PCR (TaqMan)引物及探针设计工具(https://www.genscript.com/tools/real-time-pcr-taqman-primer-design-tool?act=register_success)设计引物.对所有引物进行溶解峰和解离曲线测试,确保每对引物只有一个产物.以枇杷Actin为参考基因,正向引物为:5′-GGATTTGCTGGTGATGATGC-3′,反向引物为:5′-CCGTGCTCAATGGGATACTT-3′[13-14].本研究采用完全随机设计,所有数值均为平均值±标准差.所有数据均采用SPSS22软件进行处理,采用Duncan检验数据的显著性差异,P<0.05为差异有统计学意义.以Actin为参照基因,利用2-△△CT方法计算每个MADS-box基因的相对表达量[15].最后,利用Excel软件将数据图表化.
2 结果与分析
2.1 枇杷MADS-box基因鉴定及理化性质
通过隐马尔可夫模型和本地Blast的方法,获得96个枇杷MADS-box候选基因.经Pfam和NCBI Conserved Domain Search数据库检测后,剔除7个结构域不完整的基因,最终获得89个枇杷MADS-box基因.根据亚族分类对89个枇杷MADS-box基因命名为EjMADS1~EjMADS89.结构域分析显示,51个MADS-box基因有MADS结构域和K-box结构域,其余基因只包含MADS结构域.MADS-box基因的基础特性包含编码蛋白的长度、等电点、分子质量、内含子数、结构域和亚细胞定位(附件表Ⅰ,扫OSID码可见).在这89个MADS-box基因中,编码蛋白的氨基酸个数为90~557个.EjMADS64蛋白只有90个氨基酸;EjMADS53蛋白长度最长,其氨基酸组成达到557个.枇杷MADS-box蛋白的等电点为5.38~10.16,其中有59个等电点大于8.5;分子质量为10.22~63.30 ku,平均分子质量为27.14 ku.Wolf Sport在线网站亚细胞定位显示,63%基因分布在细胞核中,EjMADS25和EjMADS34分布在高尔基体中,EjMADS9、EjMADS11、EjMADS28和EjMADS29分布在叶绿体中,其余基因分布在细胞质和线粒体中.
2.2 枇杷MADS-box基因构建的系统发育树
为了研究枇杷MADS-box基因与拟南芥MADS-box基因的系统进化关系,以及将枇杷MADS-box基因进一步划分为已成立的亚族,本研究分别构建MADS-box基因的Ⅰ、Ⅱ型系统发育树(图1、图2).系统发育树基于107个拟南芥和89个枇杷的MADS-box蛋白序列的多重序列比对建立起来.然而,有研究表明拟南芥基因组中缺失了一个古老的分支——TM8[16],因此,本研究从GeneBank中下载了番茄TM8序列(KF270624)和杨树TM8序列(XP_002321711.1)用于系统进化分析.使用MEGA6.06软件,采用邻近法构建系统发育树.根据与107个拟南芥MADS-box基因的关系,枇杷MADS-box基因可被划分为两大组:Ⅰ、Ⅱ型.在这89个枇杷MADS-box基因中,有58个(EjMADS1~EjMADS58)属于Ⅱ型基因,其余31个(EjMADS55~EjMADS89)为Ⅰ型基因.Ⅰ型枇杷MADS-box基因又可进一步划分为亚族Mα(23个)、Mβ(5个)和Mγ(7个).在Ⅱ型枇杷MADS-box基因中,只有4个基因(EjMADS51~EjMADS54)可被归入MIKC*亚族,其余50个属于MIKCC亚族.根据拟南芥MADS-box基因的分类[9],枇杷的MIKCC型基因可进一步划分为13个亚家族,主要集中在SEP、AP1/FUL和SVP亚族中.在FLC(EjMADS29)、AGL12(EjMADS27)和AGL15(EjMADS1)亚族中只分布有单个基因.

图1 枇杷和拟南芥Ⅰ型MADS-box基因的系统发育树Fig.1 Phylogenetic tree of type Ⅰ MADS-box genes in loquat and Arabidopsis

图2 枇杷和拟南芥Ⅱ型MADS-box基因的系统发育树Fig.2 Phylogenetic tree of type ⅡMADS-box genes in loquat and Arabidopsis
2.3 枇杷MADS-box蛋白的保守基序和基因结构
利用MEME在线网络工具对89个枇杷MADS-box蛋白的保守基序分布和关系进行分析,最终得到10个保守基序(基序1~10).各基因的基序详情如附件图Ⅰ、图Ⅱ所示(扫OSID码可见).总体来看,同属于一个亚家族的基因有着相似的保守基序.所有的枇杷MADS-box蛋白都含有基序1(除EjMADS6外),这是其中一个典型的MADS-box结构域,由31个氨基酸构成;基序3、4在大多数枇杷MADS-box蛋白中也是保守的.MADS结构域由58个氨基酸构成,MIKC型和Mα型的大部分MADS-box蛋白都有完整的MADS结构域,而Mβ和Mγ亚族中MADS-box蛋白的MADS结构域仅由基序1、3构成.基序2、6代表K结构域.基序2广泛存在于除了EjMADS3、EjMADS18、EjMADS39、EjMADS55和EjMADS57之外的Ⅱ型蛋白中.
枇杷MADS-box基因的内含子数量为0~13个.在拟南芥和黄瓜中关于MADS-box基因的研究表明,Ⅰ、Ⅱ型MADS-box基因的内含子分布情况是有差异的[9,17].MIKCc和MIKC*(Mδ)亚族的基因都包含多个内含子,Mα、Mβ和Mγ亚族基因通常不含或只含一个内含子.相似的情况同样出现在枇杷中:在58个MIKC型的基因中,有78%(45/58)基因的内含子数大于或等于5;在31个Mα、Mβ和Mγ亚族基因中,超8成以上的基因不含内含子.此外,枇杷MADS-box近缘基因的基因结构较为相似,差异仅表现在内含子和外显子的位置或长度上.但有一些近缘基因也会有不一样的内含子和外显子分布,如EjMADS51和EjMADS54的系统进化关系有着较高的自展法系数值,但EjMADS51有3个内含子,EjMADS54只有两个内含子.
2.4 枇杷MADS-box基因的染色体定位和共线性关系
根据基因注释文件,89个枇杷MADS-box基因中有3个基因(EjMADS42、EjMADS59、EjMADS60)在utg0_pilon上.通过TBtools软件分析显示,86个MADS-box基因可以定位到枇杷的17条染色体上,说明MADS-box基因在枇杷中可能有多种功能[1].MADS-box基因在枇杷染色体上呈不均匀分布,主要分布在第2、8、9、15号染色体上;第4号染色体上没有MADS-box基因分布;第15号染色体上分布最多,有11个MADS-box基因.Ⅱ型基因在第8、15号染色体上分布最多,分别有9和8个基因,在第3、4、11、12号染色体上没有分布;Ⅰ型基因主要分布在第5、9、12、17号染色体上,在第1、4、7、8、13、16号染色体上没有分布.
从图3可以看出,有一部分基因聚集在染色体的某个特定区域,形成基因簇,这可能与基因重复事件有关[18].基因重复和随后的分化是基因组进化和复杂性的主要机制.在拟南芥、金鱼草和矮牵牛中存在数量不等的MADS-box重复基因.为了确定枇杷MADS-box基因在进化过程中是否存在复制关系,利用TBtools软件的McscanX和Circos功能,根据每个基因在枇杷染色体上的位置做了共线性分析.结果显示,枇杷MADS-box基因中存在12对串联重复基因(EjMADS03/EjMADS50、EjMADS10/EjMADS53、EjMADS12/EjMADS35、EjMADS22/EjMADS48、EjMADS24/EjMADS44、EjMADS37/EjMADS36、EjMADS40/EjMADS43、EjMADS51/EjMADS54、EjMADS52/EjMADS39、EjMADS65/EjMADS66、EjMADS80/EjMADS82、EjMADS81/EjMADS80),发生在第9、8、13、16、15、2、10、12号染色体上,第2、13、15、16号染色体上都只有1对.与此同时,枇杷染色体片段复制产生的MADS-box基因有38对.结合系统发育树,发现这些重复基因通常会聚集在一起.

chr1~chr17分别表示第1~17号染色体;每条染色体内侧有不同颜色的标记和名称:橘色渐变区域为染色体基因密度,灰线表示重复的MADS-box基因对;图外侧基因标签:红色表示Ⅱ型基因,黑色表示Ⅰ型基因.图3 枇杷MADS-box基因的染色体定位及共线性关系Fig.3 Chromosome localization and collinearity of MADS-box gene family in loquat
为了进一步研究MADS-box基因中的重复基因,对枇杷和4个代表性物种(拟南芥、葡萄、水稻、玉米)进行了基因组间的共线性分析,结果如附件图Ⅲ所示(扫OSID码可见).枇杷分别有41、50、31个MADS-box基因与拟南芥、葡萄、水稻、玉米的MADS-box基因同源.同源对数的差异与枇杷和其他物种间的进化距离有关.枇杷与双子叶植物基因组之间的共线性比与单子叶植物基因组之间的共线性要大.而在双子叶植物中,枇杷与葡萄基因组之间的共线性又比与拟南芥基因组之间的共线性要大.值得一提的是,一些枇杷MADS-box基因存在多对共线性基因(一个枇杷基因与其他物种的多个基因相关),如EjMADS15与拟南芥At2G22630.2/ At4G37940.1/ At5G51860.1/ At5G62165.2相关,EjMADS38与葡萄VIT_01s0011g00100.t01/ VIT_17s0000g04990.t01/ VIT_15s0048g01270.t01/ VIT_16s0022g02330.t01相关.这意味着这些基因可能在进化过程中起关键作用.此外,一些共线性基因对存在于枇杷与拟南芥、葡萄之间,而不存在于枇杷与水稻、玉米之间,如EjMADS03与At2G42830.2/ At3G58780.4/ VIT_12s0142g00360.t01相关,EjMADS04与At2G45660.1/VIT_15s0048g01250.t01/VIT_16s0022g02380.t01相关,而在水稻和玉米中没有同源基因.表明这些同源基因对可能是双子叶植物和单子叶植物分化后产生的[19].还有一些共线性基因对存在于枇杷与其他4个物种之间,说明这些同源基因在它们的祖先分化之前就已经存在.
2.5 枇杷MADS-box基因的启动子顺式作用元件
顺式作用元件是基因表达所必需的一段碱基序列.从PlantCARE预测的结果(附件图Ⅳ,扫OSID码可见)来看,89个枇杷MADS-box基因启动子区域共涉及24种响应元件.其中,分布最多的是光响应元件,有1 081个,余下是茉莉酸甲酯响应元件(274个)、厌氧诱导响应元件(225个)、脱落酸诱导响应元件(213个)、赤霉素响应元件(88个)、生长素诱导响应元件(64个)、水杨酸诱导响应元件(64个)、干旱诱导响应元件(78个)等.枇杷MADS-box基因启动子中有多个激素类响应元件,有促进果实成熟的,如生长素、赤霉素、水杨酸响应元件,还有与果实转色有关的响应元件,如脱落酸、茉莉酸甲酯响应元件.卢文静[20]研究表明,草莓中的两个SEP-like基因(FaMADS1、FaMADS2)调控花青素、香气物质的合成以及果实软化,而这两个基因受到脱落酸和生长素响应元件的作用.在89个枇杷MADS-box基因中,有77.5%的基因至少存在1个脱落酸响应元件(ABRE),(C/G/T)ACGTG(G/T)(A/C)是ABRE的核心序列.生长素响应元件包括TGA-element(AACGAC)、AuxRR-core(GGTCCAT)、TGA-box(TGACGTAA)、AuxRE(TGTCTCAATAAG),约56%的基因含有生长素响应元件.枇杷MADS-box基因启动子还有多种非生物胁迫响应元件,如厌氧诱导(225个)、参与干旱诱导的MYB结合位点(78个)、低温(48个)、防御和胁迫(47个)、机械损伤(4个)等响应元件.辣椒中的MADS-box基因与植株抗胁迫能力密切相关,ABA和MeJA处理能显著诱导该基因的转录,进而提高植株耐受性[21].此外,也存在一些与植物发育、代谢相关的响应元件,如MYBHv1结合位点(55个)、分生组织(50个)、玉米醇溶蛋白调控(43个)、细胞周期(19个)、昼夜节律(13个)、种子特异性(9个)、栅栏叶肉细胞分化(8个)、光敏色素下调表达(1个).37个枇杷MADS-box基因分布有MYBHv1(CCAAT-box)结合位点,NF-Y基因通过与CCAAT-box特异性结合而进行转录,NF-Y基因参与植物生长发育调控与逆境胁迫响应[22].顺式作用元件分析表明,枇杷MADS-box基因参与果实发育、成熟以及胁迫反应.
2.6 枇杷MADS-box基因在果实成熟期间的表达
根据枇杷转录组MADS-box基因的标准化Log2(RPKM+1)构建的热图(附件图Ⅴ,扫OSID码可见)显示,共有28个MADS-box基因在果实中表达,其中有8个基因(EjMADS23、EjMADS26、EjMADS41、EjMADS43、EjMADS50、EjMADS05、EjMADS22、EjMADS37)在果实成熟期的表达量较高且存在差异.这8个基因的qRT-PCR结果与转录组数据一致,说明该转录组数据可用于研究MADS-box基因在枇杷中的表达谱.
系统发育树(图1)显示,上述8个基因都属于Ⅱ型基因,共分5个亚类.其中,EjMADS23、EjMADS26、EjMADS41、EjMADS43都属于SEP亚族,它们在不同品种中有着不同的表达模式.图4显示,在‘白梨’中,这4个SEP亚族同源基因在成熟期间的表达量呈下调模式.在‘三月白’中,EjMADS26、EjMADS43的表达量也是随着果实成熟而逐渐下调,但变化幅度比‘白梨’要大,且表达量显著高于‘白梨’;EjMADS41的表达量总体呈下调趋势,但在谢花后100 d有所上调;EjMADS23的表达量呈“W形”变化,在谢花后80、100、120 d的表达量较高.两个品种枇杷EjMADS22(AP1亚族)的表达模式与4个SEP亚族基因相似,表达量随着果实成熟而逐渐下调.‘三月白’的EjMADS50(AG亚族)在谢花后80、110 d有着较高的表达量,而‘白梨’EjMADS50的表达量随着果实成熟而逐渐下调.在Tian et al[11]的研究中,苹果AG、AP1的同源基因MdMADS14、MdMADS15、MdMADS21、MdMADS2、MdMADS5的表达量也表现出下调模式.拟南芥果实的发育和分化会受到AP1/FUL、AG亚族基因的调控[23-24].在‘三月白’中,EjMADS37(SVP亚族)的表达量在谢花后90 d显著下调,在谢花后100 d显著上调,随后逐渐下调;‘白梨’EjMADS37的表达量随着果实成熟而逐渐下调,在谢花后100~120 d的表达量显著低于‘三月白’.‘三月白’EjMADS05(AGL15亚族)的表达量表现为先上调后下调的趋势,在谢花后100 d达到峰值,随后逐渐下调;‘白梨’EjMADS05的表达量在谢花后80~100 d逐渐上调,在谢花后110 d显著下调,至最后一个成熟阶段又显著上调并达到峰值;EjMADS05在两个枇杷品种的前两个时期的表达量都比较低,而后期表达量上调,尤其是在‘三月白’中.
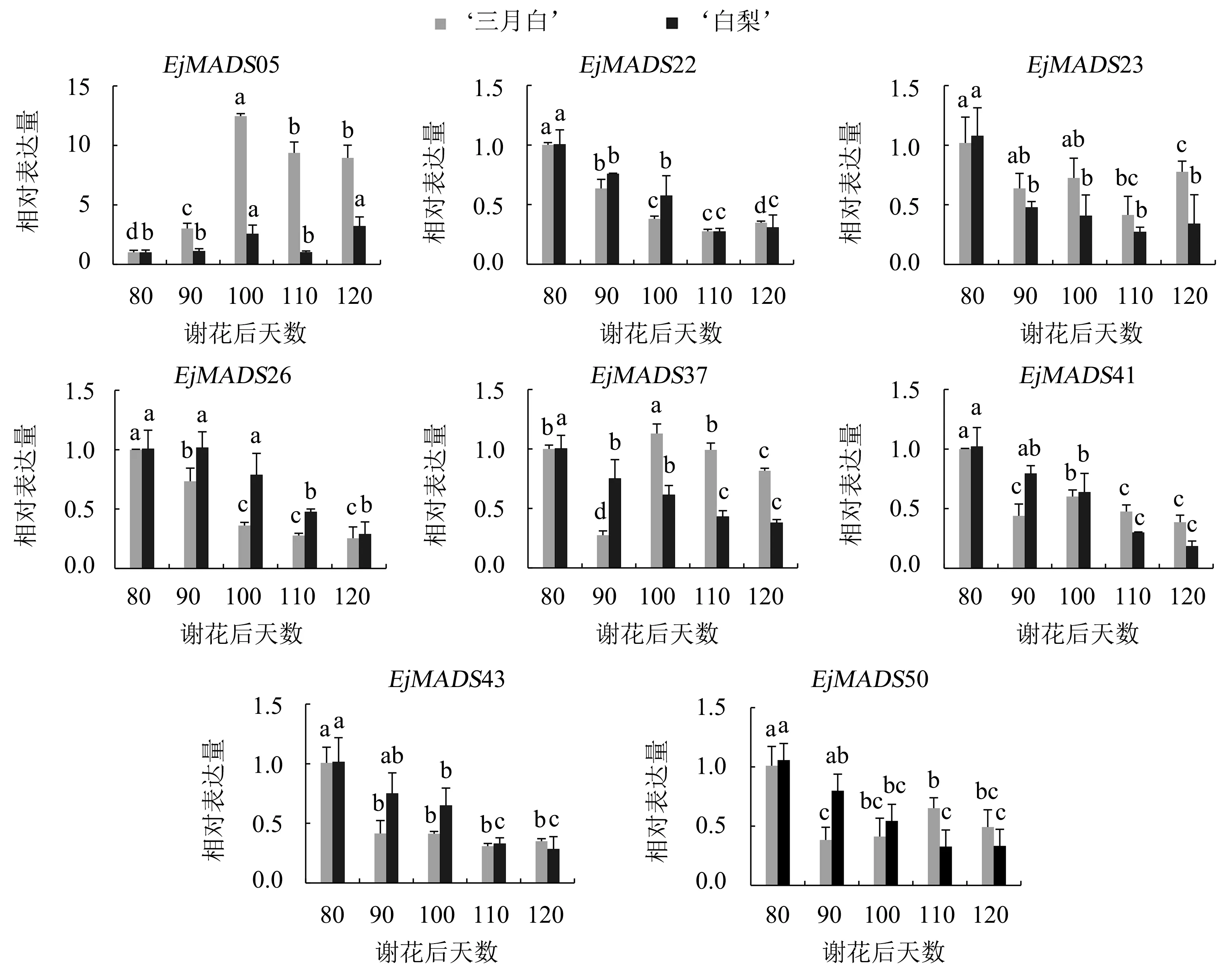
不同字母表示同一品种5个不同成熟阶段经邓肯式多重比较检测有显著差异(P<0.05).图4 8个MADS-box基因在‘三月白’和‘白梨’果实成熟期间的相对表达量Fig.4 Relative expression patterns of 8 MADS-box genes at 5 stages of maturity in loquat lines of ‘Sanyuebai’ and ‘Baili’
3 讨论
MADS-box基因广泛存在于植物体内,并在植物生长发育和果实成熟的过程中充当重要角色.近些年来,随着测序技术和生物信息学的发展,在许多物种上都对MADS-box基因进行了预测和研究.MADS-box基因在拟南芥中被鉴定出107个[9],在水稻中被鉴定出99个[10],在番茄中被鉴定出131个[1],在苹果中被鉴定出146个[11],在梨中被鉴定出98个[25].本研究从枇杷基因组中鉴定出89个MADS-box基因,其中,Ⅰ型基因有31个,Ⅱ型基因有58个.相比其他物种,枇杷的MADS-box基因相对少一些,一方面可能与所测基因组序列完整度有关,另一方面可能反映了物种进化过程的特定复制和缺失.基因重复是新基因产生且帮助生物体适应不同环境的主要进化机制,主要有串联重复、片段重复和全基因组重复.本研究结果显示,枇杷Ⅱ型MADS-box基因比Ⅰ型基因有着更多的串联重复和片段重复,这可能是Ⅱ型基因多于Ⅰ型基因的原因.
基于拟南芥基因组的系统进化关系,枇杷Ⅱ型MADS-box基因可以被划分为14个亚族,主要是MIKCc型基因,MIKC*型基因只有少部分,这与在其他物种中的分布特点相同:MIKCc型基因和MIKC*型基因在拟南芥的数量分别是39和7个[9],在水稻中的数量分别是37和5个[10];在甜橙中的数量分别是28和8个[26].这表明MIKCC型基因在物种中是比较保守的.
在本课题组测定的转录组数据库中,共有28个MADS-box基因在果实中表达,其中有8个基因在果实成熟期的表达量较高且存在差异(RPKM>15).在这8个基因中,有4个基因属于SEPALLATA(SEP)亚族.MADS-box中的SEP亚族基因最先被证明在花器官鉴定和花器官形态发育中起关键作用[27].随后发现不管是在跃变型还是在非跃变型果实中,SEP亚族基因对果实成熟都有调控作用.如:草莓SEP1/2-like(FaMADS9)基因的沉默会抑制花瓣、瘦果及花托组织的正常发育和成熟[8];甜樱桃SEP1/2-like(PaMADS7)基因被证实可以与细胞壁代谢相关基因PG1启动子相互作用,从而影响果实软化[28];抑制苹果SEP1/2-like(MADS8、MADS9)会导致花瓣萼片状以及果肉大大减少[29].在枇杷品种‘白梨’中,这4个SEP亚族同源基因在果实成熟期间的表达量呈下调模式,这与Gaffe et al[30]的研究结果相同,即属于SEP亚族的番茄MADS1基因SlMADS1,其转录本会在果实中积累,积累量随着果实的成熟而逐渐减少.Dong et al[31]研究表明,SlMADS1基因沉默的番茄在果实成熟过程中产生的乙烯量大概是野生型的2~4倍.值得注意的是,Terol et al[32]在克莱门柚(Citrusclementina)中发现一个可能参与果实调控的MADS-box基因,该基因在早熟、中熟和晚熟的不同柑橘属品种中有着显著的差异表达——在早熟品种中的表达量会低于晚熟品种.在枇杷品种‘三月白’中,4个枇杷SEP亚族基因与甜樱桃SEP同源基因PbMADS2、PbMADS4、PbMADS7的序列相似[28].通过本地蛋白序列Blast比对,EjMADS41与甜樱桃PbMADS7高度同源(E值为e-113),EjMADS43与草莓SEP1/2-like(FaMADS9)基因的相似度达到79%(E值为e-102),EjMADS26与番茄SlMADS1基因的相似度达到63%(E值为e-80).顺式元件分析显示:EjMADS26、EjMADS43都含有生长素、赤霉素、脱落酸和水杨酸响应元件;EjMADS41含有赤霉素和脱落酸响应元件,且脱落酸响应元件居多.在今后的研究中,可以研究这3个SEP亚族基因是否对枇杷果实软化或色素合成有调控作用,进而证明参与了果实成熟调控.值得注意的是,EjMADS37(SVP亚族)和EjMADS05(AGL15亚族)在不同品种间的表达差异明显:EjMADS37在‘白梨’中的表达量随着果实成熟而逐渐下调,但在‘三月白’中的表达量却逐渐上调.‘三月白’是枇杷的特早熟白肉品种,‘白梨’是枇杷的中晚熟白肉品种,其成熟时间与MADS-box基因的关系,在后续研究中值得进一步展开.
4 结论
本研究共鉴定出89个枇杷MADS-box基因,其中,Ⅰ型基因有31个,Ⅱ型基因有58个.Ⅱ型MADS-box基因可以进一步划分为14个亚族.鉴定出的枇杷MADS-box基因分布在第1~17号染色体上.通过分析MADS-box基因在‘三月白’、‘白梨’两个品种5个成熟阶段的基因结构和表达情况,推测EjMADS26、EjMADS43、EjMADS41、EjMADS37、EjMADS05这5个基因参与了果实成熟调控.本研究提供了枇杷MADS-box基因的全面信息,可能有助于进一步了解MADS-box基因在多年生果树果实成熟调控方面的作用机理.
