沙门菌sRNA GcvB及伴侣蛋白Hfq对靶基因stm4351的调控作用
2022-06-06张家莉段世宇令狐远凤
张家莉, 杨 阳, 潘 永, 段世宇, 令狐远凤, 杨 琦,3
(1.贵州大学动物科学学院;2.贵州大学动物疫病研究所;3.贵州省动物疫病研究室,贵州 贵阳 550025)
沙门菌(Salmonella)是一种广泛存在于自然界的革兰氏阴性菌,具有极强的感染性和致病力,能够引起人和动物伤寒、腹泻甚至全身性感染等疾病[1].当前,其被公认为是世界上最重要的人畜共患病原菌之一.2017年全球出现1 430万例人类感染沙门菌的病例,其中13.59万人死亡[2].
ABC转运系统(ATP-binding cassette transporter)是细菌生命活动中至关重要的一环,主要影响细菌对氨基酸的吸收,其通常具有至少一种周质溶质结合蛋白,蛋白经外膜孔扩散,通过结合、水解ATP而获得能量并将多种底物分子如氨基酸类、多肽类、无机离子、金属离子、糖类转出(入)细胞,从而对细菌的生存、致病性等产生重要影响[3-5].沙门菌中,stm4351长741 bp,编码精氨酸ABC转运蛋白底物结合蛋白,其受长为200 nt的反式编码调控 sRNA GcvB调控[6-7].以stm4351的mRNA起始密码子为原点,GcvB可能与其-30~-22的区域(CACAACAUC)进行配对结合[8].该sRNA来自于靶基因不相邻基因区间,与靶基因具有较低的互补性.因此,其具有较强的调节能力,能调控沙门菌中约1%的mRNA,对氨基酸转运和代谢的多个靶标的表达具有负调节作用[9-10].反式编码调控sRNA大多需要伴侣蛋白Hfq共同作用,而GcvB是革兰氏阴性细菌中与Hfq相关性最高的sRNA之一.
有关GcvB与伴侣蛋白Hfq对靶基因stm4351的具体调控方式还未明确.本试验成功构建了stm4351的启动子与lacZ基因的融合基因,lacZ能与stm4351共用起始密码子(ATG)进行翻译并表达出β-半乳糖苷酶(LacZ),此时lacZ的表达量可视为stm4351的表达量.通过P22噬菌体转导试验将GcvB及Hfq单缺失和双缺失菌株转入Δstm4351∷lacZ中,以Δstm4351∷lacZ作为对照,利用LacZ活性和stm4351相对转录量差异评价GcvB、Hfq对stm4351的调控作用,为探究sRNA对沙门菌的调控机理及制定沙门菌的防控措施奠定基础.
1 材料与方法
1.1 材料
鼠伤寒沙门菌(S.typhimurium)标准株LT2、7455菌株(含有质粒pKD46,pKD46是λ red同源重组质粒,携带氨苄抗性)、鼠伤寒沙门菌hfq基因缺失株(基因型Δhfq∷tetRA)、鼠伤寒沙门菌gcvB基因缺失株(基因型ΔgcvB∷cat)[11]、鼠伤寒沙门菌hfq和gcvB基因双缺失菌株(基因型Δhfq∷tetRAΔgcvB∷cat)为本实验室构建.
P22噬菌体、质粒pCP21(含有FLP重组酶,能识别FRT位点)、pCE40(携带FRT位点与lacZ基因,但无lacZ启动子)、pKD13(携带FRT位点,具卡那霉素抗性)均由法国国家科学研究中心分子遗传学Bossi实验室惠赠.PCR产物纯化试剂盒和RNA提取试剂TRIzol均购自生工生物工程(上海)股份有限公司;试剂均为分析纯.
根据NCBI提供的基因序列设计引物(表1),引物送至上海生物工程有限公司合成.

表1 试验所用引物1)Table 1 Primers used in the experiment
1.2 构建单缺失菌株Δstm4351∷lacZ
参照文献[12],以质粒pKD13作为模板,利用引物P1、P2进行PCR扩增.扩增体系:10 μL pKD13,8 μL buffer,57 μL ddH2O,上、下游引物各1 μL,2 μL dNTPs Mix(2.5 mmol·L-1),1 μL Taq 酶和Pfu 酶(3∶1).扩增程序:95 ℃变性10 s、53~60 ℃退火30 s、72 ℃延伸90 s,30个循环.将PCR产物纯化后保存于-80 ℃.
将7455菌株培养至D600 nm=0.5~0.7,7 500 r·min-1离心6.5 min,用甘油洗净.将洗净的菌液与目的片段混匀,倒入电转杯中进行电转化(t=5.9 s、U=2.5 V),电穿孔后迅速用1 mL复苏液复苏,37 ℃孵育1 h,抽取100 μL菌液涂布于相应抗性平板上,37 ℃过夜培养,次日在同抗性平板上挑取菌落进行纯化培养.通过电转化将质粒pCP21、pCE40依次转入纯化菌种中,然后在卡那霉素抗性平板与麦康凯培养基上进行筛选.通过PCR产物凝胶电泳与测序验证lacZ与stm4351是否替换成功.
1.3 构建双缺失和三缺失菌株
参照文献[13]制备裂解液:将供体菌过夜培养,取0.3 mL菌液加入2.3 mL P22肉汤中,培养8 h后转到2 mL离心管中,10 000 r·min-1离心2 min,取上清液用CHCL3灭菌,获得裂解液.
转导:将受体菌过夜培养,取100 μL菌液与50 μL裂解液(1∶50)混匀,在37 ℃摇床中孵育1 h后涂布于相应抗性选择培养基中过夜培养.
分别将基因缺失株Δhfq∷tetRA、ΔgcvB∷cat和Δhfq∷tetRAΔgcvB∷cat作为供体菌,stm4351缺失株作为受体菌进行转导.通过抗性平板进行筛选,获取双缺失菌株、三缺失菌株:stm4351ΔgcvB∷cat、stm4351Δhfq∷tetRA、stm4351Δhfq∷tetRAΔgcvB∷cat.
1.4 LacZ活性测定
参照文献[14],将Δstm4351∷lacZ、stm4351ΔgcvB∷cat、stm4351Δhfq∷tetRA、stm4351Δhfq∷tetRAΔgcvB∷cat培养至D600 nm=0.3~0.5,记录D600 nm值.取0.1 mL菌液,用Z buffer定容至1 mL,加入0.2 mL ONPG (4 mg·mL-1)开始反应,记录加入时间(t0);当液体变为黄色时加入0.5 mL 1 mol·L-1Na2CO3终止反应,记录终止时间(tf);将试管中液体以5 000 r·min-1离心30 s后,以Z buffer作空白对照,测D420 nm值,记录数据.计算LacZ活性.
1.5 stm4351转录量测定
参照文献[15],根据DNA提取试剂盒说明书,利用引物P9、P10进行PCR扩增.扩增体系为上游引物1 μL、下游引物1 μL、2×Taq DNA master mix 12.5 μL、ddH2O 6.5 μL、DNA模板4 μL.扩增条件:95 ℃预变性30 min;95 ℃变性5 s、 60 ℃退火30 s,35个循环.
提取各菌株的总RNA样本,将其反转录为cDNA,以此作为模板,参考SYBR®Premix Ex TaqTMⅡ (Tli RNaseH Plus)试剂盒说明书,进行两步法反应.扩增条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,39个循环.每个样本3个重复,采用2-ΔΔCt法[16]计算相关基因mRNA的转录水平.
2 结果与分析
2.1 Δstm4351∷lacZ的构建结果
对构建的菌株进行PCR验证,获得目的条带并测序(图1,图2).与原片段进行对比发现,stm4351成功被lacZ基因替换,获得菌株Δstm4351∷lacZ.
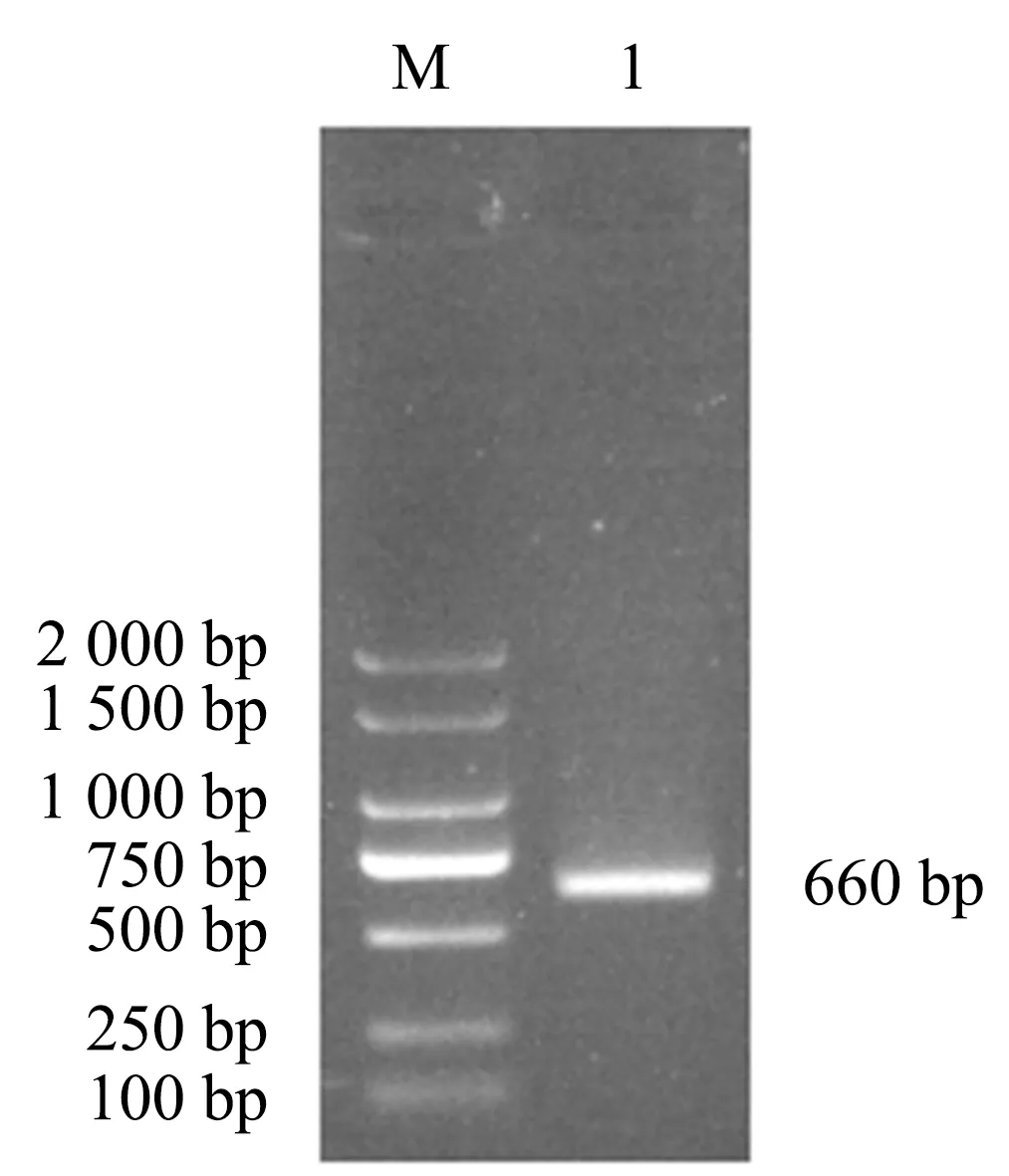
M.DL2 000 marker;1.stm4351验证.图1 stm4351基因与lacZ融合的PCR检测Fig.1 PCR detection on lacZ fusion of stm4351 gene
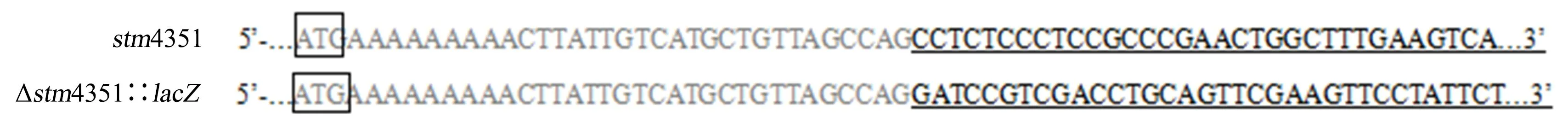
灰色为LT2菌株与stm4351缺失菌株上游同源序列;黑色框中为起始密码子;划线部分为替换基因序列.图2 lacZ基因替换stm4351基因的部分序列Fig.2 Partial sequence of stm4351 gene replaced by lacZ gene
2.2 双缺失、三缺失菌株的构建结果
通过转导,对各菌株进行PCR鉴定,再进行PCR凝胶电泳(图3),成功构建出缺失菌株.
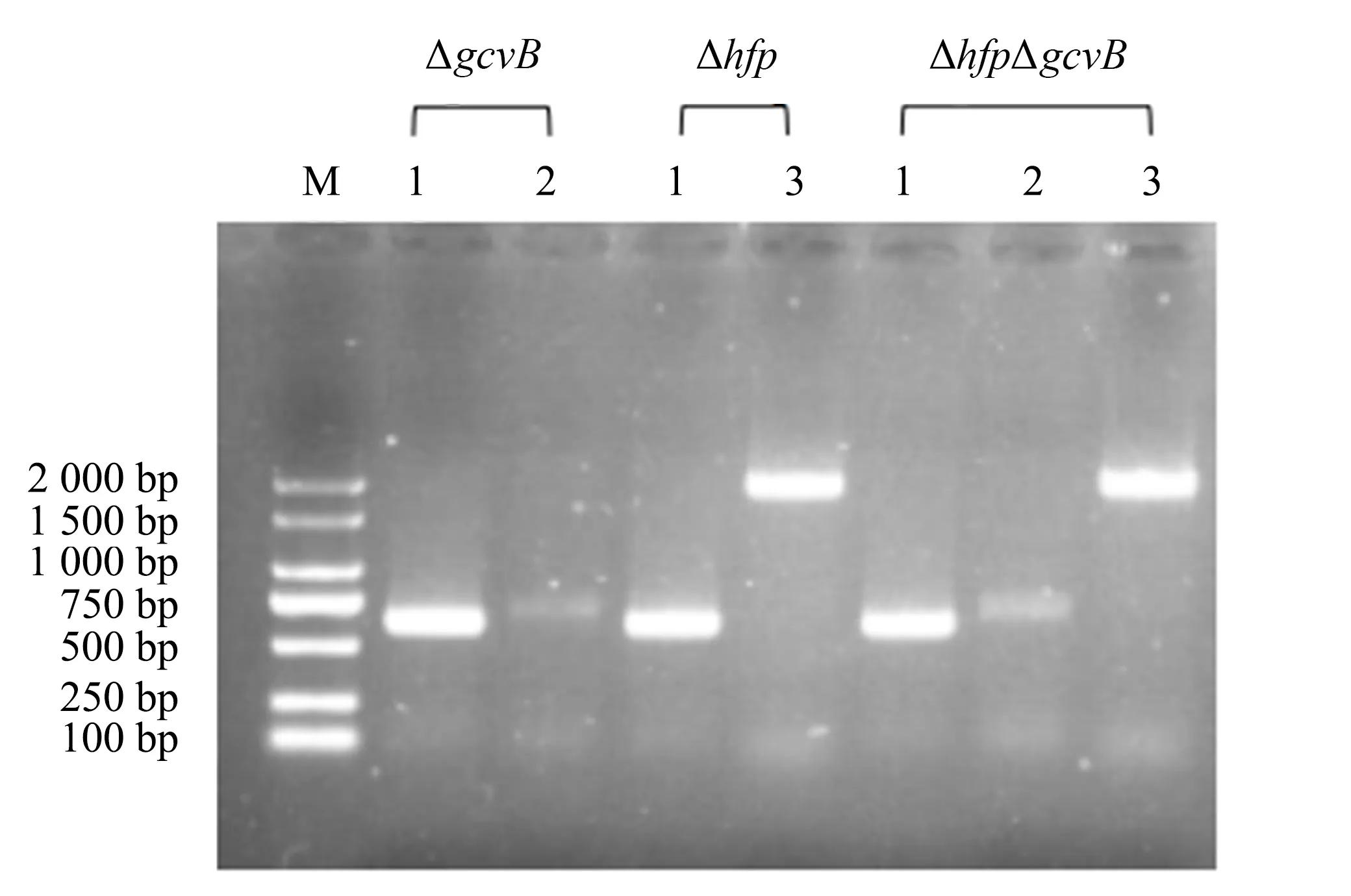
M.DL2 000 marker;1.stm4351验证(660 bp);2.gcvB验证(696 bp);3.hfq验证(1 964 bp).图3 stm4351 ΔgcvB∷cat、stm4351Δhfq∷tetRA、stm4351Δhfq∷tetRAΔgcvB∷cat菌株的PCR检测Fig.3 PCR detection on stm4351 ΔgcvB∷cat, stm4351Δhfq∷tetRA, stm4351Δhfq∷tetRAΔgcvB∷cat
2.3 基因缺失对LacZ活性的影响
将Δstm4351∷lacZ、stm4351ΔgcvB∷cat、stm4351Δhfq∷tetRA、stm4351Δhfq∷tetRAΔgcvB∷cat菌株分别在麦康凯培养基上划线培养,长出的菌落均为红色(图4).这表示lacZ基因已经成功将stm4351替换,且各菌株均具备发酵乳糖产酸的能力.
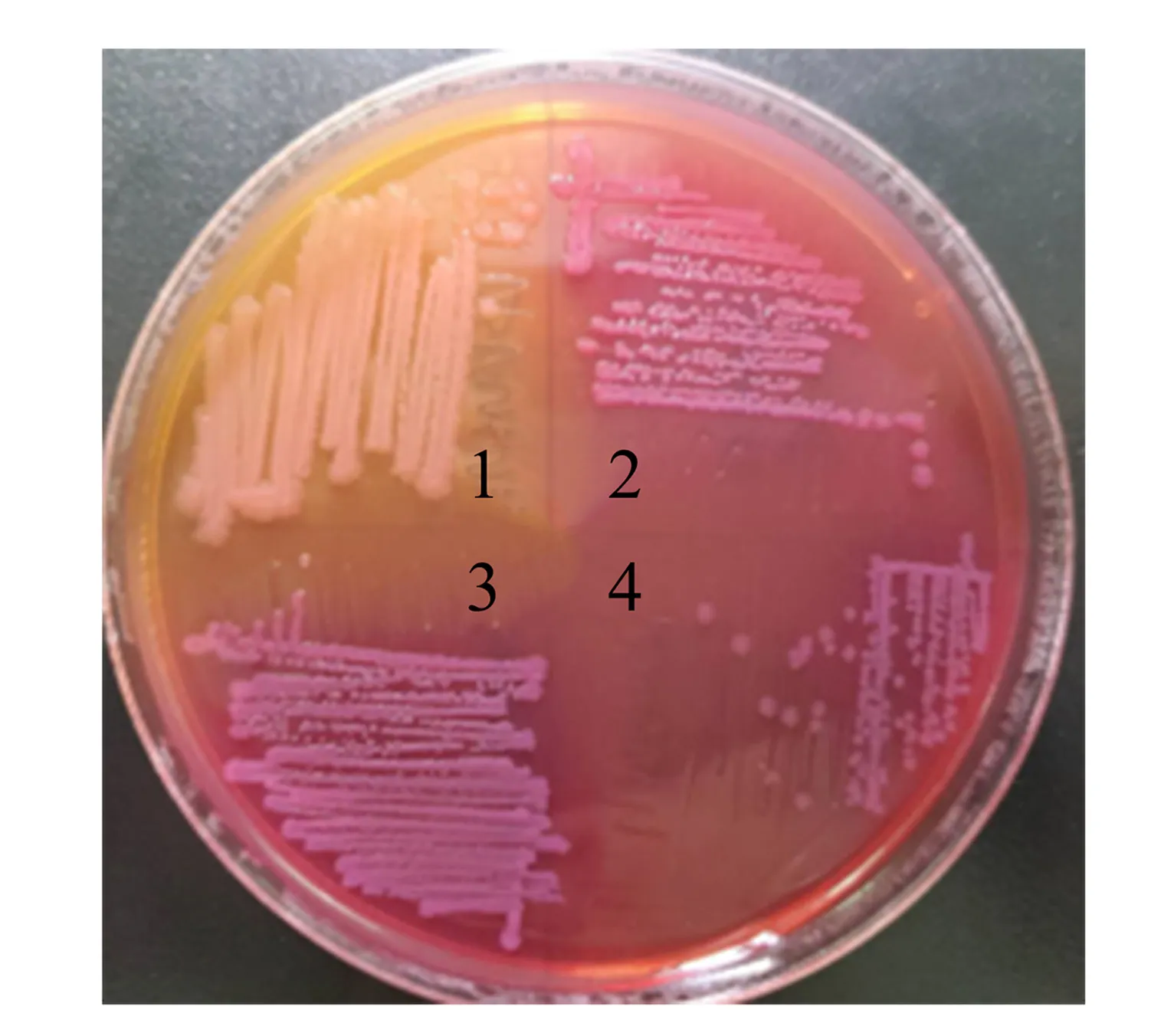
1.Δstm4351∷lacZ; 2.stm4351ΔgcvB∷cat; 3.stm4351Δhfq∷tetRA; 4.stm4351Δhfq∷tetRAΔgcvB∷cat.图4 基因缺失菌株在麦康凯培养基上的生长情况Fig.4 Growth of gene deletion strains in Maconkey medium
由图5可以看出,与对照组WT(Δstm4351∷lacZ)相比,gcvB或hfq缺失以及gcvB与hfq同时缺失后,LacZ活性均有所上升,分别上升2.6、3.4、4.2倍.由此说明,gcvB缺失后stm4351蛋白表达量变化显著(P<0.05),hfq单缺失及hfq与gcvB同时缺失后stm4351蛋白表达量变化极显著(P<0.01)
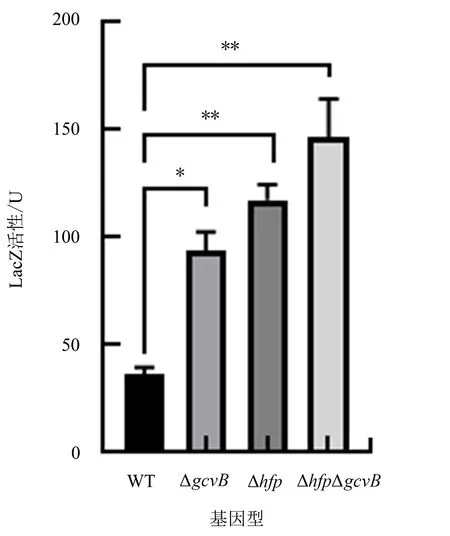
*表示差异显著(P<0.05);**表示差异极显著(P<0.01).图5 不同基因缺失菌株的β-半乳糖苷酶活性Fig.5 β-galactosidase activity in different gene deletion strains
2.4 基因缺失对stm4351转录水平的影响
由图6可以看出,与对照组LT2相比,hfq缺失后stm4351的转录量极显著下降(P<0.01),而gcvB缺失及hfq与gcvB同时缺失后stm4351的转录量变化不显著(P>0.05).
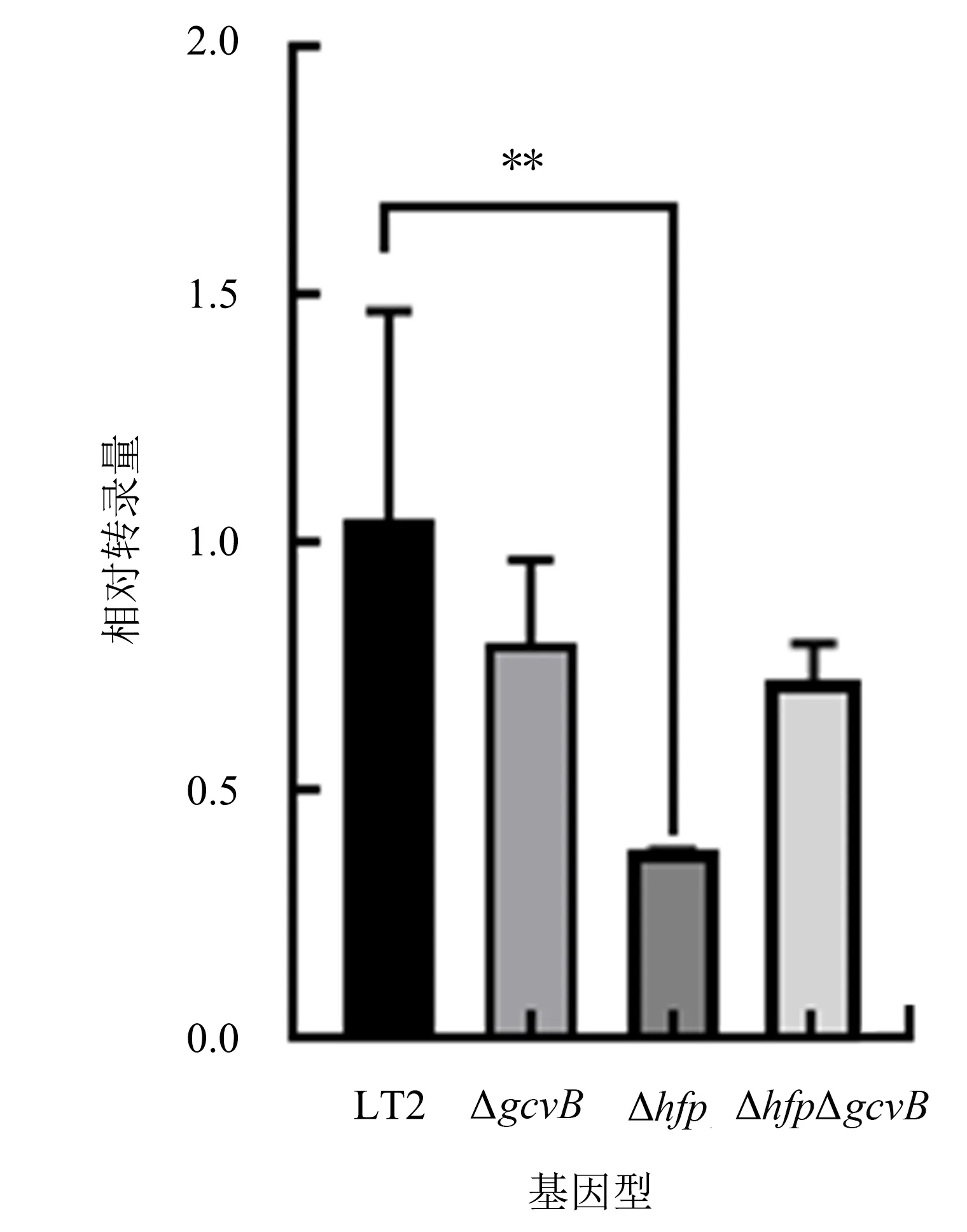
图6 不同基因缺失菌株的stm4351相对转录量Fig.6 Relative transcription levels of stm4351 in different gene deletion strains
3 讨论
细菌中存在一类sRNA,长度为40~400 nt,能进行转录但不进行翻译,对细菌中重要基因的表达有抑制或激活作用,进而维持细菌的稳定及调节细菌重要的生命活动和致病性[17].有研究认为,sRNA结合在核糖体结合位点的附近,占据核糖体与mRNA的结合位点,以抑制翻译起始从而刺激mRNA的降解[18].根据编码调控方式,sRNA分为两类:一类为基于碱基对完全互补配对的顺式编码调控sRNA;另一类为通过不完美的碱基配对发挥调控功能的反式编码调控sRNA.反式编码调控sRNA在发挥其调控作用时常存在一种伴侣蛋白Hfq[19].Hfq是一种保守的细菌RNA结合蛋白,是RNA结合蛋白的Sm样家族的成员之一,充当调节性RNA伴侣,能促进sRNA与其mRNA靶标之间的碱基配对,并直接调节某些mRNA的翻译,进而影响特定转录物的翻译和更新.GcvB是革兰氏阴性菌(如大肠杆菌、沙门菌)中反式编码调控sRNA中的一种,与伴侣蛋白Hfq协同作用,对靶基因产生调控作用.
Sharma et al[8]通过RNA混合算法(hybrid algorithm)对鼠伤寒沙门菌进行预测,认为stm4351为GcvB的靶基因.Montaseri et al[20]使用gRNA进行预测,得到了同样的结论.本研究结果显示:在蛋白水平上,gcvB或hfq缺失后,LacZ活性均有所上升;gcvB与hfq同时缺失后,stm4351基因的表达水平比单缺失菌株高.因此,可推测GcvB、Hfq均对stm4351的表达存在抑制作用,且在Hfq的辅助作用下,GcvB对stm4351表达的抑制作用增强.在mRNA水平上,当hfq缺失后,stm4351转录量显著下降,说明在mRNA水平上,GcvB仅与stm4351结合,并未表现明显的调控作用.sRNA作为转录后调控因子,与靶标mRNA 5′UTR区域进行碱基配对,从而占据核糖体与mRNA的结合位点,抑制mRNA的翻译,使得mRNA失去核糖体保护而被降解[21].由此推测,GcvB极有可能通过碱基配对与Hfq结合,再与stm4351形成GcvB-Hfq-stm4351的复合体,以此竞争核糖体与mRNA的结合位点,使得核糖体不能结合到链上,从而抑制stm4351的转录.gcvB缺失后,stm4351转录量并未产生显著变化,说明Hfq还可能与其他sRNA结合进行相应的调节作用,也可能通过其他途径或方式进行调节.gcvB与hfq同时缺失也未使stm4351转录量发生显著变化,推测另一种调控stm4351基因转录或翻译的机制被激活,且这种机制可能受GcvB或Hfq的负调控,该机制值得进一步探究.
4 结论
本试验成功构建了沙门菌基因缺失菌株Δstm4351∷lacZ、stm4351ΔgcvB∷cat、stm4351Δhfq∷tetRA、stm4351 Δhfq∷tetRAΔgcvB∷cat.沙门菌中GcvB、Hfq均能够对stm4351的翻译产生抑制作用;GcvB在伴侣蛋白Hfq的辅助作用下对stm4351的抑制作用增强;Hfq可能通过2种或更多的途径对stm4351进行调控;Hfq对stm4351的保护或激活作用可能受到GcvB的影响.
