沙门菌伴侣蛋白Hfq及RybB对外膜蛋白相关基因fadL、ompN、ybfM的作用
2022-06-06令狐远凤段世宇张家莉张宝太
令狐远凤, 杨 阳, 潘 永, 段世宇, 张家莉, 张宝太, 杨 琦
(1.贵州大学动物科学学院;2.贵州大学动物疫病研究所,贵州 贵阳 550025)
沙门氏菌(Salmonella)为肠杆菌科沙门氏菌属成员,可引起人与动物多种疾病,在全世界均有发生,造成严重的经济损失.RybB是长度约为81 nt并依赖伴侣蛋白Hfq的sRNA,在大肠杆菌与沙门氏菌中,RybB是已知调节外膜蛋白(outer membrane proteins, OMPs)合成的sRNA中具有最广泛的靶标mRNA[1].沙门氏菌RybB控制着17种以上的mRNA[2],RybB与细胞外应激因子σE相关,当OMPs由于外部因素(如热休克、接触乙醇、抗菌肽、高分子)和细胞生长进行稳定期时,会出现蛋白折叠错误或损伤等状况,并诱导与σE相关的细胞外应激反应[3],从而使RybB立即限制OMPs合成.OMPs参与细菌物质的代谢、运输、维持细菌正常形态等生命活动.在部分革兰氏阴性菌中,OMPs已被公认为是宿主免疫识别的重要因子,与细菌的致病性息息相关.fadL、ompN、ybfM在沙门氏菌中均参与OMPs的合成,fadL可在革兰氏阴性菌中编码外膜通道蛋白,参与长链脂肪酸的转运[4];ompN编码外膜上的孔蛋白,可能参与糖的转移、信号转导等各种细胞过程,可作为潜在的疫苗候选者;ybfM编码了可被壳二糖利用的OMPs.在大肠杆菌与沙门氏菌中,RybB sRNA与mRNA 5′-UTR区域结合可抑制多个主要OMPs的合成[5].
本试验通过同源重组系统及FLP酶/FRT位点特异性重组,构建鼠伤寒沙门氏菌外膜蛋白相关缺失菌株,在缺失菌株的基础上将lacZ基因分别插入fadL、ompN、ybfM缺失区域并且能进行β-半乳糖苷酶的表达.同时根据RybB基因序列,进行鼠伤寒沙门氏菌中部分RybB(GGAGCCCATC)缺失菌株与RybB全缺失菌株的构建.通过P22噬菌体转导方式,以鼠伤寒沙门氏菌Hfq、RybB缺失菌株作为供体菌株,将相应的缺失转入颜色指示菌株中,构建相应的Hfq缺失、RybB缺失、Hfq&RybB双缺失后的颜色菌株,通过β-半乳糖苷酶活性分析及qPCR探究伴侣蛋白Hfq与RybB sRNA 对外膜蛋白ybfM所产生的调控作用,为后续试验奠定基础.
1 材料与方法
1.1 菌株与质粒
鼠伤寒沙门氏菌参考菌株LT2(GenBank:NC_003197.265)、鼠伤寒沙门氏菌7455(携带质粒pKD46)均由法国国家科学研究中心(CNRS)分子遗传学Bossi实验室馈赠.
质粒pKD46(GenBank:AY048746.1)、质粒pCP20(GenBank:AY048744.1)、质粒pCE40(GenBank:AY061944.1)、质粒pKD3(GenBank:AY048742.1)、质粒pKD13(GenBank:AY048744.1)均由法国国家科学研究中心(CNRS)分子遗传学Bossi实验室馈赠.
1.2 主要试剂
DL2000 plus DNA Marker购自南京诺唯赞生物科技有限公司;2×Taq PCR Master Mix、Pfu DNA Polymerase、Taq DNA Polymerase、dNTPs Mix、卡那霉素、氯霉素、氨苄青霉素、四环霉素购自北京Solarbio公司;琼脂糖购自上海英潍捷基公司;核酸染料Goldview购自Biodee,QIAquick PCR Purification Kit (50)、Gel Extration KIT胶回收试剂盒购自Omega公司;50×TAE Buffer.
1.3 构建缺失株
构建缺失株LT2 ΔfadL∷MudK、LT2 ΔompN∷MudK、LT2 ΔybfM∷MudK、LT2 ΔRybB∷cat、ΔRybB(GGAGCCCATC)∷cat,根据GeneBank上LT2菌株的fadL、ybfM、ompN基因序列,设计同源重组引物P1(F)与P2(F)、P5(Y)与P6(Y)、P9(O)与P10(O)用于对应菌株构建,引物均由生工生物工程(上海)股份有限公司进行合成(表1).
利用λ-Red同源重组方法,以质粒 pkD13为模板,引物 P1、P2,PCR体系为8 μL pKD13(1∶20)、13 μL ddH2O、上下游引物各2 μL、Green Taq Mix 25 μL,程序为95 ℃变性10 s、53~60 ℃退火30 s、72 ℃延伸90 s的30个循环,所得目的片段按照试剂盒步骤进行纯化并于4 ℃保存.在含有L-阿拉伯糖的LB培养基中,37 ℃、170 r·min-1诱导培养pKD46,D600 nm值达到0.4~0.6时,将其菌液制备成电转化感受态细胞.将打靶片段电转化至pKD46感受态细胞中,转化产物于LB平板(含50 μg·mL-1的卡那霉素)上37 ℃培养过夜.经PCR筛选出fadL基因替换缺失株LT2 ΔfadL∷Kn.将pCP20质粒转入LT2 ΔfadL∷Kn缺失株中,在LBA中进行培养筛选,获得菌株 fadL-pcp20,将质粒Pce40转入菌株fadL-pcp20,通过抗性平板筛选出具有Kn抗性,在麦康凯平板上呈现红色的菌株命名为ΔfadL∷MudK,通过PCR与测序验证,构建出菌株LT2 ΔfadL∷MudK.其余缺失株按相同方法分别构建出LT2 ΔompN∷MudK、LT2 ΔybfM∷MudK.以质粒pkD3为模板,用相同体系和程序构建出LT2 ΔRybB∷cat,LT2ΔRybB(GGAGCCCATC)∷cat.
1.4 P22噬菌体转导构建缺失菌株
将鼠伤寒沙门氏菌Hfq、RybB缺失菌株作为供体菌株,将颜色构建菌株LT2 ΔfadL∷MudK、LT2 ΔompN∷MudK、LT2 ΔybfM∷MudK作为受体菌,把存有相应菌株的甘油于冰上进行解冻,按照1∶100的比例,取50 μL甘油于5mL Kn+LB中,在37 ℃、170 r·min-1摇床中进行过夜培养.取20 μL的供体菌borth至1.5 mL离心管,按1∶50加入980 μL无菌PBS中进行稀释.分别取受体菌50、100 μL稀释后供体菌borth至2.0 mL EP管中,混匀.将2.0 mL离心管置于37 ℃摇床进行孵育1 h后,取20 μL在相应抗性LB平板进行涂布筛选.次日取单个菌落进行划线纯化培养.
1.5 β-半乳糖苷酶活性分析
取50 μL待测菌株按照1∶50的比例置于5 mL Kn+LB中,在37 ℃、170 r·min-1摇床中进行培养至D600 nm=0.3~0.5.抽取菌液1 mL置于比色皿中测D600 nm.从比色皿中取0.1 mL至新试管中,以Z buffer定容到1 mL.向试管中添加数滴甲苯,在42 ℃水浴摇床中进行振荡2 h.将试管转于28 ℃水浴锅中放置5 min,通过向试管中加入0.2 mL 邻硝基苯β-D-半乳糖吡喃糖苷(o-Nitrophenyl-β-D-Galactopyranoside,ONPG)(4 g·L-1)并记录加入时间(t0).当试管中呈现出黄色时,加入0.5 mL 1mol·L-1Na2CO3终止反应,记录终止时间(tf).将试管中终止所得液体进行1次离心,取上清液 1 mL置于比色皿中,以Z buffer 管作为空白对照,测D420 nm.通过公式计算β-半乳糖苷酶活性.
β-半乳糖苷酶活性=(1 000×D420 nm)/[(tf-t0)×D600 nm]
1.6 fadL、ompN、ybfM转录水平的变化
根据GenBank上鼠伤寒沙门氏菌LT2 16s RNA、ybfM、fadL、ompN序列,设计相应的qPCR引物(表2),引物均由生工生物工程(上海)股份有限公司进行合成.

表2 qPCR引物Table 2 Primers used for qPCR amplification
根据R6950 Bacterial RNA Kit,提取鼠伤寒沙门氏菌LT2的RNA,以相应的菌株RNA作为模板,按照HiScriptⅢRT superMix for qPCR试剂盒说明书进行cDNA的合成.以反转录得到的cDNA作为模板,按照SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒说明书进行qPCR,通过GraphPad Prism 8.0.2软件进行数据分析.
2 结果与分析
2.1 缺失菌株的构建及PCR鉴定
利用λ-Red同源重组系统将mudk与STMLT2 wild株候选基因融合,结果表明,菌株经特异性引物PCR 扩增后,出现与预期相符的条带,分别为958、1 297、962 bp(图1),深圳华大生物科技有限公司的扩增产物测序结果也与预期相符,本试验成功构建STMLT2fadL基因MudK融合菌株、STMLT2ompN基因 MudK融合菌株、STMLT2ybfM基因MudK融合菌株.将构建的RybB相关缺失菌株DNA作为模板,通过特异性引物进行扩增,PCR扩增片段为472 bp,菌株LT2∷cat、LT2 ΔRybB(GGAGCCCATC)∷cat、LT2 ΔRybB∷cat作为模板扩增片段分别为1 477、1 470、1 227 bp(图2),将鼠伤寒沙门菌LT2∷cat、LT2 ΔRybB(GGAGCCCATC)∷cat、LT2 ΔRybB∷cat PCR产物送至生物公司进行测序,成功构建LT2 ΔRybB(GGAGCCCATC)∷cat、LT2 ΔRybB∷cat.

A:fadL缺失菌株; B:ompN缺失菌株;C:ybfM缺失菌株;M:2000 bp DNA marker;泳道1、3、6分别为LT2 ΔfadL∷MudK、LT2 ΔompN∷MudK、LT2 ΔybfM∷MudK;泳道2、4、5均为空白对照.图1 fadL、ompN、ybfM缺失菌株的PCR电泳扩增图Fig.1 Electrophoretogram of PCR amplifications of fadL, ompN and ybfM deletion strains
M:2 000 bp DNA marker;1:鼠伤寒沙门氏菌LT2;2:LT2∷cat;3:LT2 ΔRybB (GGAGCCCATC)∷cat;4:LT2 ΔRybB∷cat.图2 LT2 RybB缺失菌株的PCR电泳图Fig.2 PCR electropherogram of LT2 RybB deletion strain
2.2 转导构建
以LT2 Δhfq∷TetRa、RybB分别作为供体菌株,通过P22噬菌体转导,将hfq、RybB缺失片段转入LT2fadL∷MudK、LT2 ΔompN∷MudK、LT2ybfM∷MudK中,在颜色指示菌株基础上进行hfq、rybB的单缺失菌株、双缺失菌株的构建(图3).

A:hfq菌株构建;B:RybB菌株构建;M:2 000 bp DNA marker;1:LT2 ybfM∷MudK Δhfq∷TetRa;2:LT2 ybfM∷MudK ΔRybB∷cat;3:LT2 ybfM∷MudK Δhfq∷TetRa ΔRybB∷cat;4:LT2 ompN∷MudK Δhfq∷TetRa;5:LT2 ompN∷MudK ΔrybB∷cat;6:LT2 ompN∷MudK Δhfq∷TetRa ΔrybB∷cat;7:LT2 fadL∷MudK Δhfq∷TetRa;8、9:LT2 fadL∷MudK ΔrybB∷cat;10、11:LT2 fadL∷MudK Δhfq∷TetRa ΔrybB∷cat.图3 菌株转导构建结果Fig.3 Verification of strain transduction and construction
2.3 hfq及rybB对外膜蛋白的作用
根据β-半乳糖苷酶活性分析hfq、rybB对fadL、ompN、ybfM的蛋白表达的影响(图4).结果表明,当hfq缺失后,fadL蛋白表达下调,而ybfM、ompN蛋白表达水平上调,分别为未缺失株的0.43、1.3、134.6倍;当rybB缺失后,fadL、ybfM、ompN的蛋白表达上调,分别为未缺失株的1.2、1.75、6.7倍;当hfq与rybB共同缺失后,相较于未缺失菌株,fadL的蛋白水平下调,是未缺失的0.47倍,ybfM和omoN的蛋白水平上调,是未缺失的1.8和336.5倍.

图4 鼠伤寒沙门氏菌颜色指示菌株的β-半乳糖苷酶活性 图5 rybB、hfq基因单缺失或双缺失后fadL、ompN、ybfM基因转录水平Fig.4 β-galactosidase activity of S.typhimurium as color indicator strain Fig.5 Transcriptional levels of fadL, ompN and ybfM genes after single or double deletion of rybB and hfq genes
qPCR检测结果表明(图5),与鼠伤寒沙门氏菌相比,LT2 Δhfq∷TetRa中fadL基因转录表达下调6.13倍,而ompN、ybfM基因转录表达分别上调了10.39、15.7倍;LT2 ΔrybB∷cat中fadL、ybfM基因转录表达分别下调2.44、2.32倍,ompN基因上调了3.68倍;LT2 ΔrybB∷cat Δhfq∷TetRa中fadL基因转录表达下调1.12倍,而ompN、ybfM上调6.80、2.85倍.
通过qPCR探究RybB中GGAGCCCATC缺失对fadL、ompN、ybfM转录水平的影响(图6),qPCR结果显示,当RybB缺失后,ybfM、ompN、fadL转录量分别下调2.32倍、上调3.68倍、下调2.44倍;当RybB中(GGAGCCCATC)缺失后,ybfM、ompN、fadL转录量分别上调3.98、175.50、3.47倍;当RybB缺失后,Δhfq对ybfM、ompN、fadL转录量分别由15.70、10.39、6.13倍变为2.85、6.84、1.12倍.当RybB中(GGAGCCCATC)缺失后,Δhfq对ybfM、ompN、fadL转录量分别由15.70、10.39、6.13倍变为4.24、151.30、3.52倍.
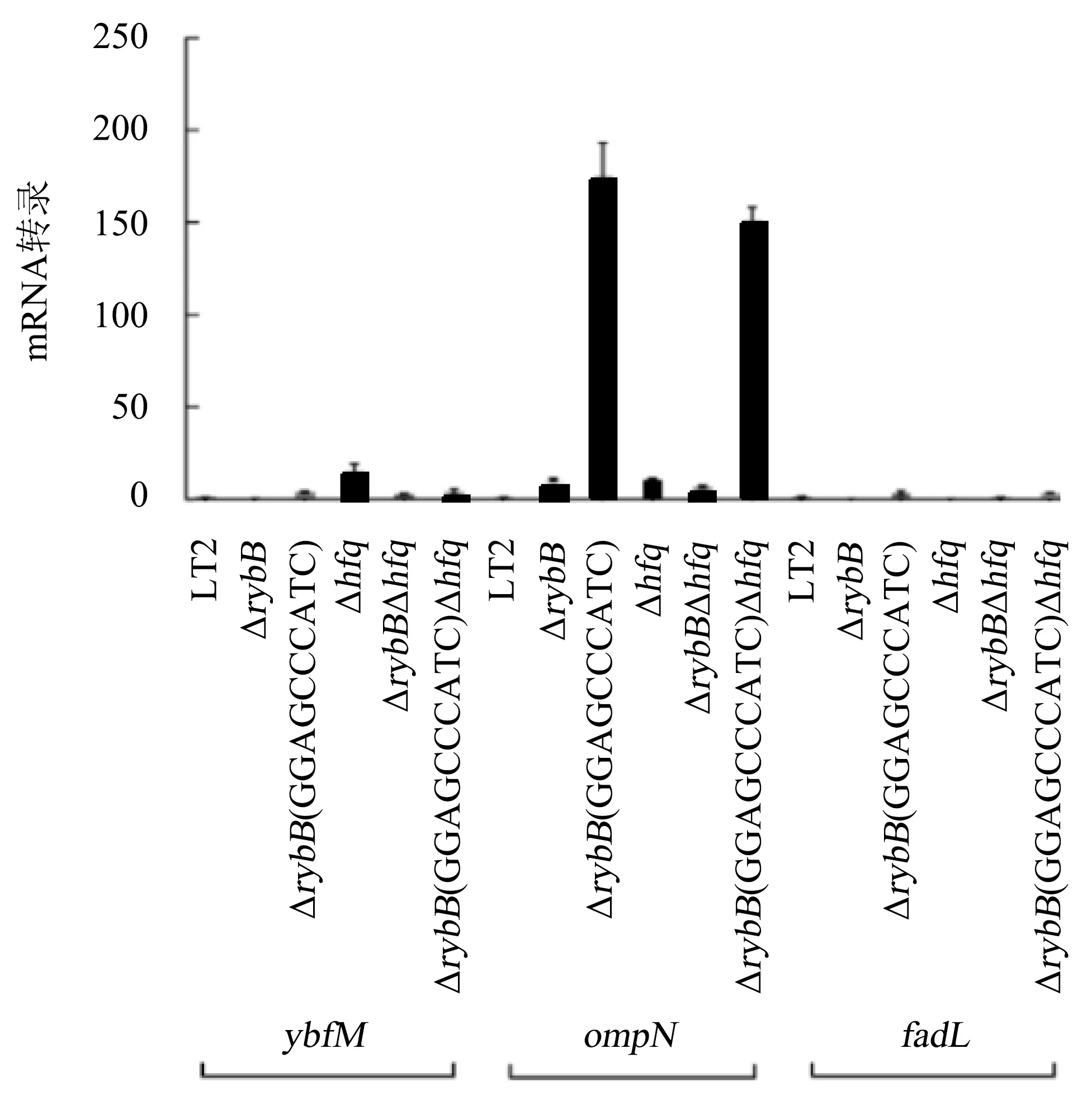
图6 ΔrybB(GGAGCCCATC)对fadL、ompN、ybfM基因转录水平的影响Fig.6 Effect of ΔrybB (GGAGCCCATC) on transcriptional levels of fadL, ompN and ybfM genes
3 讨论
细菌的调控是一个复杂的过程.RNA伴侣蛋白Hfq参与许多细菌生命活动中的众多网络监管,被视为转录后网络的核心组成部分.与Hfq相关的sRNA可能构成迄今已知的最大的转录后调节组,模型肠杆菌(如大肠杆菌或鼠伤寒沙门氏菌)可能表达其中的100种以上.依赖于Hfq的sRNA的长度通常在50~250 nt,结构多样,并从独立的染色体基因转录而来.通常通过短而不完善的RNA相互作用(10~25个碱基对)识别mRNA的5′区域,从而负责调节翻译或稳定性.RybB是一种响应σE激活而合成的sRNA,下调几种主要OMPs的表达.OMPs的过度积累是导致σE激活的信号之一,因此RybB有助于维持OMPs的稳态,并作为自体控制的基础.
为确定Hfq、rybB对fadL、ompN、ybfM的调控作用,本试验在构建出LT2fadL∷MudK、LT2ompN∷MudK、LT2ybfM∷MudK颜色指示菌株的基础上进行hfq、rybB的单缺失、双缺失菌株的构建,通过β-半乳糖苷酶活性与qPCR分别探究蛋白水平与转录水平的影响.结果表明,在蛋白水平上,ompN对hfq的缺失并不敏感,而rybB缺失后,ompN表达呈一定程度的上调.有研究表明[5],RybB可通过与ompNAUG起始密码子的下游+4至+11编码序列进行互补配对,RybB可限制ompN的蛋白表达,造成约14倍差异变化;Dam et al[6]通过构建大肠杆菌ompN-lacZ菌株和β-半乳糖苷酶活性分析,在热激条件下,通过IPTG的抗σ因子RseA的过表达,使细菌暂时耗尽σE,当RybB、hfq缺失后,ompN-lacZ表达量无变化,rybB、hfq可能并不直接对ompN进行作用,而是通过σE因子对ompN进行调控.而在转录水平上,hfq、RybB基因缺失能够导致ompN转录水平的提高,而hfq与rybB同时缺失时,虽然ompN的转录水平上调,但低于hfq单独缺失的变化.在蛋白水平上,hfq、rybB对ybfM具备强烈的抑制调控作用,而在转录水平上,rybB缺失导致ybfM转录水平降低,即使hfq缺失能够引起ybfM转录量的提升,但当RybB与hfq共同缺失时,ybfM转录量显著低于hfq单独缺失.rybB与ybfMAUG起始密码子的下游+12至+18的编码序列进行碱基互补配对,当rybB缺失后,ybfM的蛋白表达量几乎翻了一番[5].hfq可控制micM对ybfM的抑制作用[7,8].试验结果表明,hfq缺失后可导致fadL蛋白表达量出现降低,RybB缺失后,fadL蛋白表达量升高,然而在转录水平上,RybB、hfq均导致fadL转录水平的降低,同时缺失RybB与hfq时,fadL转录量显著低于单缺失.RybB与fadLAUG起始密码子的下游+43至+50的编码序列进行互补配对[9],Hfq直接参与RybB与fadLmRNA相互作用[10].Papenfort et al[9]将携带表达质粒pBAD-RybB的沙门氏菌培养至D600 nm为1.5,并通过L-阿拉伯糖诱导pBAD-RybB表达10 min后,ompN、fadLRNA分别降低6倍与8倍.本试验仅进行RybB缺失,导致ompN转录水平升高约6.7倍,然而fadL的转录水平下降,蛋白表达水平变化与转录水平变化不一致的情况,可能与RybB对fadL、ompN的结合位点相关,RybB与ompN起始密码子的5个密码子窗口内(+5至+20)进行结合,与fadL的5个密码子窗口下游的区域(+43至+50)进行结合.RybB与相应靶mRNA AUG周围区域内结合而主动抑制靶标,而结合的位点可影响靶标基因的活性.
RybB以其约+20至+40间序列与RHO非终止子和伴侣蛋白进行结合.探究RybB(+20 to+40)间序列GGAGCCCATC对RybB与伴侣蛋白Hfq调控作用的影响,结果表明,RybB中GGAGCCCATC缺失能可上调ybfM、ompN、fadL的转录水平,并使Δhfq对ybfM、fadL转录水平的调控作用减弱,增强Δhfq对ompN转录水平的调控作用;而RybB缺失可降低fadL、ybfM的转录水平、上调ompN的转录水平,并降低Δhfq对ybfM、ompN、fadL转录水平的调控作用.同时以LT2ybfM∷MudK为基础,ΔRybB、ΔRybB(GGAGCCCATC)均可提高Hfq对ybfM的表达调控作用.推测Hfq与RybB对同一基因可出现同时抑制、促进或一方抑制、促进的作用,两者结合后可能出现竞争关系,导致对目的基因的调控功能出现差异,而RybB中的序列GGAGCCCATC对Hfq、RybB的调控作用是不可缺少的,当序列GGAGCCCATC缺失后,导致Hfq、RybB结合能力减弱.序列GGAGCCCATC缺失是否影响sRNA RybB与Hfq的作用还需进一步的探索.
