胃癌中p-Stat3和Survivin表达的病理学意义及术前指标预后模型的建立
2022-06-06王晓军马苗苗张丹丹聂佳琪李晓宁崔海康张文杰
岳 汶,王晓军,马苗苗,张丹丹,潘 凤,聂佳琪,李晓宁,崔海康,杨 兰,张文杰,3
据GLOBOCAN 2018年统计报告,胃癌是世界发病率排名第五的高发肿瘤,其病死率排名第三(占癌症死亡总数的8.2%)[1]。在我国,胃癌的发病率为20.7%,位列恶性肿瘤发病率第4位;病死率为17.5%,在恶性肿瘤中位列第2位。早期胃癌经手术治疗后预后较好[2],但已进入进展期胃癌的患者即使接受了手术治疗,其治疗效果和术后生活质量均较差,复发率较高,预后也要差于早期胃癌术后的患者[3]。因此,丰富诊断早期胃癌的手段,实现胃癌的早诊早治,对术后患者的生存预后尤为关键。该研究采用术前多指标联合检测的方法预测胃癌患者术后生存预后,并筛选出预测胃癌术后生存的最优组合,为临床医师制订治疗方案提供参考。
1 材料与方法
1.1 材料收集2008年1月—2013年12月于石河子大学医学院第一附属医院行胃部肿瘤切除术的133例患者信息,收集其胃癌及癌旁组织石蜡标本,癌旁组织取自对应的肿瘤组织边缘5 cm以外的部位。本研究随访时间截至2019年10月1日。
1.2 试剂免疫组化染色试剂盒(Envision法)购自北京中杉金桥生物技术有限公司;兔抗人单抗p-Stat3抗体(Ab17955)、Survivin抗体(Ab76424)购自英国Abcam公司。
1.3 石蜡组织芯片由经验丰富的病理医师对术后石蜡切片分别进行复片,在癌旁及胃癌组织中选取具有代表性的区域。将组织从供体蜡块中取出,接种于受体蜡块中,制作石蜡组织芯片。
1.4 免疫组化免疫组织化学使用Envision法染色。芯片组织经脱蜡、水洗后,EDTA或枸橼酸进行高温高压抗原修复;使用3%H2O2阻断内源性过氧化物酶10 min,滴加一抗(p-Stat3和Survivin),置于4 ℃冰箱孵育过夜;复温后滴加二抗室温孵育30 min;显微镜下观察DAB显色,至显色效果最好时终止显色;苏木精复染、脱水、晾干、中性树胶封片。
1.5 结果判读p-Stat3和Survivin阳性表达结果均为镜下细胞核染色由浅黄至深棕褐色颗粒。阳性细胞数占比计分方法:<5%计0分,6%~25%计1分,26%~50%计2分,51%~75%计3分,76%~100%计4分。着色强度计分方法:无着色计0分,浅棕黄色计1分,棕黄色计2分,棕褐色计3分。两项积分相乘:0~1分计阴性表达(-),2~4分计为弱阳性表达(+),5~8分计为阳性(),9~12分计为强阳性 ()。
1.6 统计学处理采用SPSS 22.0以及R studio软件进行分析。通过Kruskal-Wallis H检验比较p-Stat3和Survivin在胃癌和正常胃黏膜之间表达差异性;同样采用Kruskal-WallisH检验比较p-Stat3和Survivin表达高低与胃癌术后患者临床病理特征的相关性;采用Kaplan-Meier法绘制生存曲线;使用ROC曲线下面积(AUC)表示各指标对于预测胃癌患者预后的价值;使用Cox回归分析-单因素及多因素分析影响胃癌术后患者死亡风险的危险因素;结合Logistic回归模型联合ROC曲线来描述多指标联合检测对患者术后生存状态的预测价值;使用R Studio软件中survival和rms程序包建立列线图预测模型;采用Hosmer-Lemeshow拟合优度检验分析多指标联合检测组合的预测值与实际观测值之间的吻合程度,并绘制校准曲线。
2 结果
2.1 胃癌及癌旁组织中p-Stat3和Survivin的表达情况在细胞中p-Stat3和Survivin显色表达部位是胞核,胞核被染为棕褐色。图1显示p-Stat3和Survivin在癌旁和胃癌组织中的阴性和阳性表达。
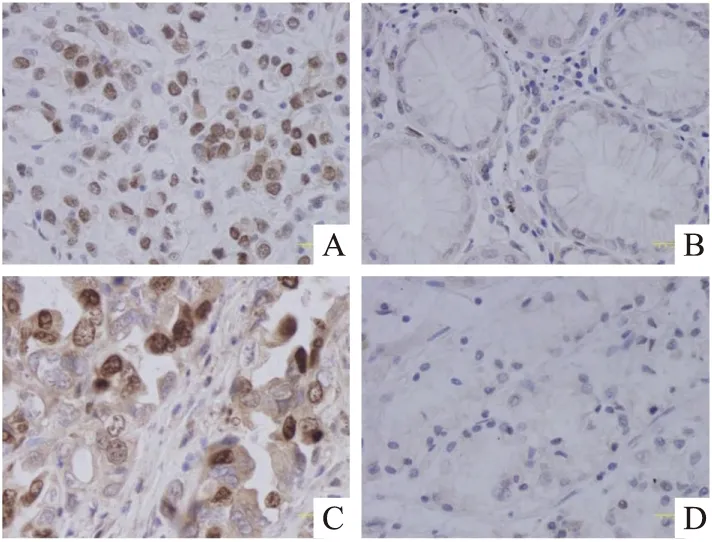
图1 p-Stat3和Survivin在胃癌及癌旁组织中的表达Envision ×400A、B:p-Stat3在胃癌及癌旁组织中的表达;C、D:Survivin在胃癌及癌旁组织中的表达
p-Stat3和Survivin在胃癌和癌旁组织中的表达有显著差异,两者在胃癌组织中的表达均高于癌旁组织(P<0.001),见表1、图2。由于石蜡组织芯片的切片组织容易脱片,故造成部分结果缺失,见表1。
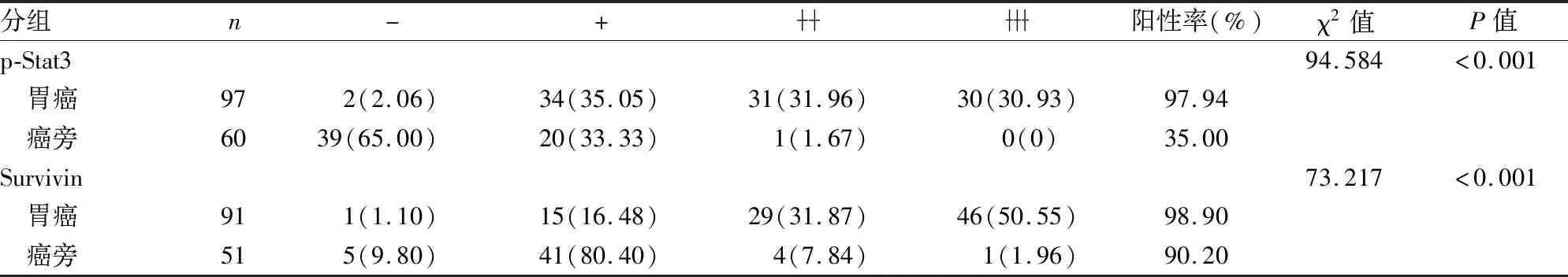
表1 胃癌及癌旁组织中p-Stat3和Survivin的表达差异[n(%)]
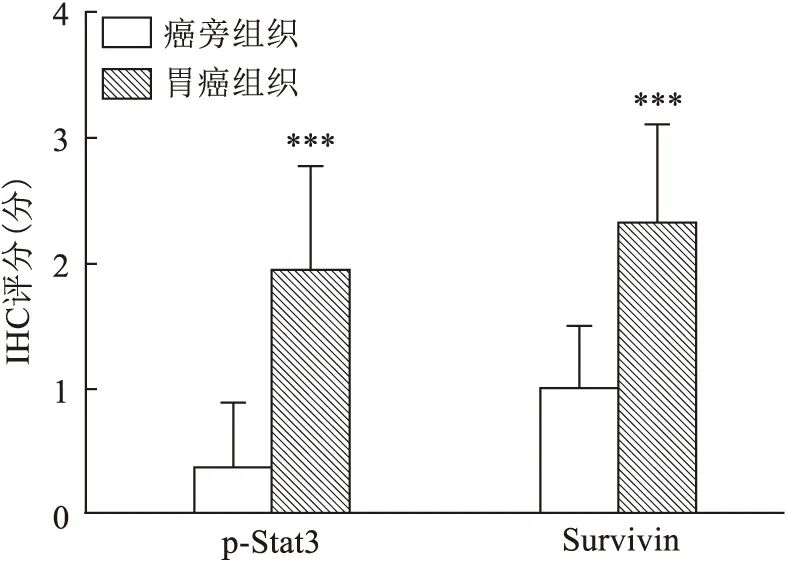
图2 胃癌及癌旁组织中p-Stat3和Survivin的表达分布与癌旁组织比较:***P<0.001
2.2 胃癌患者的基本情况如表2所示,133例肝癌患者中,男102例,女31例;年龄范围32~86岁,平均年龄63.65岁;高分化腺癌5例,中分化腺癌38例,低分化腺癌90例;TNM分期:Ⅰ期24例,Ⅱ期43例,Ⅲ期52例,Ⅳ期14例。使用ROC计算出Cutoff值,以Cutoff值为界,将丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase, AST)分为低水平组与高水平组,ALT的Cutoff值为10.5 U/L(男性和女性);AST的Cutoff值为14.50 U/L(男性)和19 U/L(女性)。
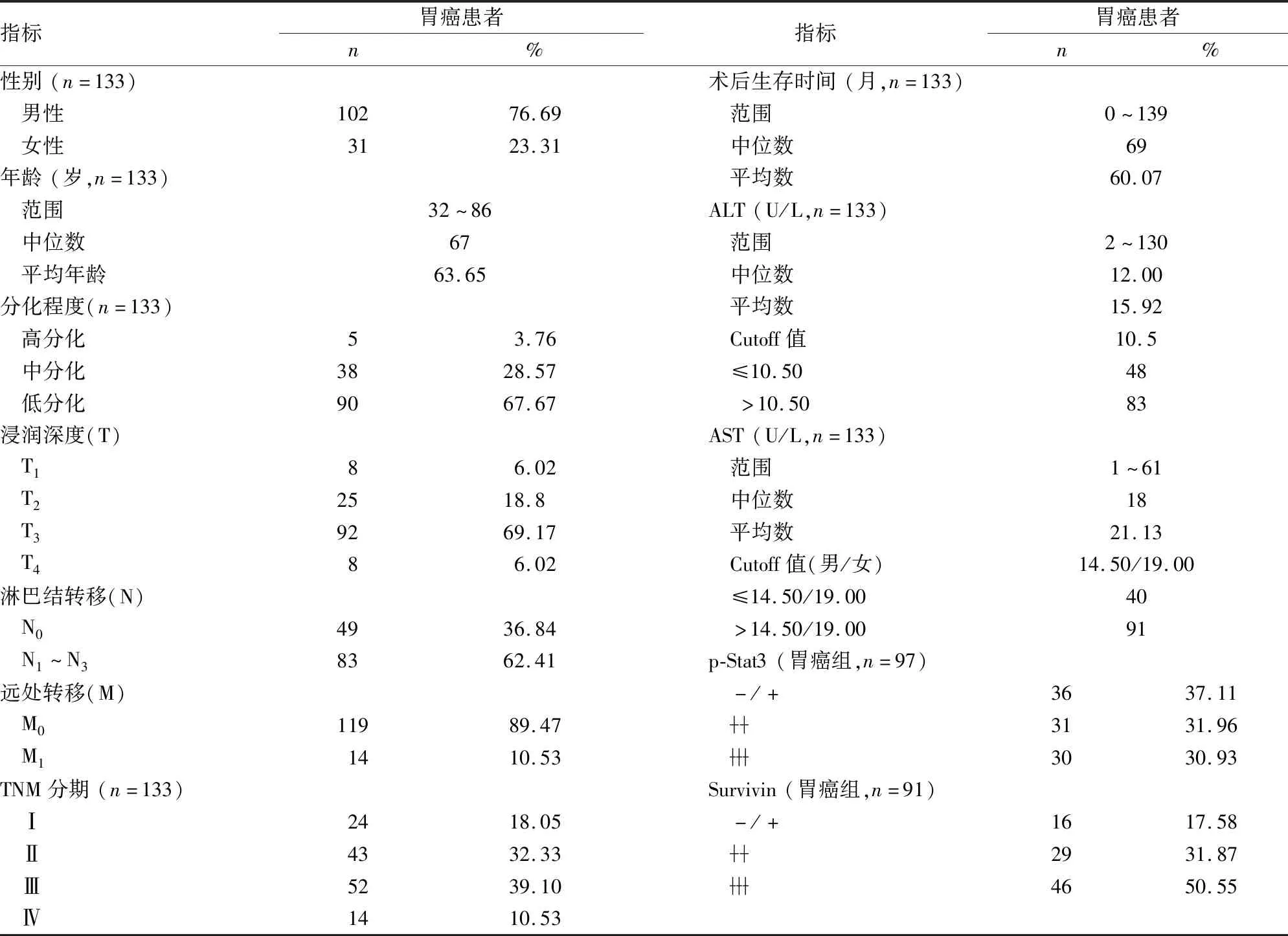
表2 胃癌患者术前及术后指标的基本情况
2.3 胃癌组织中p-Stat3和Survivin的表达与患者临床病理特征的关系表3显示p-Stat3在胃癌组织中的表达与浸润深度(P=0.037)及TNM分期(P=0.017)相关,而与患者的性别、年龄、分化程度、淋巴结转移、远处转移、AST及ALT无关(P>0.05);Survivin在胃癌组织中的表达与患者的分化程度(P=0.001)、浸润深度(P=0.037)相关,而与患者的性别、年龄、淋巴结转移、远处转移、TNM分期、ALT及AST无关(P>0.05)。
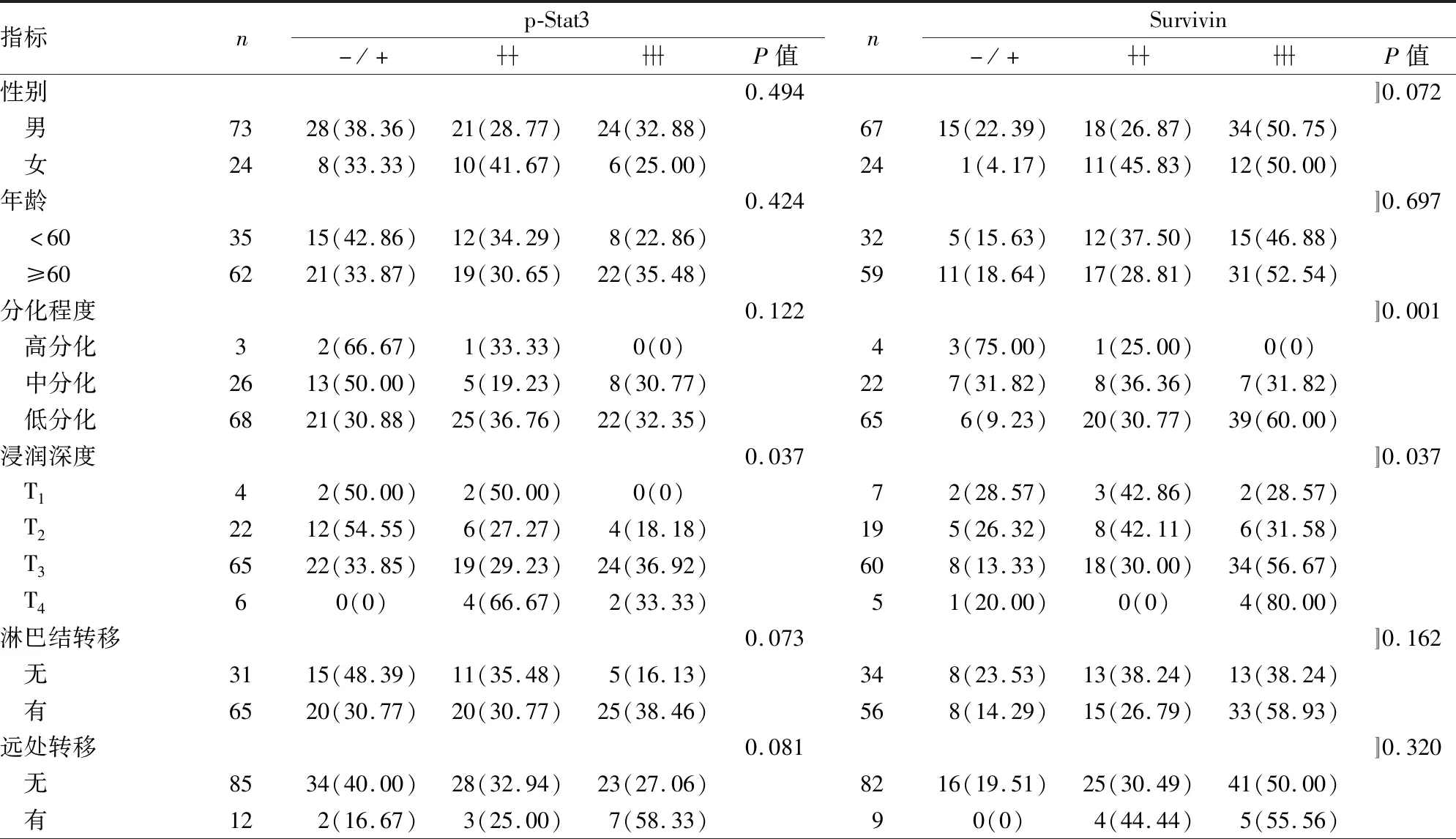
表3 癌组织中p-Stat3和Survivin表达与患者临床病理特征的关系[n(%)]
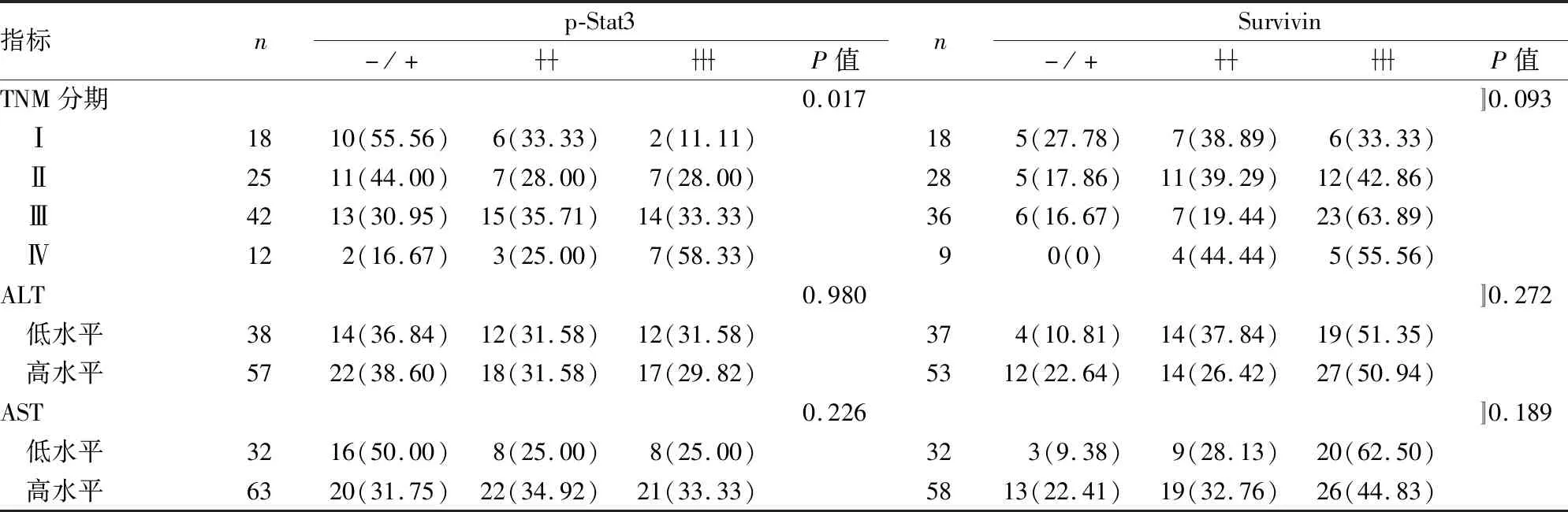
续表
2.4 p-Stat3、Survivin、ALT和AST的水平与胃癌患者预后生存本研究共收集胃癌患者133例,截至2019年10月1日,50例患者生存,83例患者死亡。
Kaplan-Meier生存曲线(图3)提示:p-Stat3(P=0.010)与Survivin(P=0.005)的表达水平越高,患者预后越差;ALT高水平组的患者总体生存率要高于低水平组(P=0.001);分化程度越低,患者的总体生存率越低(P=0.002);随着TNM分期的增高,患者的总体生存率越低(P<0.001)。AST水平的高低对患者预后的影响无明显差异(P=0.673)。
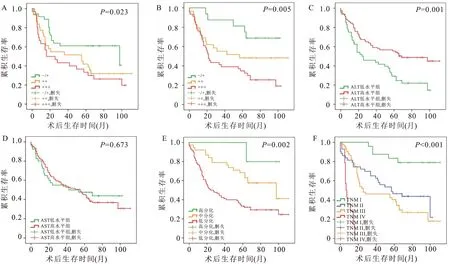
图3 p-Stat3、Survivin、ALT、AST、分化和TNM分期与胃癌患者预后的生存分析A:p-Stat3表达情况的生存曲线;B:Survivin表达情况的生存曲线;C:ALT高低水平的生存曲线;D:AST高低水平的生存曲线;E:不同分化程度的生存曲线;F:不同TNM分期的生存曲线
2.5 胃癌患者的各个检测指标对预后生存的预测价值如表4所示,在单个指标中,TNM分期、浸润深度、分化程度、Survivin 、p-Stat3、ALT、分化、年龄均可预测胃癌患者术后死亡风险(预测价值从大到小)。其中,TNM 分期的AUC 最大(AUC=0.758),对胃癌患者术后生存的预测价值最大(图4)。
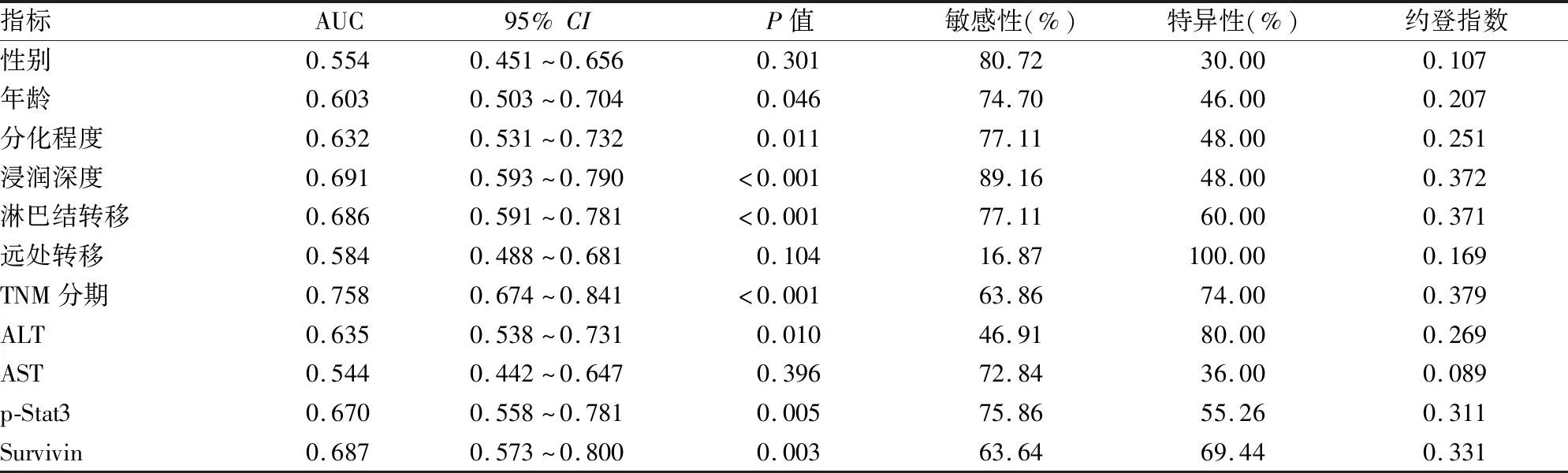
表4 胃癌患者各个指标间ROC曲线线下面积
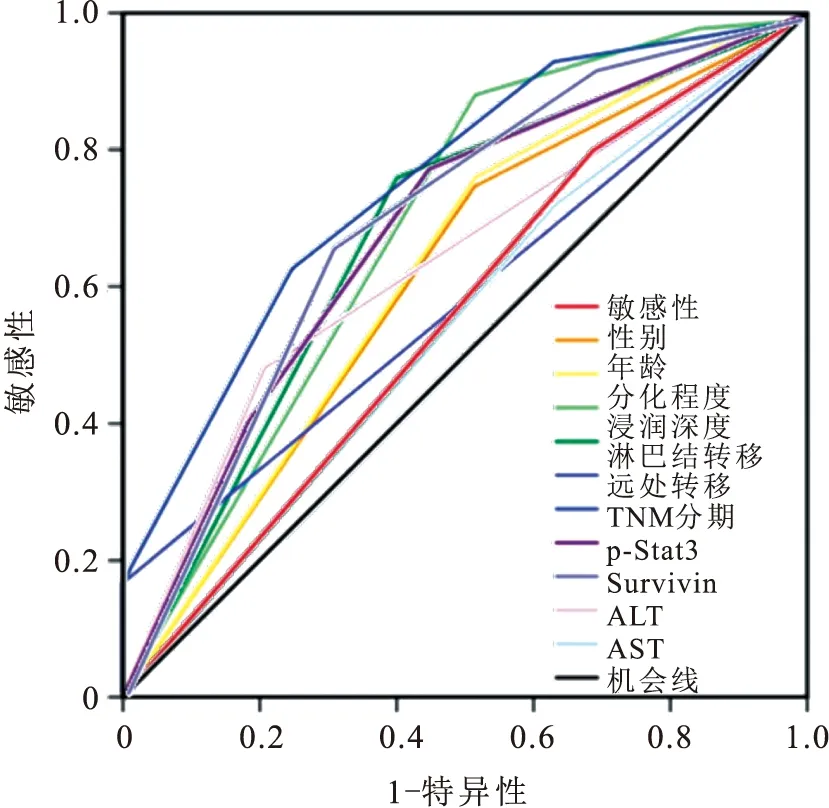
图4 示临床病理指标及免疫组化指标预测胃癌患者预后生存的ROC曲线
2.6 影响胃癌患者预后的危险因素分析综合单因素和多因素 COX 风险回归模型发现,年龄、分化程度、浸润深度、淋巴结转移、远处转移、TNM分期、ALT、p-Stat3及Survivin是影响胃癌患者预后的重要因素(表5)。
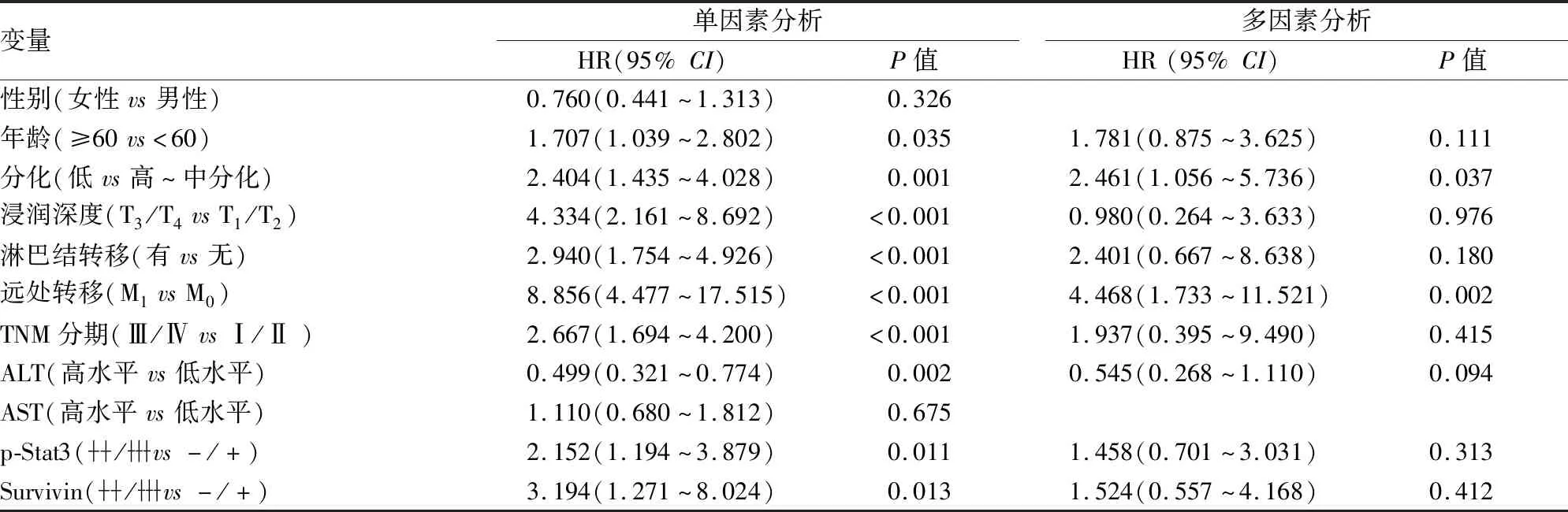
表5 胃癌患者各指标的Cox回归模型单因素及多因素分析
2.7 ROC曲线评估各指标联合预测胃癌患者术后死亡风险的效能在表6中,联合了分化程度、p-Stat3、Survivin、ALT和AST预测胃癌术后生存状况。运用减指标的方法对5个指标进行逐个筛减发现,组合3为指标最少且预测价值最大的组合。因此Survivin、ALT和AST为本研究中联合预测胃癌患者术后死亡风险的最优组合,其AUC高于TNM分期组合。
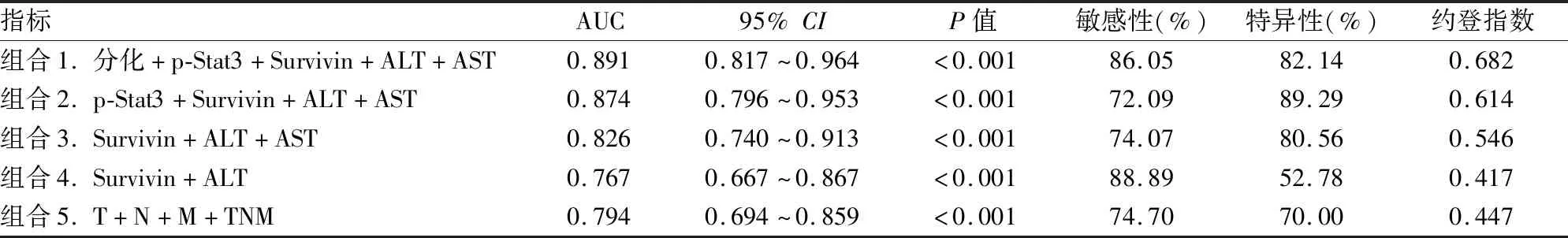
表6 胃癌患者多指标联合ROC曲线线下面积
2.8 多指标联合最优组合构建列线图预测模型本研究模型如图5所示,Survivin、ALT、AST变量的长度代表了该因素对胃癌死亡事件的贡献度,向上对应分值标尺中标注的分数,根据患者的个体化状态,将每一个变量的分数相加得到一个总分值,刻度线向下投射即可得出该胃癌个体的术后3年或5年的生存率预测值。
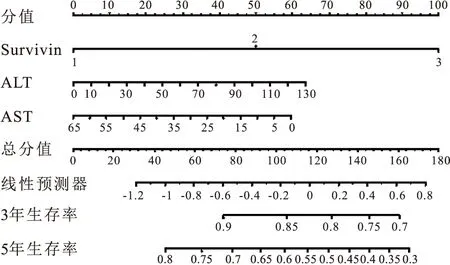
图5 Survivin+ALT+AST联合预测胃癌患者术后生存列线图
2.9 多指标联合预测胃癌患者术后生存组合的校准度对本研究的最优组合模型进行Hosmer-Lemeshow拟合优度检验,χ2=3.871,P=0.869,并绘制该组合模型的校准曲线(图6),发现模型预测到的与实际观察到的不良事件发生数量基本拟合,一致性较好,预测水准较高。
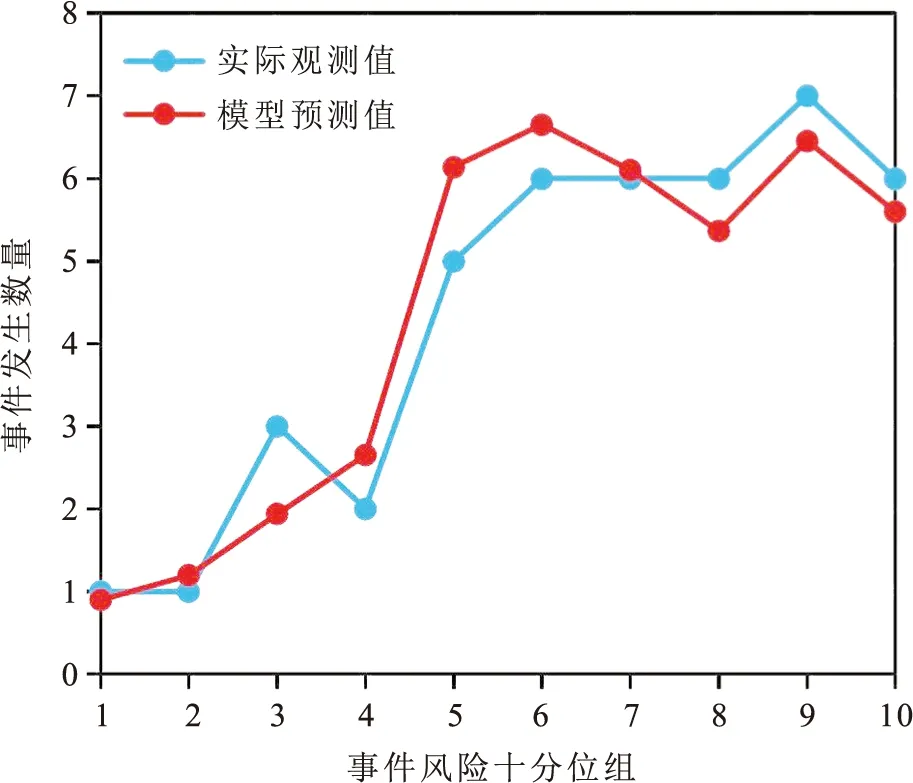
图6 多指标联合预测模型的Hosmer-Lemeshow拟合优度检验校准曲线
3 讨论
STAT3能够通过JAK/STAT通路入核调控与肿瘤密切相关的基因,介导肿瘤细胞的增殖、侵袭和血管生成等[4]。本研究显示,胃癌组织中p-Stat3的表达明显高于癌旁组织(表1),这与Kim et al[5]研究结果一致,提示p-Stat3可能在正常胃黏膜向胃癌的恶性转变过程中起到了重要作用。一项meta分析[6]显示,消化系统恶性肿瘤中p-Stat3的表达会对患者的预后造成不良后果。生存分析显示,随着p-Stat3表达水平的升高,胃癌患者的生存预后越差(图3)。张传海 等[7]发现,STAT3信号通路的活化与肝癌侵袭转移密切相关,p-Stat3有望作为肝癌预后判断的参考指标,本研究同样显示p-Stat3对于胃癌患者的生存预后具有一定的预测价值(图4)。
Survivin是一种凋亡抑制因子,能在肿瘤组织和细胞中高表达,抑制肿瘤细胞的凋亡,对肿瘤细胞的增殖起到促进作用。本研究结果显示,Survivin在胃癌组织中的表达水平高于癌旁组织(表1),并且在生存分析中发现,Survivin的表达水平越高,患者预后越差。笔者认为,Survivin的表达在胃癌的发生发展中起着重要作用,并可将其作为胃癌侵袭及预测生存预后的分子标志物,这与Krieg et al[8]的研究一致。
既往研究[9]表明,一些常见的血清学指标是影响胃癌患者预后的因素,包括ALT和AST。本研究显示高水平ALT患者的预后更差(图3),但并未发现AST对于预后的影响。Kunutsor et al[10]发现,欧洲人群中ALT较高的患者发生胃癌的风险可能较低,但在亚洲人群中ALT升高可能增加患癌的风险。
p-Stat3与Survivin的表达能够在术前的活检标本中进行检测,ALT与AST的结果均可在入院时的血清学检查中获得,而本研究旨在通过术前多指标联合建立预测患者预后的模型,为临床医师提供参考。笔者提出假说:在胃癌患者体内,与癌变、肿瘤进展和患者预后的相关基因、分子及组织细胞已经发生改变,不会因外科手术而发生逆转,所以,凡是与上述这些改变有关的分子细胞学指标,根据其术前样本的检测结果应该可以预测这些改变带来的不良影响。本研究初步建立起一个预测价值较大并且具有临床应用价值的生存预后预测组合(Survivin+ALT+AST),可作为便捷公式纳入临床中使用,并根据可视化的列线图(图5),帮助临床医师在术前进行手术决策、预判术后生存概率及制订术后最佳治疗方案,从而避免治疗不足或过度治疗带来的风险。
