miR-138调控TrkA-TRPV1信号通路对KOA模型大鼠软骨损伤的影响
2022-06-06徐远坤
杨 砥,徐远坤
膝骨性关节炎(knee osteoarthritis,KOA)作为慢性退行性骨关节疾病,多发于中老年群体,以膝关节疼痛及活动障碍为主要表现[1]。流行病学调查显示,KOA已成为全球公认的主要致残原因,且近年来KOA发病呈年轻化发展趋势,故有效预防KOA对人类健康具有重要裨益[2-3]。目前,KOA发病机制尚未完全阐明。有学者[4-5]指出,miR-138在KOA患者关节液中呈低表达,提示其可能参与KOA的发生发展,造成软骨损伤,但其具体作用机制尚不明确。基于此,该文建立KOA模型,通过TrkA-TRPV1信号通路调控miR-138,探究miR-138对KOA大鼠软骨损伤的影响。
1 材料与方法
1.1 实验材料
1.1.1实验动物 选取40只健康SD大鼠,体质量203~252(227.50±20.82)g,由科文斯医药研发(上海)有限公司提供,实验动物许可证号:SYXK(沪)2021-0001。实验动物处置严格遵守实验动物管理与保护的有关规定,饲养环境恒温(21.50±2.00)℃,相对湿度42%~50%左右,自由饮水摄食,12 h/12 h黑夜光照循环,以维持基础状态。
1.1.2主要试剂 TrkA一抗(兔来源,批号:ab76291)、二抗(抗兔,批号:ab150078)购自北京义翘神州科技股份有限公司;TRPV1(兔来源,批号:ab6166)购自武汉菲恩生物科技有限公司;antago miR-138、ago miR-138购自汉恒生物科技(上海)有限公司。
1.1.3主要仪器 ELISA试剂盒购自上海美轩生物科技有限公司;酶标仪购自上海赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1建模及分组 将40只健康SD大鼠随机分为正常组、模型组、沉默组、过表达组。正常组:给予大鼠尾部注射等剂量0.9%氯化钠溶液处理;模型组:给予大鼠麻醉、作右膝关节内侧入路,离断摘除前后交叉韧带、内侧半月板,给予尾部注射等剂量0.9%氯化钠溶液处理;沉默组:给予尾部注射30 mg/kg antago miR-138处理;过表达组:尾部注射30 mg/kg ago miR-138处理。同时各组给予腹腔注射8×104U青霉素(1 ml/kg)预防感染,连续注射1周。均连续给药7 d。
1.2.2样本采集及HE染色 于药物干预7 d后,空气栓塞法处死大鼠,抽取各组大鼠右膝关节关节液置于试管内,低温、3 000 r/min(半径:12 cm)离心10 min,分离上清液,-80 ℃超低温冰箱内保存待检。剪开膝关节囊,无菌操作分离股骨内踝关节软骨组织,剪取部分软骨组织制备匀浆液,将软骨组织置于4%多聚甲醛中浸泡固定,24 h后脱水处理,石蜡包埋,切成4 μm切片,依次经二甲苯、梯度乙醇水化后,苏木精浸染5 min,盐酸乙醇分色,自来水冲洗,1%伊红染色2~3 min,脱水、透明、封片,光镜进行观察。
1.3 指标观察
1.3.1行为学、软骨组织学检测
1.3.1.1行为学检测 于药物干预7 d后,应用改良Lecuesne MG膝关节评估法[6]对各组大鼠膝关节进行行为学评估,包括步态改变、关节肿胀、关节活动及疼痛刺激反应等。
1.3.1.2软骨组织学检测 使用显微镜对膝关节软骨组织病理切片进行观察,包括血管充血、炎细胞浸润及软骨细胞坏死等病理变化,应用Mankin评分[8]对各组大鼠软骨组织形态学进行评估。0分:软骨结构、软骨细胞数量如常,潮线完整,基质染色正常;1分:软骨细胞弥漫性分布,数量增多,软骨表面存在不规则裂隙,出现多重潮线,基质染色减退;2分:软骨细胞成簇生长,软骨裂隙深达肌层,软骨下血管浸润肌层,基质染色明显减退;3分:软骨细胞显著减少,软骨裂隙深达辐射层,基质染色显著减退;4分:软骨裂隙深达钙化层,基质染色完全消失;5分:软骨层脱落。
1.3.2关节液中炎性因子水平检测 利用双抗体夹心法测定TNF-α、IL-1、IL-6,按照1 ∶2比例稀释样品;于每孔内加入100 μl已稀释好的待测样本和标准品,37 ℃恒温孵育箱中湿育2 h;后以专用的洗涤液重复洗涤反应板,再加入1 ∶100稀释的抗体工作液100 μl/孔,37 ℃恒温孵育箱中湿育45 min;继清洗反应板4次后,在反应孔内加入肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1、IL-6溶液100 μl/孔,置于37 ℃恒温孵育箱中湿育45 min后在反应孔内加入终止液100 μl/孔终止反应,在测定450 nm波长吸光度值,依据反应颜色深浅与待测指标水平成正比,计算TNF-α、IL-1、IL-6水平。
1.3.3软骨组织骨代谢标志物阳性表达检测 利用免疫组化法测定MMP-13、Col Ⅱ阳性表达,将石蜡切片脱水、PBS漂洗、3%过氧化氢与甲醇混合液浸泡10 min,超纯水漂洗、抗原、修复、PBS漂洗后,加入一抗,常温孵育2 h,PBS漂洗5 min,加入二抗,常温孵育40 min,PBS漂洗5 min,DAB室温显色20~30 min,清洗、封片,光镜下观察细胞中基质金属蛋白酶(metalloproteinase-13,MMP-13)、Ⅱ型胶原(collagen Ⅱ,Col Ⅱ)阳性表达细胞。根据显色程度由浅至深记为0、1、2、3分,以细胞核着色记为阳性。每张片子以400×观察,统计10个视野阳性细胞数目,计算阳性细胞率。阳性细胞率=阳性细胞数目/总细胞数×100%。
1.3.4RT-PCR检测软骨组织miR-138表达 microRNA提取分离试剂盒分离miR-138细胞总RNA,采用TaqMan microRNA反转录试剂盒进行microRNA逆转录,采用SYBR Premix ExTaq II kit进行定量PCR反应,采用2-ΔΔCt方法计算,内参为U6。设置反转录反应条件:25 ℃、10 min,40 ℃、60 min,85 ℃、5 min;设置扩增条件:94 ℃、20 s,72 ℃、30 s,60 ℃、30 s,35个循环,采用2-ΔΔCt方法计算出需要检测的miR-138表达量。
1.3.5Western blot检测法对各组大鼠TrkA、TRPV1表达 取大鼠待测软骨组织按1 ∶5加入裂解液裂解、匀浆、提取总蛋白,经电泳、转膜后,5%脱脂牛奶封闭2 h,加入一抗(1 ∶300),孵育过夜。加入二抗(1 ∶5 000),常温孵育2 h,显影、定影、冲洗、晾干,扫描胶片,采用Image J软件分析TrkA、TRPV1表达,以β-actin为内参,目标蛋白水平=目标条带灰度值/β-actin条带灰度值。
1.4 统计学处理使用SPSS 19.0软件处理数据,计量资料经levene法检测具备方差齐性,shapiro-wilk检验符合正态分布,计量资料使用进行描述,组间行独立样本t检验;计数资料以%表示,组间比较进行χ2检验,P<0.05为有统计学差异。
2 结果
2.1 治疗后各组大鼠右后膝关节软骨切片HE染色图正常组:软骨细胞大小均一,排列整齐;模型组、沉默组:软骨细胞增生,软管表面细胞受损严重,表层软骨细胞稀少;过表达组:软骨细胞基本呈正常状态,表层软骨细胞增多。见图1。
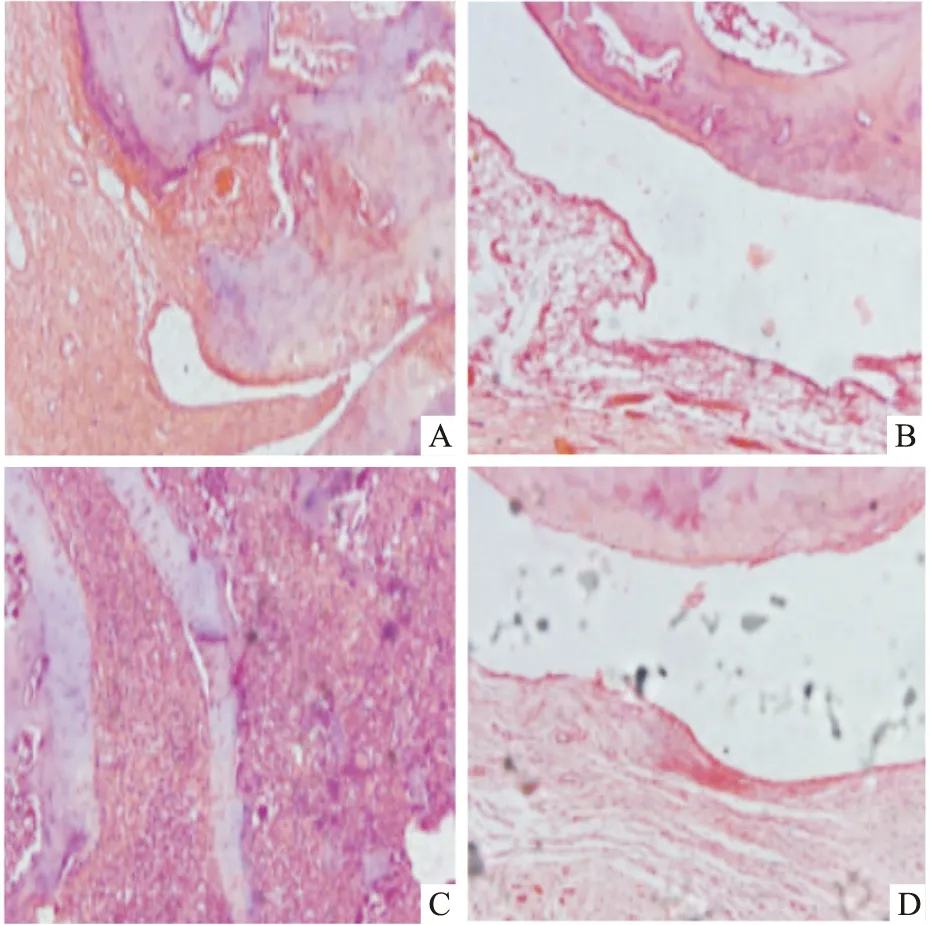
图1 治疗后各组大鼠右后膝关节软骨切片HE染色图 ×400A:正常组;B:模型组;C:沉默组;D:过表达组
2.2 各组大鼠行为学、软骨组织学评估比较与正常组相比,模型组、沉默组、过表达组大鼠行为学、软骨组织学评分升高(P<0.05);与过表达组相比,模型组、沉默组大鼠行为学、软骨组织学评分升高(P<0.05)。见表1。
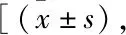
表1 各组大鼠行为学、软骨组织学评估比较分,n=10]
2.3 各组大鼠关节液中炎性因子水平比较与正常组相比,模型组、沉默组、过表达组大鼠TNF-α、IL-1、IL-6水平升高(P<0.05);与过表达组相比,模型组、沉默组大鼠TNF-α、IL-1、IL-6水平升高(P<0.05)。见表2。
表2 各组大鼠关节液中炎性因子水平比较
2.4 各组大鼠软骨组织骨代谢标志物阳性表达比较与正常组相比,模型组、沉默组、过表达组大鼠MMP-13表达升高,Col Ⅱ表达降低(P<0.05);与过表达组相比,模型组、沉默组大鼠MMP-13表达升高,Col Ⅱ表达降低(P<0.05)。见表3。
表3 各组大鼠软骨组织骨代谢标志物阳性表达比较
2.5 各组大鼠软骨组织中TrkA、TRPV1、miR-138表达比较与正常组相比,模型组、沉默组、过表达组大鼠TrkA、TRPV1表达升高,miR-138表达降低(P<0.05);与过表达组相比,模型组、沉默组大鼠TrkA、TRPV1表达升高,miR-138表达降低(P<0.05)。见表4、图2。

图2 各组大鼠软骨组织中TrkA、TRPV1 Western blot图A:正常组;B:模型组;C:沉默组;D:过表达组
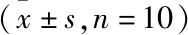
表4 各组大鼠软骨组织中TrkA、TRPV1、miR-138表达比较
3 讨论
关节软骨作为一种特殊的结缔组织,其软骨细胞转化率较低。因此,软骨损伤后自我修复能力较差。同时,软骨细胞更新及代谢过程极为复杂,由多种细胞因子参与完成。研究[7]表明,软骨细胞凋亡、细胞外基质降解是导致KOA软骨降低的主要因素。
既往研究[8]表明,炎性因子变化通过调节、刺激各种酶活性对关节软骨代谢造成直接影响。徐英杰 等[9]研究显示,TNF-α、IL-1、IL-6在KOA患者关节液中呈异常高表达,通过对局部的刺激,造成关节软骨退变加重。其中,TNF-α可参与免疫应答、介导炎症反应等,在KOA模型大鼠关节液中呈异常高表达;而IL-6具有多种生物学活性,可增强TNF-α、IL-1效应,诱导合成多种急性时相反应蛋白。相关研究[10]证实,KOA动物模型关节液中可检测到TNF-α、IL-1、IL-6,且含量明显高于正常组,在通过干预后,TNF-α、IL-1、IL-6含量降低,提示通过下调关节液中炎性因子可达到治疗KOA疗效。本研究结果显示,对KOA大鼠给予过表达miR-138干预后,软组织病理损伤减轻,关节液内TNF-α、IL-1、IL-6水平降低,提示基于TrkA-TRPV1信号通路调控miR-138可改善KOA病理组织形态学,抑制关节炎性反应蔓延,证实miR-138对机体炎性反应具有良好的抑制作用。此研究结果为预防、治疗KOA软骨损伤提供重要参考依据。
MMPs作为软骨基质内机制降解的主要蛋白酶,其中MMP-13作为降解基质内Col Ⅱ的主要胶原酶亚型,在骨性关节炎疾病的整个过程中发挥重要作用[11]。相关研究[12]证实,Col Ⅱ合成减少及降解加速与KOA发生发展呈正相关,且MMP-13通过裂解Col Ⅱ蛋白促进软骨基质的降解,造成软骨发生破坏和缺损。故通过检测MPP-13、Col Ⅱ水平为软骨退化情况评估提供重要参考。本研究结果显示,基于TrkA-TRPV1信号通路对KOA大鼠进行过表达miR-138干预,大鼠软骨组织内MPP-13表达降低、Col Ⅱ表达升高;表明过表达miR-138可抑制MPP-1合成增加,促进Col Ⅱ生产,减少软骨细胞凋亡,缓解/减轻软骨损伤;由此提示调控miR-138对改善细胞外基质降解、延缓关节软骨退变具有重要意义。
相关研究指出,TrkA-TRPV1信号通路作为疼痛信号传递的关键通路,其信号阻断对KOA疼痛抑制具有重要意义[13]。TrkA作为神经生长因子(NGF)的特异性受体可激活PI3K等降低TRPV1开放阈值,上调TRPV1表达产生反馈作用,是炎性因子释放而降低痛阈;而TRPV1作为KOA治疗的潜在靶点,TRPV1拮抗剂炎性关节疼痛缓解具有重要作用,但目前未见TrkA-TRPV1信号通路对miR-138调控的影响[14]。樊萍 等[15]研究指出,miR-138在参与KOA发生发展的同时与机体炎症存在密切相关,TrkA-TRPV1信号通路与KOA大鼠炎症反应密切相关,由此推测miR-138与TrkA-TRPV1信号通路间可能密切关联。本研究结果显示,通过对KOA大鼠给予过表达miR-138干预,TrkA、TRPV1表达降低,miR-138表达升高,提示上调miR-138对减轻软骨损伤具有独特意义,分析其原因或与抑制软骨组织中TrkA-TRPV1信号通路激活相关。
