改良透明质酸水凝胶控释脑源性神经营养因子对大鼠胚胎神经干细胞生长、分化和凋亡的影响
2022-06-06张香路阮铭暄
王 震,张香路,李 阳,阮铭暄,黄 斐
目前脊髓损伤的治疗仍然面临着很大的挑战,主要原因是脊髓损伤内部的神经干细胞分化效率低[1],神经生长因子的缺乏以及损伤部位产生炎症的微环境[2-3]。组织工程技术将神经干细胞支架与药物或生长因子结合来克服这些问题。透明质酸(hyaluronic acid, HA)因具有非免疫原性,良好的生物相容性[4],而广泛用作脊髓损伤修复的生物材料。但HA降解速度过快,不支持细胞黏附[5-6],因此需对HA进行改良,用己二酸二酰肼(adipic dihydrazide,ADH)对HA修饰,然后与葡聚糖(dextran,Dex)接枝。脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)是脊髓损伤实验中最常用的生长因子,它可以促进神经干细胞的增殖,神经轴突的生长,并诱导神经干细胞分化为神经元[7],然而,BDNF半衰期短,很难保持长期的活性[8]。聚乳酸乙醇酸[poly(lactic-co-glycolic acid), PLGA]作为受控细胞因子的释放载体,能有效维持细胞因子的活性,延长其作用时间[9]。该研究制备了改良HA水凝胶控释BDNF的微环境,首先,将BNDF包覆在PLGA微球中制备BDNF-PLGA微球,然后用改良的HA与微球进行混合,形成BDNF-PLGA/Dex-HA微环境,最后探讨大鼠胚胎神经干细胞(rat fetal neural stem cells, rFNSCs)与BDNF-PLGA/Dex-HA微环境共培养对rFNSCs的生长、分化及凋亡的影响。
1 材料与方法
1.1 实验动物及分组孕14 d的Sprague-Dawley(SD)大鼠3只,清洁级,300~320 g,由安徽医科大学实验动物中心提供。实验以大鼠胚胎干细胞为研究对象,将实验分为3组:空白对照组为rFNSCs与PLGA和HA共培养;条件对照组为rFNSCs与BDNF-PLGA和HA共培养;实验组为rFNSCs与BDNF-PLGA和改良的透明质酸水凝胶即Dex-HA共培养。
1.2 主要试剂及仪器HA钠盐(分子量:1.5~2.0 Mu,化妆品级,≥99.5%)购自山东福瑞达生物科技有限公司;除非另有说明,实验中使用的BDNF和高碘酸钠(NaIO4,≥99%)和氯化铁六水合物(FeCl3·6H2O,≥98%)均购自美国Sigma-Aldrich公司。DMEM/F12培养基、B27和胎牛血清(美国Gibco公司);表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,b-FGF)(美国Pepro-Tech公司);巢蛋白(Nestin)多克隆抗体、羊抗兔 Alexa fluor 488(英国Abcam公司);βⅢ微管蛋白(βⅢ-tubulin)单克隆抗体、星形胶质细胞特异性蛋白(GFAP)多克隆抗体和少突胶质细胞特异性蛋白(CNPase)单克隆抗体(美国Chemicon公司);驴抗兔Alexa fluor 594(美国Sigma-Aldric公司);大鼠ELISA试剂盒(北京索莱宝科技有限公司);细胞活力检测试剂盒(CCK-8)(日本同仁化学研究所);酶标仪(美国Thermofisher公司);倒置荧光显微镜、BX-51免疫荧光显微镜(日本Olympus Corporation公司)。
1.3 BDNF-PLGA微球的合成将200 mg PLGA(75/25,分子量:4~15 ku)溶解在2 ml的二氯甲烷中,10 μg的BDNF溶于1 ml牛血清白蛋白,将两种溶液混合。然后,将10 ml聚乙烯醇(PVA,1%)缓慢加入到混合物中超声混匀,加入80 ml PVA(0.3%),搅拌12 h以去除二氯甲烷。最终的乳状液用蒸馏水洗涤,离心,冷冻干燥,得到负载BDNF的PLGA微球。
1.4 氧化葡聚糖(ODex)的产生和HA-ADH的合成ODex的产生:将1 g Dex溶于20 ml蒸馏水中,加入2 ml NaIO4(100 mg/ml),于室温避光搅拌反应12 h。然后加入乙二醇终止反应。将所得溶液用纤维素管(截留分子量为7~12 ku)在去离子水中透析3 d,之后冷冻干燥处理。
HA-ADH的合成:将100 mg HA溶解于25 ml蒸馏水中,再加入8倍量的ADH,磁力搅拌4 h。将100 mg EDC和132 mg HoBt溶解在2 ml的50%DMSO溶液中,形成羧基活性基团,后用酰肼基团对HA进行修饰,调节HA-NHNH2溶液的pH至6.8持续反应4 h,将pH调至7.0完成反应。最后在100 mmol/L NaCl、25%EtOH/H2O和去离子水中透析3 d,-50 ℃条件下冷冻干燥,获得冻干的HA-ADH粉。
1.5 构建BDNF-PLGA/Dex-HA及BDNF-PLGA/HA水凝胶将20 mg BDNF-PLGA微球加入1 ml 2%HA-ADH和0.5 ml 6%ODex混合溶液中,轻轻搅拌混合物,以24孔板作为圆柱形模具,制成BDNF-PLGA/Dex-HA水凝胶微环境。同样的办法构建BDNF-PLGA/HA水凝胶。
1.6 rFNSCs的分离、培养及鉴定rFNSCs的分离:将Sprague-Dawley(SD)大鼠用10%水合氯醛麻醉后,无菌条件下取出大鼠大脑皮质放入预冷的DMEM/F12培养液中,用剪刀将组织块剪成1 mm3大小,收集于离心管中,D-Hank’s液清洗2次。然后加入0.25%的trypsin-EDTA和DNAase 100 μl于37 ℃下消化10 min,加入胎牛血清终止消化,并用吸管反复吹打,然后通过200目滤网制成单细胞悬液,将悬液在1 000 r/min离心5 min,获得rFNSCs后进行原代及继代培养。
rFNSCs培养:将分离的rFNSCs接种在低吸附培养皿上,加入含有2% B27、 20 ng/ml EGF和b-FGF的DMEM/F12培养液重悬,置于37 ℃、5%CO2细胞培养箱中培养7 d以上,传代3~4次后,用于进一步实验。
rFNSCs鉴定:将神经球放置在涂有0.1%多聚赖氨酸和Nestin(神经干细胞的标志物)的玻片上,用免疫细胞化学染色方法进行rFNSCs的鉴定。体外分化时,加入DMEM/F12与2% B27的分化培养基分化3 d,免疫细胞化学鉴定神经元。
1.7 水凝胶中BDNF的释放用ELISA法测定BDNF的释放量。将rFNSCs接种于BDNF-PLGA/Dex-HA水凝胶支架中作为实验组,将100 ml BDNF-PLGA/Dex-HA水凝胶加入到10 ml无菌PBS中,按照ELISA试剂盒说明进行检测。在每个设定的时间点(1~14 d)每天收集样本的上清液,计算累积释放率。将rFNSCs接种于BDNF-PLGA/HA水凝胶支架中作为条件对照组,并在相同时间点检测BDNF浓度。所有实验均重复3次,取每个时间点上的3个数值求平均值。
1.8 细胞增殖实验将三组的水凝胶放在超净工作台中,紫外灭菌过夜。取96孔板,分别加入空白对照组、条件对照组和实验组的水凝胶50 μl至96孔板中,将rFNSCs细胞按1×105个/ml的密度接种于96孔板中。在37 ℃、5%CO2培养箱中培养1、3、7 d后,将CCK-8试剂按照10 μl/孔加入到培养板中并在37 ℃、5%CO2条件下孵育4 h。酶标仪测量孔板中的溶液在450 nm处的吸光度(A)值。
1.9 Live/Dead实验采用Live/Dead实验检测不同水凝胶中rFNSCs的活力。首先将每组的凝胶样品分别放置于培养板底部,然后将1×103个rFNSCs种植于凝胶上,在37 ℃、5%CO2条件下培养72 h,用2 μmol/L Calcein-AM和4 μmol/L EthD-1于黑暗环境中常温下染色30 min,然后PBS洗涤2次,在共聚焦显微镜下观察各组凝胶接触的细胞生长情况。活细胞呈现绿色,死细胞呈现红色。
1.10 水凝胶对神经干细胞分化潜能的影响为探讨rFNSCs在三组水凝胶中的分化程度,将在三组水凝胶中培养7 d的rFNSCs用4%甲醛室温固定30 min,再用含0.1%Triton X-100的PBS中渗透15 min,在含1%BSA室温封闭2 h。加入一抗rFNSCs标志物Nestin抗体(1 ∶250)、神经元标志物βⅢ-tubulin抗体(1 ∶100)、神经胶质细胞标志物GFAP抗体(1 ∶400)、少突胶质细胞标志物CNPase(1 ∶200),于4 ℃孵育过夜。样品用PBS洗涤3次后,分别用二抗山羊抗鼠IgG偶联Alexa-Fluor488(1 ∶500)和驴抗兔IgG(1 ∶800)偶联Alexa-Fluor594(1 ∶500)二抗室温避光孵育2 h后,用DAPI染色细胞核后,用共聚焦显微镜采集图像。
2 结果
2.1 水凝胶中BDNF的释放水凝胶中BDNF的释放如图1所示,实验组改良的水凝胶与条件对照组水凝胶有相似的14 d控释和持续释放的特性,这两种水凝胶的BDNF释放曲线可分为三个阶段。实验组水凝胶中的BDNF释放曲线在前6 d呈线性缓释,释放率达到20.07%。第7~12天,样品的释放速率均匀增加,第12天样品中BDNF的累积释放率达到86.97%。在第13天与第14天,BDNF的积累释放速率平均为88.52%和88.57%,趋于平稳。至于条件对照组水凝胶,BDNF在前4 d相对稳定,第5~11天,BDNF的释放率增加,第11天BDNF的释放率达到85.31%,第12~14天,BDNF的积累释放量达到平衡。
2.2 rFNSCs的鉴定在图2A中,大多数分离的细胞主要以神经球的形式生长,其形态符合rFNSCs鉴定的金标准。免疫细胞化学结果显示神经球对Nestin呈阳性反应(图2B),因此悬浮神经球可以认为是rFNSCs。
2.3 rFNSCs与水凝胶共培养将rFNSCs按1×105/ml接种入三组的水凝胶上共培养。如图3,培养3 d后在扫描电镜下观察rFNSCs的微观形态,可见实验组水凝胶中rFNSCs相对于空白对照组和条件对照组中rFNSCs增殖较多,且rFNSCs在水凝胶中细胞维持了良好的形态,提示rFNSCs与水凝胶具有良好的相容性。
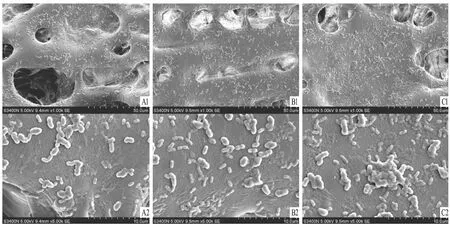
图3 rFNSCs在不同环境中的培养 A:rFNSCs与空白对照组水凝胶培养3 d;B:rFNSCs与条件对照组水凝胶共培养3 d;C:rFNSCs与实验组水凝胶共培养3 d;1:×200;2:×1 000
2.4 细胞增殖实验为了评价改良的HA水凝胶形成微环境能否支持rFNSC的生长,在实验的第1、3、7天用CCK-8检测细胞增殖活性。结果如图4所示,在相同的培养时间条件下, 实验组第3天的细胞增殖活性高于空白对照组(F=4.282,P<0.05),第7天时, 实验组细胞增殖活性高于空白对照组和条件对照组(F=15.240,P<0.05),且条件对照组也高于空白对照组(P<0.05),表明实验组改良的HA水凝胶对rFNSC细胞增殖具有促进作用。
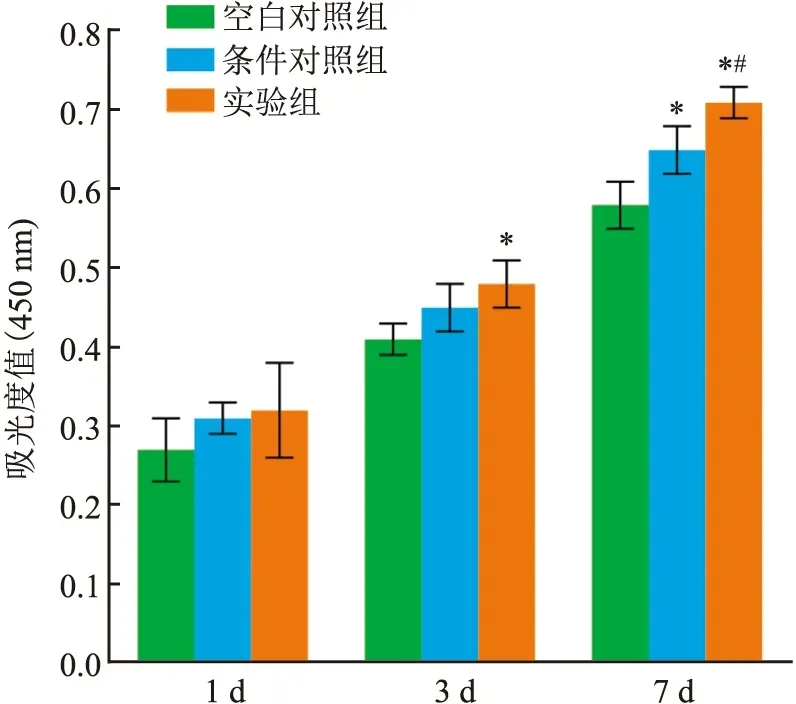
图4 CCK-8法检测不同培养组中rFNSCs的增殖活性与空白对照组比较:*P<0.05;与条件对照组比较:#P<0.05
2.5 细胞活力分析不同组的细胞活性在第3天用Live/Dead实验进行评估,其中活细胞染成绿色,死细胞染成红色。共聚焦结果显示,与空白对照组相比,条件对照组与实验组的细胞凋亡数目明显降低,且实验组死亡数目最少(图5C)。由此可见,实验组水凝胶可以降低rFNSCs的凋亡。

图5 不同培养环境中rFNSCs细胞的活/死荧光染色 ×200A:rFNSCs与空白对照组水凝胶培养3 d;B:rFNSCs与条件对照组水凝胶共培养3 d;C:rFNSCs与实验组水凝胶共培养3 d
2.6 rFNSCs在水凝胶中的的分化情况通过免疫组织化学研究制备改良HA水凝胶控释BDNF对rFNSCs分化的影响,并统计其中各种细胞所占比例。其中,神经元、少突胶质细胞和星形胶质细胞类型细胞数目分别通过神经元特异性蛋白βⅢ-tubulin、少突胶质细胞特异性蛋白CNPase和星形胶质细胞特异性胶质纤维酸性蛋白GFAP的阳性表达数目来评估。与空白对照组及条件对照组相比,实验组βⅢ-tubulin阳性率升高(F=30.418,P<0.05)、GFAP阳性率降低(F=28.381,P<0.05),且条件对照组较空白对照组GFAP阳性率降低(P<0.05)。三组CNPase阳性率变化差异无统计学意义见图6、7。由此可见,实验组改良HA水凝胶控释BDNF可以提高rFNSCs向神经元的分化,降低向星形胶质细胞分化,对于向少突胶质细胞的分化效果无明显差异。
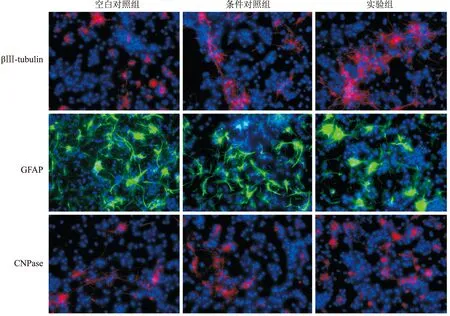
图6 不同环境中rFNSCs分化的共聚焦显微镜图像 ×400
3 讨论
由于脊髓损伤区域周围不利的微环境,空洞和纤维胶质瘢痕的形成,神经系统中分化成熟神经元自我修复能力的缺乏,以及缺乏合适的生长刺激因子,导致脊髓损伤的有效治疗非常有限[10]。目前,针对脊髓损伤后功能恢复的方法有干细胞移植、生物材料及神经营养因子的植入,但研究[11]表明,单纯的干细胞、单纯的生物材料及单纯的神经营养因子移植并不能使脊髓损伤后神经元恢复,但是由于干细胞具有多向分化潜能[12],组织工程支架可以为其提供支持,神经营养因子则可以促进干细胞的分化,因此三者联合起来移植便成为了研究的热点。
相关研究[13]表明HA经过化学修饰及与Dex接枝可以降低HA的降解速度,提高其机械性能及增强神经细胞的黏附性能,为细胞提供了适宜细胞黏附及生长的微环境。
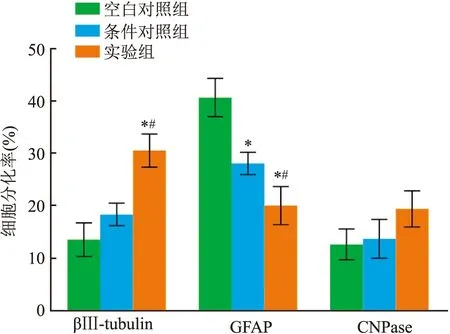
图7 不同组中rFNSCs分化的百分比与空白对照组比较:*P<0.05;与条件对照组比较: #P<0.05
神经营养因子可以提高神经元的存活率,促进轴突再生。BDNF是脊髓损伤实验中最常用的神经营养因子。研究[14]表明,外源性的BDNF可以促进损伤部位轴突的再生,髓鞘的形成,以及诱导损伤部位神经干细胞的增殖。PLGA作为受控的细胞因子释放载体,能有效维持细胞因子的活性。本研究中将改良的HA(Dex-HA)与控释BDNF的微球结合,BDNF在水凝胶释放结果显示实验组的累计释放率在开始阶段和中期阶段略低于条件对照组的,这是由于从PLGA微球中释放BDNF后,BDNF从水凝胶基质中向外释放。由于实验组的Dex-HA相对于条件对照组的HA更稳定,不易被水解,所以实验组相对于条件对照组在前中期累计释放率低,后期累计释放率高。且实验组中BDNF的释放,在前中期阶段快速释放,在后期的阶段缓慢释放,可以有效保护细胞因子的生物活性,这种释放方式为神经干细胞的生长和分化形成局部有效浓度。将rFNSCs接种到三组水凝胶共培养3 d后在扫描电镜下观察rFNSCs的微观形态,可见实验中rFNSCs相对于空白对照组和条件对照组中rFNSCs增殖较多,主要原因是实验组水凝胶相对稳定且利于细胞黏附,可以给rFNSCs提供一个良好的生长微环境。同时可以看到rFNSCs在水凝胶中细胞维持了良好的形态,与水凝胶具有良好的相容性。在CCK-8细胞增殖实验中,实验组相对于空白对照组与条件对照组吸光度增加(P<0.05),表明本研究所制备的BDNF-PLGA/Dex-HA中rFNSCs的活性要高于在BDNF/HA水凝胶和BDNF-PLGA/HA水凝胶中的。Live/Dead实验表明实验组相对于空白对照组及条件对照组可以减少rFNSCs凋亡,提高其活力,主要原因是Dex-HA相对于HA的降解速度减缓了,机械性能及对神经细胞的黏附性能增加了,为rFNSCs提供了稳定的适宜生长的微环境。在免疫细胞化学染色实验中,实验组相对于空白对照组和条件对照组能提高rFNSCs分化成神经元的比例,减少rFNSCs分化成星形胶质细胞的比例。
综上所述,改良的HA水凝胶的多孔结构为rFNSCs的生长、增殖及细胞黏附提供了良好的三维微环境,且其控释BDNF可以促进rFNSCs向神经元的分化,减少了向星形胶质细胞的分化,解决了脊髓损伤区域神经元缺乏及胶质瘢痕形成的问题。该研究为后期相关动物实验研究奠定了良好的基础。
