褪黑素减轻高糖诱导的人脐静脉内皮细胞损伤的机制
2022-06-06刘婉卿但章勇朱华庆
刘婉卿,但章勇,周 青,汪 渊,王 怡,朱华庆
褪黑素(melatonin, MLT)是一种主要由人和哺乳动物松果体合成分泌的一种吲哚类激素,其化学名是N-乙酰基-5-甲氧基色胺,又称为松果体素[1]。在体内,MLT发挥着抗炎抗氧化、清除自由基、抗细胞凋亡等生物学功能[2-3]。血管内皮由一层薄薄的扁平细胞所组成,它形成血管的内壁,是血管管腔内血液及其他血管壁(单层鳞状上皮)的接口。血管内皮细胞的损伤与多种心血管疾病的发生发展有着密切的关系,如高血压、动脉粥样硬化、心力衰竭等[4]。糖尿病常并发大血管或微血管病变,导致糖尿病心肌病、糖尿病肾病、视网膜并发症等,这些病理过程常与血管内皮损伤紧密相关[5]。在本实验中,用高糖环境模拟人体糖尿病条件,探究人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)在MLT干预下损伤与修复的潜在机制。
1 材料与方法
1.1 实验材料
1.1.1实验试剂 MLT(南京都莱生物技术有限公司);DMEM低糖培养基和胎牛血清(以色列Biological Industries公司);噻唑蓝(MTT)和二甲基亚砜(美国Sigma公司);Hoechst 33342/碘化丙啶(propidium iodide,PI)双染试剂盒(上海贝博生物科技有限公司);葡萄糖(上海国药集团化学试剂有限公司);胰酶、青链霉素、蛋白酶抑制剂、RIPA裂解液、活性氧检测试剂盒(上海碧云天生物技术公司);乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(南京建成生物工程研究所);anti-GRP78、anti-ATF4、anti-CHOP、anti-IRE1α、anti-PERK、anti-ATF6α、anti-NLRP3、anti-cleaved caspase-1、anti-IL-1β抗体(美国CST公司);anti- GAPDH、山羊抗兔IgG-HRP、山羊抗小鼠IgG-HRP抗体(美国Santa Cruz公司)。
1.1.2实验仪器 ZHJH-C1112C型超净工作台(上海智城分析仪器制造有限公司);HERA CELL VIOS 160 i型恒温细胞培养箱、酶标仪、高速低温离心机(美国Thermo Fisher Scientific公司);-80 ℃超低温冰箱(日本SANYO电器股份有限公司);电泳仪及电泳槽(北京六一仪器厂);全自动数码凝胶成像系统(上海欧翔公司);TDZ4-WS低速自动平衡离心机(长沙湘仪离心机仪器有限公司);磁力搅拌器(北京中兴伟业仪器有限公司);电热恒温干燥箱(上海跃进医疗器械厂);pH仪(上海雷磁仪器厂);CytoFLEX流式细胞仪(美国BECKMAN COULTER公司)。
1.2 实验方法
1.2.1HUVEC细胞培养 HUVEC细胞购自于美国ATCC细胞库,传代至第三代,培养于含10%胎牛血清、1%青链霉素的DMEM培养基中,置于37 ℃、5% CO2培养箱中培养,每隔24 h换液,待细胞融合至80%左右时传代,并取对数生长期细胞进行相关实验。
1.2.2MTT实验 取对数生长期的HUVEC细胞,经胰酶消化后,用含有10%胎牛血清的完全培养基重悬,以200 μl/孔(2×103个细胞)接种于96孔板中,分为10组:对照组、溶剂对照组、模型组、治疗组(MLT浓度分别为10、20、40、60、80、100、160 μmol/L),置于37 ℃、5% CO2培养箱中培养,待细胞贴壁后,弃去原培养上清液,PBS洗涤3次后分别给予正常完全培养基(葡萄糖浓度为5.5 mmol/L)、含与治疗组等量的二甲基亚砜的正常完全培养基、高糖完全培养基(葡萄糖浓度为30 mmol/L)、含相应浓度的MLT的高糖完全培养基处理。作用48 h后每孔加入20 μl(5 mg/ml)的MTT,继续在培养箱中孵育4 h,弃去培养上清液,每孔加入150 μl 二甲基亚砜,振荡溶解后用酶标仪检测490 nm波长处各孔的吸光度(A490)值。
1.2.3LDH释放量检测 将HUVEC细胞分为3组:对照组、模型组和治疗组。细胞均匀接种于培养皿中,待细胞贴壁后,对照组用5.5 mmol/L葡萄糖浓度的普通培养基进行培养,模型组用30 mmol/L葡萄糖浓度的高糖培养基进行培养,治疗组用含有100 mmol/L MLT的30 mmol/L葡萄糖浓度的高糖培养基进行培养。处理48 h后收集各组细胞培养上清液,按照试剂盒说明书检测细胞培养上清液中LDH的释放量。
1.2.4细胞内活性氧(reactive oxygen species,ROS)水平检测 将细胞种于6孔板中,同1.2.3项处理 48 h后收集各组处理后的细胞,并用无血清培养基以1 ∶1 000稀释DCFH-DA。以每孔800 μl的体积重悬细胞,置于37 ℃培养箱中孵育20 min,每隔5 min颠倒混匀1次,使探针和细胞充分接触。用无血清培养基洗涤3次,流式细胞仪检测。
1.2.5Hoechst 33342/PI双染 将细胞种于玻底培养皿中,同1.2.3项处理48 h后弃去培养上清液,用PBS洗涤2次。取100 μl试剂C加900 μl无菌纯水稀释,混匀即成1×染色缓冲液工作液,每皿加入1 ml工作液,再加入10 μl Hoechst 33342染色液A,轻轻混匀后4 ℃避光孵育10 min。在每皿加入10 μl PI染色液B,轻轻混匀后4 ℃避光孵育10 min。PBS洗涤细胞后用共聚焦显微镜检测结果。
1.2.6Western blot实验 取对数生长期的HUVEC细胞消化后以相同的量接种于100 mm直径的细胞培养皿,置于培养箱中培养,待完全贴壁后弃去培养液,用PBS洗3次,同1.2.3项处理48 h,弃去培养基,用PBS洗3次,每皿加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液于冰上充分裂解细胞,14 000 r/min 4 ℃离心20 min。吸取上清液,根据BCA法测定的蛋白浓度,以4 ∶1的比例加入相应体积的总蛋白和5×蛋白上样缓冲液,振荡混匀后在100 ℃水浴中煮沸15 min使蛋白完全变性,冷却后置于-80 ℃冰箱中保存。电泳时每泳道加入20 μg的蛋白样品进行SDS-PAGE凝胶电泳,电泳完成后将蛋白转移至PVDF膜。5%脱脂牛奶室温封闭2 h。TBST洗涤3次,TBS洗涤1次,每次5 min,分别孵anti-GRP78、anti-ATF4、anti-CHOP、anti-IRE1α、anti-PERK、anti-ATF6α、anti-NLRP3、anti-cleaved caspase-1、anti-IL-1β、anti-GAPDH一抗(1 ∶1 000),置于4 ℃冰箱摇床孵育过夜。TBST洗涤3次,TBS洗涤1次,每次5 min。孵二抗羊抗兔(1 ∶5 000)、羊抗鼠(1 ∶3 000),室温摇床孵育2 h,TBST洗涤3次,TBS洗涤1次,每次5 min,加ECL显影液显影。以GAPDH作为内参,用Quantity One软件分析结果,蛋白表达水平以目的蛋白/GAPDH的平均灰度值比值表示。
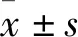
2 结果
2.1 MLT对高糖刺激下的HUVEC细胞增殖的影响MTT结果显示,与对照组相比,模型组HUVEC增殖水平下降,差异有统计学意义(F=2.484;P<0.001)。与模型组相比,治疗组HUVEC的增殖水平升高,并且在MLT浓度为 100 μmol/L时细胞增殖水平最高,差异有统计学意义(F=0.328;P<0.001)。故后续实验中均采用100 μmol/L作为治疗组MLT浓度。溶剂对照组与对照组之间无统计学差异。见表1、图1。

图1 高糖及MLT干预48 h后细胞培养图片 ×200A:对照组;B:模型组;C:治疗组

表1 不同浓度MLT对高糖刺激的HUVEC增殖的影响
2.2 MLT对高糖刺激的HUVEC细胞培养上清液中LDH释放量的影响根据测量所得结果显示,与对照组相比,模型组培养上清液中LDH释放量增加,差异有统计学意义(F=2.785,P<0.05);与模型组相比,在MLT干预下,治疗组培养上清液中LDH释放量减少,差异有统计学意义(F=2.144,P<0.05)。见图2。

图2 MLT对高糖刺激的HUVEC细胞培养上清液中LDH释放量的影响(n=3)1:对照组;2:模型组;3:治疗组;与对照组比较:*P<0.05;与模型组比较:#P<0.05
2.3 MLT对高糖刺激的HUVEC细胞中ROS生成的影响流式细胞术结果显示,与对照组相比,模型组HUVEC细胞中ROS水平升高,差异有统计学意义(P<0.01);与模型组相比,治疗组HUVEC细胞中ROS水平下降,差异有统计学意义(P<0.01)。见图3。

图3 MLT对高糖刺激的HUVEC细胞中ROS生成的影响(n=3)1:对照组;2:模型组;3:治疗组;与对照组比较:*P<0.01;与模型组比较:#P<0.01
2.4 MLT对高糖刺激的HUVEC细胞中Hoechst 33342/PI染色变化的影响共聚焦显微镜拍摄结果显示,与对照组相比,模型组HUVEC细胞中蓝色荧光和红色荧光增加;与模型组相比,治疗组HUVEC细胞中蓝色荧光和红色荧光减少。见图4。

图4 MLT对高糖刺激的HUVEC细胞中Hoechst 33342/PI染色变化的影响 ×200
2.5 MLT对高糖刺激的HUVEC细胞中内质网应激相关蛋白GRP78、ATF4、CHOP、IRE1α、PERK、ATF6α表达的影响Western blot结果显示,与对照组相比,模型组HUVEC细胞中GRP78、ATF4、CHOP、IRE1α、PERK、ATF6α蛋白相对表达水平均有升高,差异有统计学意义(P<0.01);与模型组相比,治疗组HUVEC细胞中GRP78、ATF4、CHOP、IRE1α、PERK、ATF6α蛋白相对表达水平均有下降,差异有统计学意义(P<0.01)。见图5。
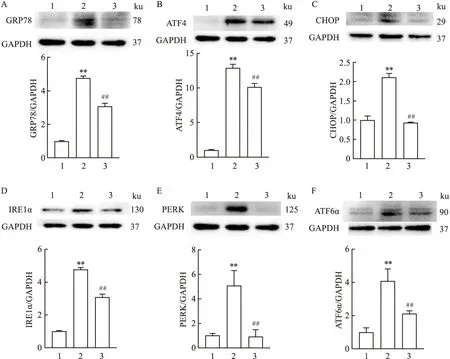
图5 MLT对高糖刺激的HUVEC细胞中GRP78、ATF4、CHOP、IRE1α、PERK、ATF6α蛋白表达的影响1:对照组;2:模型组;3:治疗组;与对照组比较:**P<0.01;与模型组比较:##P<0.01
2.6 MLT对高糖刺激的HUVEC细胞中焦亡相关蛋白NLRP3、cleaved caspase-1、IL-1β表达的影响Western blot结果显示,与对照组相比,模型组HUVEC细胞中NLRP3、cleaved caspase-1、IL-1β蛋白相对表达水平均有升高,差异有统计学意义(P<0.01);与模型组相比,治疗组HUVEC细胞中NLRP3、cleaved caspase-1、IL-1β蛋白相对表达水平均有下降,差异有统计学意义(P<0.01)。见图6。
图6 MLT对高糖刺激的HUVEC细胞中NLRP3、cleaved caspase-1、IL-1β蛋白表达的影响1:对照组;2:模型组;3:治疗组;与对照组比较:**P<0.01;与模型组比较:##P<0.01
3 讨论
高糖诱导的内皮细胞功能损伤一直是心血管疾病领域的研究热点。在糖尿病病程中,内皮细胞显著受损,内皮功能发生障碍。但在此过程中内皮细胞的损伤与修复机制一直尚未明确。本实验以HUVEC为例,以含高浓度葡萄糖的细胞培养基模拟体内糖尿病环境,MLT为干预药物,探究了高糖刺激导致内皮细胞损伤及MLT对其调控机制是否与细胞内质网应激和细胞焦亡有关。经上述实验证明,高糖诱导下内皮细胞的增殖水平下降,胞膜完整性被破坏,经MLT干预后内皮细胞增殖水平升高,胞膜完整性的破坏得到一定缓解。ROS是分子氧的活性中间体,当活性氧生成和抗氧化防御之间失去平衡时,内皮功能就会发生障碍,在代谢性和动脉粥样硬化疾病中导致血管损伤[6]。因此,可以通过检测细胞内ROS生成的变化来判断内皮损伤的程度。在本实验中,高糖刺激下的内皮细胞中ROS生成量增加,MLT干预后ROS生成量相对下降。上述实验表明MLT可以减少内皮细胞中ROS的产生,从而缓解高糖刺激对内皮功能的损伤。Hoechst 33342可以穿透细胞膜,染色后凋亡细胞蓝色荧光会比正常细胞增强。PI不能穿透细胞膜,对于坏死细胞,其细胞膜的完整性遭到破坏,PI可以进入坏死细胞对核染色,使细胞红色荧光增强。在本实验中,高糖刺激的内皮细胞中蓝色荧光和红色荧光增加,MLT干预后的内皮细胞中蓝色荧光和红色荧光减少,表明MLT在此过程中对细胞进行了一定的保护作用。
当机体发生低氧、错误折叠、突变蛋白积累或者处于高糖诱导时,细胞中内质网应激(endoplasmic reticulum stress,ERS)水平升高[7],将导致未折叠蛋白反应(unfolded protein reaction,UPR)。UPR的主要功能是恢复内质网的生理活性,调控细胞凋亡和其他适应性反应。有研究[8]表明,ERS是糖尿病、肥胖、脂肪肝、心血管疾病、动脉粥样硬化等代谢综合征发病的重要因素。内质网中的葡萄糖调节蛋白78(GRP78)能够促进蛋白质折叠和防止蛋白质聚集,是UPR信号的主启动子。非ERS 状态下,GRP78与蛋白激酶RNA样ER激酶(PERK)、肌醇酶1α(IRE1α)和转录激活因子6(ATF6)结合,以复合物的形式存在。当发生细胞损伤时,ERS 启动,GRP78 从复合物状态中解离并激活[9],通过PERK、ATF6、IRE1α 三条途径,激活下游的eIF2α、CHOP、ATF4等通路[9-10],加速蛋白质折叠和降解,重新建立ER稳态。
NLRP3炎症小体是一种多蛋白复合物,识别PAMPs或损伤相关分子模式(DAMP),并招募和激活炎症蛋白酶caspase-1[11]。在细胞焦亡过程中,活化的cleaved caspase-1将pro-IL-1β和pro-IL-18切割形成成熟形式IL-1β、IL-18,同时切割GSDMD的N端序列,在细胞膜上形成孔道,细胞膜完整性破坏,细胞内容物释放到细胞外,细胞崩解死亡。有研究[12]表明, UPR时IRE1α-XBP1轴的选择性激活可以刺激NLRP3的活化。同时有证据[13]表明内质网应激参与炎症小体诱导的炎症级联反应,它们之间的复杂相互作用是炎症疾病潜在的治疗靶点。
在既往的研究[14]中,MLT可以通过调控内质网应激PERK-eIF2α-ATF4-CHOP通路来抑制高糖诱导下的成骨细胞凋亡。另有研究[15]表明,MLT可以通过抑制链脲佐菌素诱导的糖尿病模型小鼠神经元细胞焦亡和自噬发挥神经保护作用。但在内皮细胞中,MLT是否可以通过相似的调控方式减轻高糖带来的内皮损伤还尚不明确。该研究中,高糖刺激的内皮细胞中GRP78、ATF4、CHOP、IRE1α、PERK、ATF6α蛋白表达水平提升,在MLT干预后呈现下降趋势,推测MLT的调控过程与ERS有关;同时高糖刺激的内皮细胞中NLRP3、cleaved caspase-1、IL-1β蛋白表达水平提升,MLT干预后同样出现下降趋势,推测MLT可能是通过抑制细胞焦亡对内皮细胞发挥保护作用。但在此过程中,这两种调控机制之间是否存在关联,以及关联的具体靶点还仍需进一步探索。
糖尿病心血管并发症是导致糖尿病病死率增加及影响糖尿病患者生活质量的重要因素。该研究结果表明,MLT可以减轻高糖诱导的内皮细胞损伤,其机制可能与调控内质网应激和细胞焦亡有关。该研究或许为糖尿病等代谢类疾病的治疗提供了新的思路,为后续相关实验提供了有力的佐证。
