Eya1基因过表达对MES23.5细胞凋亡的影响
2022-06-06秦登利
秦登利,高 锦
帕金森病(Parkinson′s disease, PD)是一种常见的神经系统退行性疾病[1]。PD发生的主要病理学特征为黑质致密部多巴胺能神经元变性死亡[2]。虽然目前临床上的药物可以暂时减缓PD的运动症状,但却不能阻止多巴胺能神经细胞的渐进性死亡[3]。眼发育缺失1(eye absent 1, Eya1)是Eya家族中的一员,是一种转录激活因子[4]。Eya家族成员主要由两个结构域构成,即氨基端和羧基端结构域[5]。研究显示Eya1不仅在发育中,在肿瘤及神经相关疾病中均发挥着重要的作用[6]。Eya1可修复大肠肿瘤细胞中断裂的DNA,进而拮抗细胞凋亡的作用[7]。在损伤早期的多巴胺能神经细胞中,Eya1通过转录因子Six2促进胶质细胞系神经营养因子的表达而保护损伤的细胞[8]。然而,Eya1保护受损多巴胺能神经细胞的具体机制尚未阐明。
该研究构建了携带Eya1基因的慢病毒表达质粒,筛选了稳定高表达Eya1的细胞株,并通过CCK-8、Hoechst 33258染色和Western blot方法检测过表达Eya1对细胞凋亡的影响。
1 材料与方法
1.1 材料
1.1.1主要试剂 大鼠DA能神经细胞系MES23.5细胞购自中国科学院细胞库(上海);HEK 293细胞购自美国ATCC公司;Lipofectamine 2000购自天津Invitrongen公司;ApaL I和Xho I等限制性内切酶购自美国NEB公司;Eya1 Polyclonal Antibody(货号:22658-1-AP、稀释比1 ∶500)、Bcl-2 Polyclonal Antibody(货号:12789-1-AP、稀释比1 ∶2 000)及Bax Polyclonal Antibody(货号:50599-2-lg、稀释比1 ∶5 000)均购自武汉三鹰Proteintech公司,细胞增殖及细胞毒性检测试剂盒(货号:KGA317)购自南京凯基公司;Hoechst 33258染色试剂盒(货号:C0003)购自上海碧云天公司;6-羟基多巴胺(6-hydroxydopamine,6-OHDA)药物(货号:HY-B1081A)购自上海MCE公司。
1.2 方法
1.2.1细胞培养 将MES23.5细胞和HEK 293细胞用含10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM培养基中,于37 ℃、5%CO2、95%湿度的培养箱内培养,当细胞培养生长到90%融合度左右时用0.25%胰蛋白酶消化传代,选择处于对数生长期良好的细胞用于实验。
1.2.2携带Eya1基因的载体的构建 利用NCBI数据库下载Eya1基因序列(Gene ID:NM_001 310 459.1),利用引物设计软件,设计一对Eya1基因特异性的PCR引物,正向引物为5′-GCCAACTTTGTACAAAAAAGCAGGCTGCCACCATGGAA ATGCAGGATCCTAAACCAGCC-3′,反向引物为5′-TACTTGTCGTCATCGTCTTTGTAGTCCAGGTACTCTA ATTCCAAGGCATG-3′,引物由上海生工有限公司合成。
PCR扩增目的基因Eya1,并使其两端带上Gibson(Gibson Assembly)反应重叠区域。在核酸外切酶、DNA聚合酶和DNA连接酶的共同作用下发生Gibson反应,将目的基因连接到入门载体,构建pDown-mEya1入门载体。将Gibson反应产物转化到感受态细胞DH5α后,将平板37 ℃倒置培养过夜,随后挑取菌落,PCR反应鉴定阳性克隆,DNA测序mEya1区域,确认序列正确的克隆。然后,将携带attL4-EFIA-attR1序列的pUp-EF1A、携带attL1-mEya1-attL2序列的pDown-mEya1和携带attR4-Chl-ccdB-attR2序列的慢病毒终载体pLV.Des2d.C/mCherry:T2A:Puro LR反应(reaction of an attL substrate with an attR substrate),EF1A启动子、mEya1/Flag按顺序正确插入到终载体上,经过转化挑菌、酶切鉴定得到正确的mEya1过表达慢病毒终载体(plv-mCherry:T2A:Puro-EF1A>mEya1/Flag),过表达的Eya1转录本:[NM_001 310 459.1]。
1.2.3携带Eya1基因的慢病毒颗粒的包装及病毒滴度测定 培养HEK 293细胞,待细胞汇合度达到80%~90%时,替换成无抗生素的完全培养基。加入质粒DNA混合物(15 μg转移载体和20 μg的包装混合物)和脂质体2 000。转染后48~72 h,收集病毒上清液,4 ℃、3 000 r/min离心15 min,用0.45 μm滤膜进一步过滤病毒上清液。将200 μl病毒浓缩液加入至离心管,上层加入1.5 ml的20%蔗糖溶液,平衡后12 000 r/min离心2 h。离心去上清液,收集沉淀病毒颗粒,每管沉淀用200 μl Hank′s平衡盐溶液重悬,测定病毒滴度。48~72 h后荧光显微镜下观察荧光表达情况。选取荧光率在1%~20%的孔进行滴度计算。
1.2.4筛选稳定表达Eya1基因的MES23.5细胞 取对数生长期的MES23.5细胞按照每孔5×104个细胞接种到6孔板内,待细胞生长到50%~60%融合度时感染病毒,分为对照组(未感染慢病毒的细胞)、空载体组(感染携带荧光蛋白但不携带Eya1基因的慢病毒)和慢病毒感染组(感染携带Eya1基因及荧光蛋白基因的重组慢病毒)。根据预实验得到的最佳感染细胞的感染复数在培养基中加入MOI=10的病毒量,同时加入感染试剂Polybrene(最终浓度应为5 μg/ml)提高感染效率。混匀后置于细胞培养箱培养;12 h后更换新的培养基;48 h后荧光显微镜下观察感染效率,并加入嘌呤霉素(预实验测定的最佳药物筛选浓度为8 μg/ml)筛选出感染成功的细胞进行实验。
1.2.5MES23.5细胞损伤模型的制备 本课题组前期研究显示,100 μmol/L 6-OHDA溶液加入多巴胺能神经细胞2 h,细胞生存率约为53%,所以选择此浓度和时间用于后续实验。待细胞生长密度到90%左右时,加入100 μmol/L 6-OHDA溶液,对照组加入含抗坏血酸的0.9%氯化钠溶液,在加入6-OHDA 2 h后收集细胞,进行MES23.5细胞凋亡的检测,以及采用Western blot检测Bcl-2和Bax蛋白的表达变化。
1.2.6CCK-8试验检测MES23.5细胞活力 取对数期生长的细胞,用胰蛋白酶消化成单细胞悬液,将MES23.5细胞以每孔8×103个的密度接种在96孔板中,每组均设置6个复孔;24 h培养细胞贴壁后,对照组加抗坏血酸处理2 h,给予空载体组和过表达Eya1组加药处理2 h后,将培养基吸出,每孔加入100 μl培养基和10 μl CCK-8试剂,混匀后置于细胞培养箱孵育2 h。用酶标仪在波长450 nm处测定各孔吸光度值。
1.2.7Hoechst 33258染色 细胞发生凋亡时,染色质会发生固缩。Hoechst 33258对细胞进行染色后,在荧光显微镜下观察,正常细胞核呈正常的蓝色,而凋亡的细胞核会呈致密浓染或呈碎片状致密浓染。将细胞接种到24孔板中(5×104细胞/孔),当细胞融合度为80%左右时,对照组加入抗坏血酸处理2 h,实验组加入100 μmol/L 6-OHDA处理2 h,吸尽培养液,加入150 μl固定液,固定10 min后,用PBS洗3遍,加入150 μl Hoechst 33258染液,染色5 min,去染色液,用PBS洗2遍,吸尽液体,滴一滴抗荧光淬灭液于载玻片上,盖上有细胞的盖玻片,荧光显微镜下观察细胞核形态变化。
1.2.8Western blot检测Eya1、Bcl-2和Bax蛋白表达水平 取对数期生长的细胞,收集病毒感染细胞和6-OHDA处理后的细胞及对照组细胞,用预冷的RIPA裂解液提取总蛋白,12 000 r/min离心30 min,取上清用BCA(bicinchonininc acid)法测定蛋白浓度,按1 ∶4的体积比在蛋白样品中加入5×SDS上样缓冲液,95 ℃煮沸变性10 min。取60 μg蛋白进行SDS-PAGE电泳分离目的蛋白,并转移至NC膜,使用5%的脱脂牛奶室温封闭2 h,加一抗4 ℃孵育过夜,washing buffer洗涤条带3次,每次10 min,室温二抗避光孵育2 h,再用washing buffer洗涤条带3次后用Odyssey CLX红外激光成像系统扫描条带。以β-actin为内参,使用Image J分析条带灰度值。
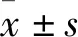
2 结果
2.1 携带Eya1基因的慢病毒重组表达质粒的构建及鉴定PCR扩增的目的片段Eya1经Gibson和LR反应后连接于慢病毒终载体,利用SnapGene软件进行酶切分析,可知使用ApaL I和Xho I连接的载体进行双酶切后,可以分别产生1 085、2 295、2 891、1 246、3 648 bp的5条DNA条带(图1A)。酶切后琼脂糖凝胶电泳结果显示有5条清晰的条带,与预测的一致,其中2 295处所在的条带包含目的基因Eya1(图1B)。测序结果经DNA分析比对与预期完全一致(图2)。以上结果表明携带Eya1的重组表达载体构建成功。

图1 构建的重组慢病毒质粒酶切后琼脂糖凝胶电泳分析A:重组慢病毒质粒;B:琼脂糖凝胶电泳分析;M:DNA marker;P7:未转染质粒;7:重组慢病毒质粒

图2 DNA测序图谱及基因序列比对
2.2 携带Eya1基因的慢病毒的包装及病毒滴度测定将Eya1表达质粒转染至HEK293细胞中,培养48 h后收集细胞培养上清液,通过荧光计数法进行滴度测定。病毒滴度=荧光细胞数×稀释倍数×1 000,结果显示上清液中的病毒滴度为2.61×108(TU/ml)。
将慢病毒包装的Eya1颗粒按照预实验的感染复数MOI=10感染到MES23.5细胞中,48 h后能明显观察到大量mCherry红色荧光(图3),感染效率达80%。经嘌呤霉素药物筛选后得到稳定表达目的基因的细胞株,即Eya1 MES23.5细胞株。

图3 Eya1慢病毒感染MES23.5细胞 ×20A:明场显微镜下;B:荧光显微镜下
2.3 稳定表达Eya1基因的MES23.5细胞中Eya1蛋白水平的鉴定收集培养的Eya1 MES23.5细胞株,Western blot方法鉴定细胞中Eya1蛋白的表达。结果显示,过表达Eya1组中Eya1蛋白表达水平明显高于空载体组和对照组(F=11.82,P<0.05),见图4。以上结果进一步表明,成功筛选出稳定表达Eya1的MES23.5细胞。
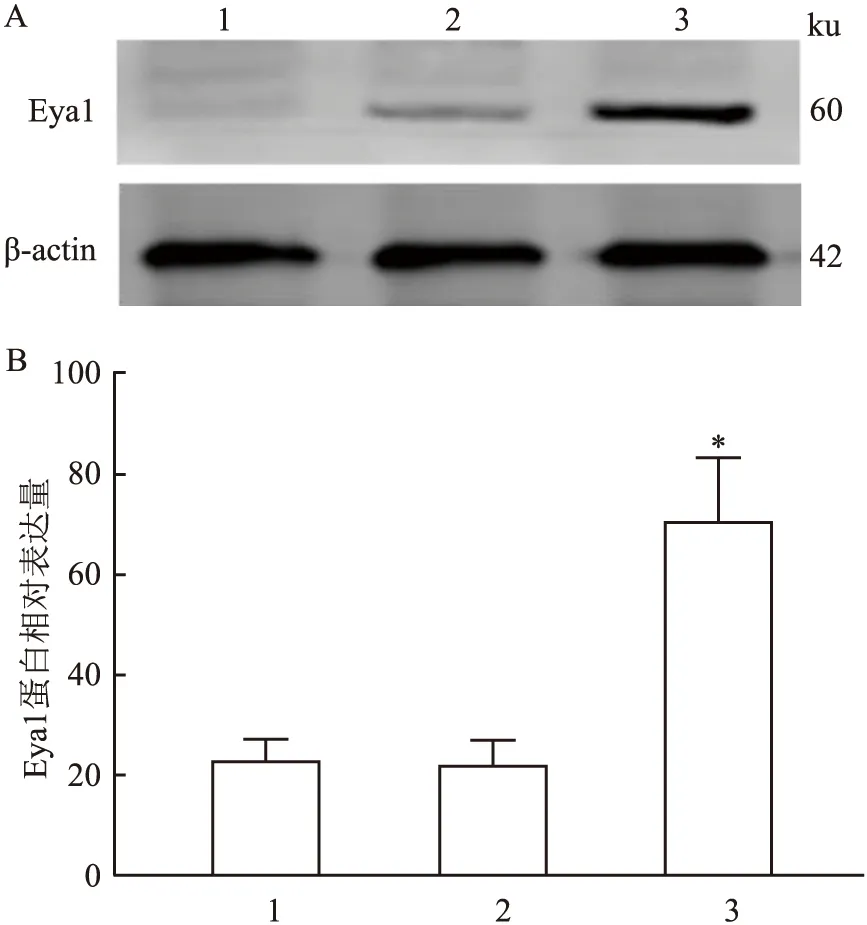
图4 Western blot检测MES23.5细胞中Eya1蛋白表达水平A:Western blot检测Eya1基因的表达;B:各组Eya1蛋白灰度值统计图;1:对照组;2:空载体组;3:过表达Eya1组;与空载体组比较:*P<0.05
2.4 过表达Eya1对6-OHDA诱导的MES23.5细胞活力的影响用CCK-8试验检测了药物处理后MES23.5细胞的活力变化并进行了形态学观察。结果显示,过表达Eya1组细胞活力明显高于空载组(F=9.159,P<0.05),而对照组之间差异无统计学意义(图5)。显微镜下观察显示,对照组细胞形态正常,胞体和突起均匀附着;加药处理后细胞形态异常,胞体变小且皱缩,过表达Eya1组细胞胞体变小和皱缩明显减轻(图6)。以上结果表明过表达Eya1保护了药物处理对MES23.5细胞的损伤作用。
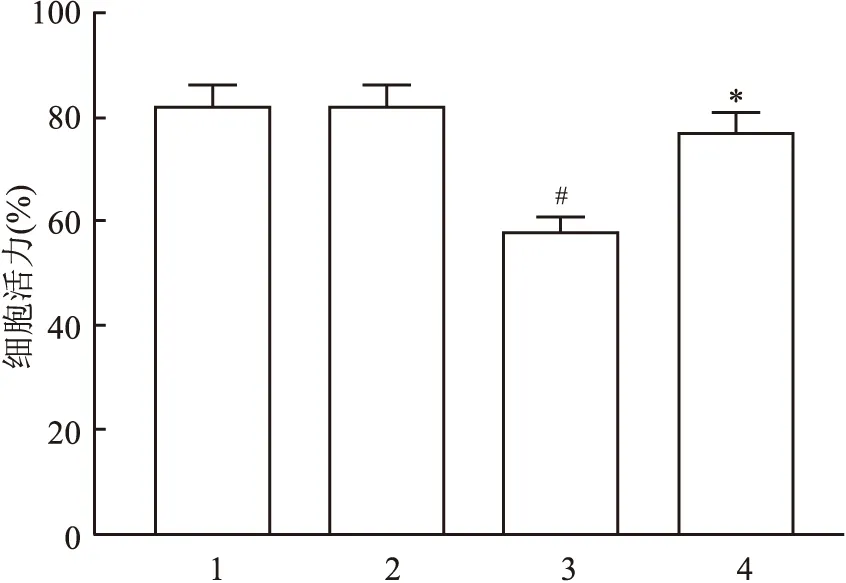
图5 CCK-8检测各组细胞的活力1:对照组;2:空载体组;3:6-OHDA处理的空载体组;4:6-OHDA处理的过表达Eya1组;与6-OHDA处理的空载体组比较:*P<0.05;与对照组比较:#P<0.05
图6 显微镜下MES23.5细胞形态的观察 ×20A:对照组;B;空载体组;C:6-OHDA处理的空载体组;D:6-OHDA处理的过表达Eya1组
2.5 过表达Eya1对6-OHDA诱导的MES23.5细胞凋亡的影响Hoechst 33258染色观测了药物处理后MES23.5细胞核的形态学变化。结果显示,荧光显微镜下观察到未加药物处理组的细胞核呈现均匀淡蓝色,细胞核大小一致,形状均匀(图7A、B)。6-OHDA药物处理后,空载体组细胞核发生固缩,变小,且出现凋亡小体,细胞核呈现浓染致密的荧光(图7C);过表达Eya1组细胞核中凋亡小体与空载体组相比明显减少。以上结果表明过表达Eya1可降低6-OHDA诱导的MES23.5细胞的凋亡。

图7 Hoechst 33258染色观察细胞的凋亡情况 ×20A:对照组;B:空载体组;C:6-OHDA处理的空载体组;D:6-OHDA处理的过表达Eya1组;箭头:为部分凋亡细胞
2.6 过表达Eya1对6-OHDA诱导的MES23.5细胞中凋亡相关蛋白Bcl-2、Bax表达的影响Western blot方法检测细胞中促凋亡蛋白Bax和抗凋亡蛋白Bcl-2的表达,结果显示,未加药物处理组中Bcl-2和Bax表达差异没有统计学意义;6-OHDA诱导细胞损伤后,Eya1过表达组Bax表达明显低于空载体组(F=11.89,P<0.05),而Bcl-2的表达明显高于对照组(F=27.83,P<0.05)(图8)。说明过表达Eya1增强了MES23.5细胞的抗凋亡作用。

图8 Western blot检测各组Bcl-2和Bax蛋白的表达A:Western blot 检测各组Bcl-2和Bax蛋白的表达B:每组Bcl-2蛋白表达水平统计图;C:每组Bax蛋白表达水平统计图;1:对照组;2:空载体组;3:6-OHDA处理的空载体组;4:6-OHDA处理的过表达Eya1组;与对照组比较:#P<0.05;与6-OHDA处理的空载体组比较:*P<0.05
3 讨论
在各种病毒载体中,慢病毒载体具有将外源基因有效整合到宿主染色体上,因而可以持久性表达,同时,慢病毒载体还具有安全性高的特点[9]。本研究利用慢病毒载体建立稳定高表达Eya1的细胞株,为研究Eya1基因在多巴胺能神经细胞中的生物学功能奠定基础。
本研究将构建的Eya1过表达的稳定感染的MES23.5细胞株及其空载体对照组细胞株给予6-OHDA处理2 h,构建DA能神经细胞的损伤模型。研究结果显示,6-OHDA作用2 h时MES23.5细胞的活性降低了约50%,故选择6-OHDA作用2 h,便于观察Eya1过表达对损伤的细胞是否具有保护作用。CCK-8检测结果显示,过表达Eya1组的细胞活力明显高于空载体对照组,这说明Eya1对损伤的MES23.5细胞具有保护作用。Hoechst 33258染色结果表明Eya1是通过拮抗细胞凋亡的作用发挥了对细胞的保护作用。
细胞凋亡的主要途径有死亡受体途径和以线粒体为主的内源性凋亡,线粒体信号通路在调节细胞凋亡中起着重要的作用。线粒体凋亡途径上Bcl-2蛋白家族作为参与细胞凋亡的核心家族,对凋亡的调控意义尤为突出[10]。在Bcl-2蛋白家族中Bcl-2是起主要作用的抗凋亡蛋白,有证据表明Bcl-2家族蛋白的功能与多巴胺能神经元的发育密切相关,Bax是重要的促凋亡蛋白。正常情况下,脑组织神经细胞处于抗凋亡与促凋亡相对平衡状态。Bcl-2高表达状态是为了阻止细胞凋亡,起到一种生理性神经自我保护作用,而Bax高表达状态则是促进了细胞凋亡,起到一种病理学破坏作用[11-12]。本研究在应用Hoechst 33258法检测细胞凋亡的基础上,同步应用Western blot方法对Bcl-2和Bax蛋白进行检测,进一步证实了Eya1在损伤的细胞中具有拮抗细胞凋亡的作用,结果显示过表达Eya1组的Bcl-2表达明显高于空载体组,Bax蛋白表达明显低于空载体组。然而,本研究中课题组发现一个现象,即6-OHDA处理后的空载体组中Bcl-2的蛋白表达水平与对照组相比增高,而不是降低。造成这种现象的原因可能为受损早期的细胞启动自身的应激性保护机制,调用自身抗凋亡系统来抵抗药物造成的损伤。这也与本课题组前期研究[8]结果相一致,即在6-OHDA作用1~3 h时,Eya1表达一过性增高,以保护受损的多巴胺能神经细胞。
综上所述,该研究构建了Eya1过表达的慢病毒表达载体及Eya1稳定表达的MES23.5细胞株,表明过表达Eya1通过调控Bcl-2、Bax表达,拮抗6-OHDA诱导的MES23.5多巴胺能神经细胞的凋亡。该研究为课题组进一步开展Eya1基因在帕金森病中的功能和作用机制研究奠定了重要基础。
