哺乳动物体细胞核移植胚胎发育中表观重编程的研究进展
2022-06-06闫业联张梦雅刘秋晨徐长志宗艳峰朱治桦吴苏城李运生张运海曹祖兵
闫业联,张梦雅,刘秋晨,汪 薪,徐长志,宗艳峰,朱治桦,吴苏城,宋 雨,李运生,张运海,曹祖兵
(安徽农业大学动物科学技术学院,地方畜禽遗传资源保护与生物育种安徽省重点实验室,合肥 230036)
体细胞核移植(somatic cell nuclear transfer,SCNT)也称体细胞克隆,包括去核、注核、融合和激活等步骤,SCNT能将已分化的体细胞重编程为全能性状态,彻底改变人们对生殖发育经典理论的认识。应用SCNT技术已成功克隆非洲爪蟾、小鼠、牛等20余种动物[1],SCNT囊胚可用来产生多能干细胞(pluripotent stem cells,PSCs),也称为核移植胚胎干细胞(nuclear transfer embryonic stem cells,ntESCs),它与供体同源,可用于更新和替换损坏的细胞和组织,同时,SCNT胚胎也是一种帮助人们理解细胞记忆如何被重编程产生全能细胞的模型,显示出SCNT在农业良种扩繁、濒危物种保护、生物医学以及基础研究等方面的巨大潜力[1]。然而,SCNT效率低下、表型异常发生率高严重阻碍了该技术的广泛应用。 牛的克隆效率最高,也仅为5%~20%,远远低于体外受精(invitrofertilized,IVF)的效率(40%~60%)[2]。此外,克隆动物常出现胎盘增生、胎盘发育不全[3]以及出生后巨胎症[4]、免疫缺陷[5]、呼吸障碍[6]等异常现象。但是,成功克隆的动物大多可产生正常表型的后代,意味着这些异常现象主要是由表观遗传重编程不完全引起的,而非基因突变造成的[7]。随着低样本量测序技术的发展和完善,人们能够在SCNT胚胎中检测到更详细的全基因组表观遗传修饰图谱,进一步揭示SCNT胚胎表观遗传重编程中的缺陷,为提高克隆效率提供了线索[8]。作者简述了SCNT的发展历程,并对影响SCNT胚胎着床前发育效率的表观遗传事件进行总结(图1A),强调了一些可能影响SCNT效率的表观遗传标记(图1B),以及对一些克服表观遗传障碍提高克隆效率的方案进行梳理,旨在促进对SCNT相关表观遗传调控机制的理解,从而更有效地提高克隆效率。
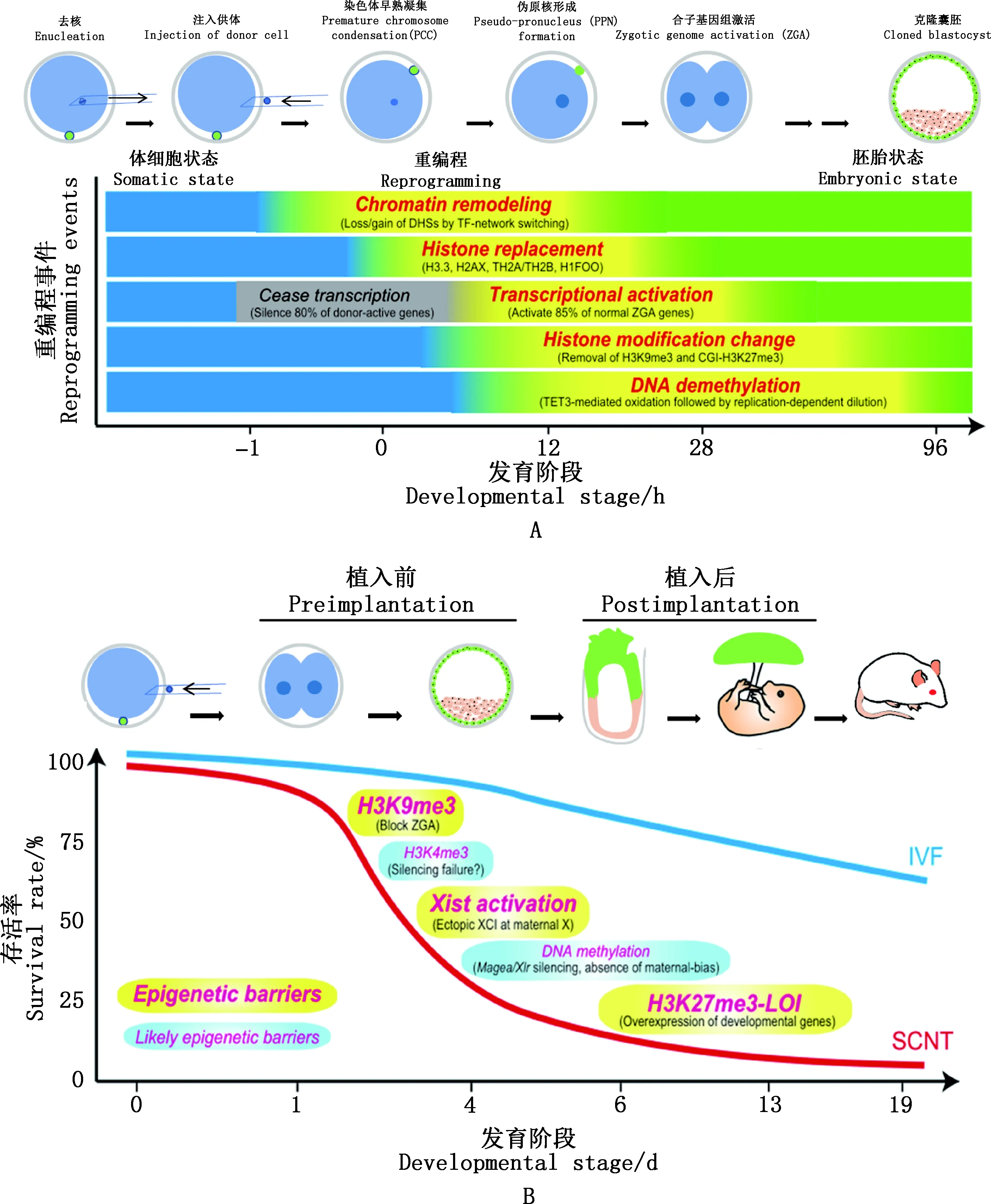
图1 SCNT胚胎发育过程中的重编程事件及其在生殖克隆中的相关障碍[1]Fig.1 Molecular mechanisms of SCNT reprogramming and its associated barriers in reproductive cloning[1]
1 体细胞核移植
1958年,Gurdon等[9]将非洲爪蟾(Xenopuslaevis)幼体肠细胞核移入去核卵母细胞,获得了第1例SCNT动物个体。1986年,Willadsen[10]通过电融合1个卵裂球与去核卵母细胞移植入受体子宫,成功获得了3只存活的羔羊,为哺乳动物SCNT提供了依据。1997年,Wilmut等[11]将成年芬多斯母羊的乳腺上皮细胞与苏格兰黑面母羊的去核卵细胞电融合,获得了首个SCNT哺乳动物“多利”,这一里程碑式的成就开启了克隆时代。牛、小鼠、山羊、猪、欧洲盘羊、家兔、家猫、马、大鼠、骡子、狗、雪貂、狼、水牛、红鹿、单峰骆驼、食蟹猴等相继被成功克隆[12],其中最引人瞩目的是2018年食蟹猴的成功克隆[13],再次证实了SCNT的可行性。
同时,SCNT在治疗性克隆、线粒体疾病等研究中也得到了发展,2001年,Wakayama等[14]在成年小鼠体细胞克隆胚胎中分离出了具备多能性特征的ntESCs;2007年Byrne等[15]报道了在成年恒河猴皮肤成纤维细胞核移植的克隆胚胎中,成功地分离获得了2枚ESCs,其不仅有正常的核型,且具备体内外三胚层分化的多能性;2013年,该团队利用人胎儿皮肤成纤维细胞核移植,在克隆胚胎中成功地获得了4枚有正常二倍体核型和具备多能性的ntESCs[16],随后,正常成年人[17]、糖尿病[18]及老年性黄斑变性病人[19]体细胞来源的ntESCs的相继获得,使得治疗性克隆成为研究热点。
2 体细胞核移植后的表观遗传重编程
2.1 DNA甲基化
DNA甲基化主要指发生在CpG双核苷酸中胞嘧啶上第5位碳原子的甲基化过程,其产物为5-甲基胞嘧啶(5-mC)[20],在受精胚胎中,母系和父系等位基因主要通过10-11易位(ten-eleven translocation,TET)蛋白(TET1、2、3)介导5-mC氧化为5-羟甲基胞嘧啶(5-hmC)和胸腺嘧啶DNA糖基化酶(thymine DNA glycosylase,TDG)介导的碱基切除修复[21]这两种DNA去甲基化途径,来清除DNA分子上亲本甲基化标记[22],在囊胚期达到最低甲基化水平。 随后借助DNA甲基转移酶(DNA methyltransferases,DNMTs)(DNMT3A、DNMT3B、DNMT1)建立并维持新的甲基化模式[22]。
由于供体细胞基因组DNA高度甲基化[23],SCNT胚胎发育过程中可能也经历着DNA甲基化的动态变化,在小鼠SCNT胚胎中发现,定位于假原核(pseudo pronucle,PPN)的TET3诱导5-mC向5-hmC的转化[24],在其1-细胞晚期仍存在与供体细胞相近的DNA甲基化模式[25],到2-细胞、4-细胞阶段,SCNT胚胎依然比受精胚胎甲基化水平更高[8],发育阻滞在2-细胞和4-细胞阶段的SCNT胚胎的甲基化水平分别比能够发育到囊胚阶段的2-细胞和4-细胞的甲基化水平高[26],直到囊胚期才达到与IVF囊胚相似的甲基化水平(15.6%vs19.1%)[27]。此外,小鼠植入前SCNT胚胎中存在的异常再甲基化差异甲基化区域(re-methylated differentially methylated regions,rDMRs),导致对合子基因组激活(zygotic genome activation,ZGA)十分重要的基因和反转录转座子的错误表达,严重阻碍了克隆胚胎的正常发育[28]。综上表明,SCNT胚胎发育过程中经历去甲基化/再甲基化的动态变化,而一种与受精胚胎相似的DNA甲基化模式对SCNT成功重编程至关重要。
2.2 组蛋白修饰
组蛋白修饰是指真核生物的细胞核中,与DNA结合的碱性蛋白质氨基末端发生的甲基化、乙酰化、磷酸化、泛素化等共价修饰,不仅在调控染色质结构和基因表达中发挥重要作用,而且可以作为表观遗传标记传递给子细胞[29]。 然而,SCNT胚胎与IVF胚胎在组蛋白甲基化和乙酰化方面存在明显差异[30]。
2.2.1 组蛋白甲基化 组蛋白甲基化在胚胎发育的各个阶段均有重要作用[31]。研究较多的是位于基因启动子处的转录激活标记组蛋白3赖氨酸4三甲基化(H3K4me3),在母体基因组中,存在与部分甲基化的DNA域高度重叠的非典型H3K4me3(non-canonical form of H3K4me3,ncH3K4me3)形式,成熟卵母细胞到2-细胞早期阶段的基因组沉默常伴随着ncH3K4me3的整体显现,过表达赖氨酸特异性去甲基化酶5b(lysine-specific demethylase 5b,Kdm5b)导致大量卵母细胞中H3K4me3显著下调并重新激活转录,表明它可能参与了基因抑制[32]。在2-细胞晚期,启动子上典型H3K4me3峰的建立会取代非典型H3K4me3,H3K4me3去甲基酶Kdm5a/b的敲低会导致胚胎难以发育到囊胚阶段,并导致合子基因组激活缺陷[33],说明及时去除H3K4me3修饰对于ZGA是必需的。
组蛋白3赖氨酸9三甲基化(H3K9me3)异常是SCNT胚胎中常见的抑制性修饰,它与异染色质的形成有关,抑制相关基因的表达[34]。在小鼠SCNT胚胎2-细胞期存在一些相对于IVF胚胎未能激活的区域,被称为抗重编程区域(reprogramming-resistant regions,RRRs),造成ZGA缺陷,影响克隆胚胎正常发育。在体细胞中这些RRRs中富集H3K9me3[35],过表达H3K9me3特异性组蛋白去甲基化酶Kdm4d或在供体小鼠胎儿成纤维(mouse embryonic fibroblast,MEF)细胞中敲除Suv39h1和Suv39h2(两种H3K9甲基转移酶)可以去除RRRs中的H3K9me3,使得小鼠SCNT胚胎在2-细胞期正常激活基因组,显著提高了胚胎的发育效率[35]。通过其他Kdm4家族基因改善H3K9me3修饰,也在牛[36]、食蟹猴[13]、人[19]显示出类似的效果。虽然在SCNT中使用Kdm4d可获得与IVF相当的植入率,但植入的SCNT胚胎只有不到15%能足期发育,而且在kdm4d处理后的SCNT胚胎中仍可观察到胎盘异常[35]。表明H3K9me3可能主要阻碍SCNT着床前胚胎发育。
组蛋白3赖氨酸27三甲基化(H3K27me3)异常重编程会阻碍SCNT胚胎发育,H3K27me3在IVF植入前胚胎的启动子区域缺失,在体细胞中主要富集于CpG岛屿(CGI)和CGI相关启动子上,在母体基因组中广泛分布[37]。在植入前后胚胎发育中均发挥关键作用[38],在小鼠SCNT胚胎2-细胞中存在异常重编程,当发育到桑椹胚时来自供体细胞启动子相关的H3K27me3基本消失,达到与IVF胚胎相似的分布模式[27]。过表达H3K27me3特异性去甲基化酶Kdm6a显著增加了SCNT囊胚形成率,但足期发育率没有提高,敲低Kdm6b可提高Kdm6a的表达,不仅促进了ZGA,提高了囊胚的形成率,而且提高了出生率和ntESCs的产生效率[39]。 而对胚胎植入后的影响,主要是由H3K27me3印迹基因(如Sfmbt2或其相关的microRNA簇)的印迹缺失(loss of imprint,LOI)造成的[40]。
2.2.2 组蛋白乙酰化 组蛋白乙酰化通常发生在核心组蛋白N-端碱性氨基酸集中区域的特定赖氨酸残基上,具有增加染色质可及性,促进转录激活的作用[41]。Dahl等[33]对小鼠体内胚胎的研究发现,组蛋白3赖氨酸27乙酰化(H3K27ac)的基因组覆盖范围从卵母细胞到2-细胞胚胎均显著增加,与启动子H3K4me3峰的建立过程十分相似,表明这些活性标志可能共同作用介导ZGA。当供体细胞注入去核MⅡ期卵母细胞后,体细胞中核心组蛋白(H3K9、H3K14、H4K16)快速去乙酰化,在克隆胚胎激活后发生再乙酰化[30]。猪SCNT胚胎1-细胞与2-细胞期H3K18ac、H4K8ac水平均显著低于IVF胚胎,但囊胚时期SCNT胚胎与IVF胚胎中二者水平基本一致[42]。Yang等[43]发现异常的乙酰化区域阻碍合子基因的激活,曲古抑菌素A (trichostatin A,TSA)处理和过表达双同源盒(double homebox,Dux)(Dux)挽救异常的H3K9ac修饰,能够明显提高克隆小鼠的发育效率,表明正确的组蛋白乙酰化重编程同样是提高SCNT效率的重要途径。
2.3 组蛋白变体
当供体细胞核注入去核卵母细胞后,必须被重塑成类似于受精卵的细胞核才能保证SCNT成功[44]。受精后,主要与鱼精蛋白包装在一起的精子基因组经历整体重塑,存在于母系的组蛋白,如H3.3(由H3f3a和H3f3b编码)和H2AFX迅速重新包装精子的DNA[45]。在SCNT后,进入去核卵母细胞的供体细胞染色质开始浓缩,不久后,MacroH2A(由H2afy和H2afy2编码)从体细胞核染色质中解离,直到桑椹胚阶段,MacroH2A在染色质中重新建立[46]。大多数供体细胞来源组蛋白变体在激活后5 h内消失,伴随着这个过程,所有卵母细胞来源的H3变体(H3.1、H3.2和H3.3)、H2A组蛋白家族成员X(H2A histone family member X,H2AFX)以及卵母细胞特异性的组蛋白变体H1foo在SCNT时被迅速整合到供体细胞核中[45]。除此之外,卵母细胞独特的核心组蛋白变体TH2A和TH2B(分别由Hist1h2aa和Hist1h2ba编码),在体细胞中过表达能够诱导染色质开放并促进诱导性多能干细胞(induced pluripotent stem cells,iPSC)重编程[47]。在小鼠SCNT前,敲低卵母细胞的组蛋白变体H3.3会阻碍多能基因的激活,影响胚胎发育[48],说明组蛋白变体在SCNT重编程中具有重要作用。
2.4 基因组印迹
基因组印迹是指在胚胎发育期间,通过表观遗传修饰来自亲本的等位基因或染色体,导致2个亲本来源的等位基因有不同的表达活性,具有这种差异的基因被称为印迹基因[49]。基因组印迹在配子形成期间被清除和建立,并在生物体的整个生命周期中保持,保证了早期胚胎的正常发育[50]。然而,基因组印迹在克隆胚胎中没有得到有效维持,导致印迹基因异常表达[12]。
DNA甲基化是哺乳动物主要的基因组印迹,不同亲本来源的等位基因调控区的差异性DNA甲基化(differentially methylated region,DMR)能够决定及维持印迹基因的差异表达[51]。H19/胰岛素样生长因子2(insulin like growth factor 2,IGF2)是哺乳动物中典型的印迹基因簇,均受DMR调控,其父源等位基因上的DMR被甲基化,在该位点上H19沉默刺激IGF2活化和细胞生长,而母源等位基因上的H19是一种抑制因子,对IGF2表达具有顺式沉默效应。研究发现,IGF2和H19的异常表达可导致克隆犊牛死亡[52],在异常死亡的克隆猪胎盘中也检测到IGF2和H19的表达异常[53],在人和小鼠中,H19、IGF2和胰岛素样生长因子2受体(insulin like growth factor 2 receptor,IGF2R)等印迹基因的异常表达会导致胎儿过度生长,通过检测DMR的DNA甲基化水平发现巨胎症的克隆绵羊中IGF2R表达较正常胎儿显著降低[54]。低甲基化的H19/IGF2印迹导致H19转录增加,抑制克隆胎儿的生长,而高甲基化的H19/IGF2印迹介导的IGF2过表达导致克隆胎儿的过度生长[12]。在小鼠SCNT植入前胚胎中印迹基因H19、母源表达3(maternally expressed 3,Meg3)、IGF2R、Achaete-Scute家族BHLH转录因子2(achaete-scute family bhlh transcription factor 2,Ascl2)和小核核糖核蛋白多肽N(small nuclear ribonucleoprotein polypeptide N,SNRPN)只有4%正常表达[55];与常规妊娠相比,从死亡克隆妊娠和活犊分离的牛胎盘中观察到6个印迹基因(H19、X非活性特异性转录本(X inactive specific transcript,XIST)、IGF2R、SNRPN、父源表达3(paternally expressed 3,PEG3)和IGF2异常表达[56],意味着对基因组印迹机制的深入研究对改善SCNT效率具有重要意义。
除DNA甲基化之外,H3K27me3修饰是一个新的印迹基因调控机制,在胚胎着床前发育过程中,母系沉积的H3K27me3抑制至少76个基因的母系等位基因表达,其中Sfmbt2、Gab1、Smoc1、Jade1在胎盘中受H3K27me3介导的非典型印迹调控,在胎儿中丢失印迹(双等位表达),在小鼠SCNT胚胎囊胚期所有依赖H3K27me3的印迹基因基本上都失去了印迹状态,成为双等位基因表达,这可能是由于供体细胞中缺乏H3K27me3印迹标记,因为它在供体细胞来源的胚胎谱系中缺失[40]。然而,在猪和牛植入后克隆胚胎中没有发现H3K27me3基因印迹缺失,这表明H3K27me3印迹系统可能不是跨物种保守的[57]。印迹基因Ndn和Xist在克隆牛胚胎中的异常表达与乙酰化组蛋白4赖氨酸5(AcH4K5)相关[58],而小鼠Xist(X-inactive specific transcript)是H3K27me3调控的印迹基因的一员[59]。Xist是位于X染色体上的17 kb的长链非编码RNA,参与调控X染色体失活(XCI)[60]。哺乳动物X染色体通过印迹失活和随机失活保证雄性和雌性细胞之间X染色体编码基因表达水平的平衡[61]。然而在小鼠SCNT胚胎中,Xist普遍高表达,导致2条X染色体异常失活,引起SCNT胚胎移植后死亡[62]。在牛[62]和猪[63]中也观察到SCNT后异常Xist激活,与产前胚胎死亡有关,说明异常的Xist表达可能也属于H3K27me3印迹调控的体细胞克隆障碍[64]。
2.5 染色质开放性
染色质开放性也被称为染色质可及性,是指核大分子能够与染色质化的DNA进行物理接触的程度,基因的表达依赖于染色质的可及性[12]。受精后,染色质组织不同的精子和卵子都经过重编程,以获得相似的染色质可及性,从而使2个亲本等位基因的表达相等[65]。在胚胎激活后12 h内,小鼠SCNT胚胎1-细胞的染色质可及性重编程伴随着DNase Ⅰ高敏感位点(DNase Ⅰ hypersensitive sites,DHSs)的整体缺失基本完成[66],DHSs与基因表达呈正相关,存在于供体细胞并在克隆胚胎中重新编程,然而,供体细胞的特异性DHSs无法被重新编程到克隆胚胎的DHSs,阻碍了克隆胚胎中的基因表达[66]。另外,供体细胞的染色质状态对转录重编程有重要影响,Miyamoto等[67]对非洲爪蟾的研究发现,供体细胞中沉默但已有开放转录起始位点的基因在SCNT后容易被激活。 Djekidel等[66]利用liDNase-seq技术研究发现DHS谱重编程与供体特异性转录因子(TFs)网络向合子网络的转换有关,一些体细胞TFs无法与染色质分离,也可能是SCNT重编程的障碍,这其中潜在的机制需要进一步研究。
3 表观遗传重编程改善的策略
尽管人们已经尝试优化SCNT程序、更换供体/受体细胞类型、改变去核与融合方法等提高克隆效率,但并未像消除表观遗传障碍那样显著提高克隆效率,因为决定克隆胚胎发育能力的关键之一是表观遗传重编程的程度[44]。目前,改善供体细胞重编程状态最常用的方法是药物处理或调控胚胎发育相关重要基因的表达,下文将从表观修饰剂、组蛋白去甲基化酶、抑制Xist表达、鱼精蛋白和精子RNA几个方面进行梳理。
3.1 表观修饰剂
Han等[68]通过在供体细胞中过表达TET3来优化SCNT胚胎的去甲基化过程,成功提高了克隆山羊的出生率(3.6%vs1.5%)。DNA甲基化转移酶抑制剂(DNA methyltransferases inhibitors,DNMTi)(图2A)或靶向DNA甲基化转移酶的siRNA来修正异常的再甲基化过程可显著提高克隆效率(图2B),如利用5-氮杂-2′-脱氧胞苷(5-aza-2′-deoxycytidine,5-aza-dc)[69]、zebularine[70]、RG108[71]处理降低基因组DNA甲基化水平可以改善克隆胚胎的发育;通过注射靶向DNA甲基化转移酶(DNMT3a和DNMT3b)的siRNA(图2B),可将小鼠SCNT胚胎囊胚发育率提高近10%(48.2%vs39.5%),且小鼠SCNT胚胎的足期发育率由0.88%提升到5.33%[28]。组蛋白去乙酰酶抑制剂(histonedeacetylase inhibitor,HDACi)能够增加组蛋白乙酰化,打开染色质结构,有利于转录因子的结合,激活参与早期胚胎发育的基因[12](图2A)。迄今为止,已发现TSA、Scriptaid、Oxamflatin、SAHA、quisinostat、丙戊酸等多种HDACi,其中TSA是抑制Ⅰ和Ⅱ类HDACs最有效、最常用的抑制剂[72],可将小鼠克隆胚胎效率从1%提高到6%[73]。TSA和5-aza-dc共同处理SCNT胚胎,能够极大地提高小鼠、猪克隆胚胎的发育效率[74]。此外,使用TSA和Scriptaid 2种HDACi联合处理家兔克隆胚胎比使用单一HDACi更有利于提高克隆效率[75]。但值得思考的是,这些药物(如HDACi和DNMTi)在整体基因组范围内对其靶标产生作用,那它们的副作用是什么?它们在激活一些基因的同时也会抑制其他基因表达吗?此外,这些表观修饰剂对除小鼠之外其他物种的着床后克隆胚胎发育的影响鲜有报道,均需要进一步研究。
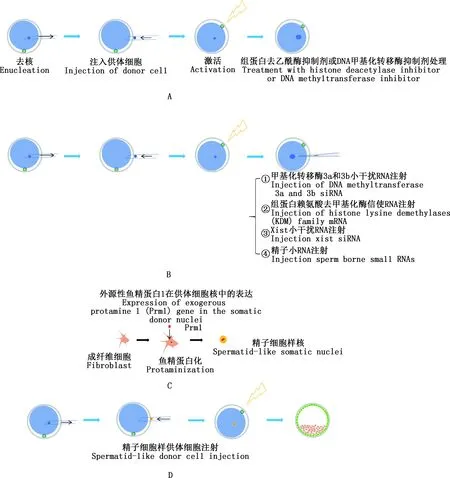
A,组蛋白去乙酰酶抑制剂或DNA甲基化转移酶抑制剂处理激活后重构卵母细胞;B,注射小干扰RNA、信使RNA以及精子小RNA等方法提高克隆效率;C,构建外源性表达鱼精蛋白1的体细胞;D,通过使用精子样结构供体细胞改善核移植效率A,SCNT improvement by exposure of histone deacetylase inhibitors (HDACi) after reconstructed oocyte activationor DNA methyltransferase inhibitor (DNMTi);B,SCNT improvement by Injection of siRNA,mRNA and sperm-borne small RNAs;C,Exogenous expression of Protamine 1 (Prm1) gene in the somatic donor nuclei;D,SCNT improvement by using donor cells with spermatid-like structures图2 改善SCNT的策略Fig.2 Strategies for improving SCNT
3.2 组蛋白去甲基化酶
组蛋白赖氨酸去甲基化酶(histone lysine demethylases family,Kdms)可以通过优化组蛋白修饰水平,改善克隆胚胎发育效率(图2B)。研究发现,H3K9me3去甲基化酶Kdm4d和Kdm4b均能有效降低H3K9me3水平,使得囊胚率提高到80%以上[8],且Kdm4d mRNA注射到SCNT胚胎中能将出生率从仅1%提高到8.7%[35]。同样,当把H3K4me3特异性去甲基化酶Kdm5b mRNA注射到去核卵母细胞中可将小鼠囊胚率从约30%提高到50%以上,过表达Kdm4b和Kdm5b可将囊胚率提高到95%以上,并有超过11%的克隆胚胎发育成活的动物[8],而接受Kdm4b和Kdm5b mRNA和siDNMT3a和siDNMT3b共注射的去核卵母细胞的胚胎发育率更高[28]。 灵长类动物食蟹猴(Macacafascicularis)的成功克隆得益于TSA和H3K9me3甲基化去甲基化酶Kdm4d的联合处理[13],证明了消除多重表观遗传障碍是改善SCNT重编程的有效方法。
3.3 抑制Xist表达
SCNT胚胎中普遍存在Xist高表达,造成X染色体失活机制异常,敲除或敲低小鼠克隆胚胎中Xist基因,能够提高克隆胚胎的发育效率[76]。而将Xist敲除与Kdm4过表达相结合,可将克隆效率提高到20%以上[27]。在克隆猪早期胚胎中,Kdm4a的过表达会上调Xist的表达,因此不能提高克隆猪胚胎后期的体内发育能力[77]。不同物种间的差异提示人们对不同物种间表观遗传变化的准确理解对推动SCNT技术的应用十分关键。
3.4 鱼精蛋白和精子小RNA
除了集中在卵母细胞上的研究,对精子认识的不断深入为提高SCNT效率提供了新的策略。通过构建外源性表达鱼精蛋白1的供体细胞(图2C),能够产生精子细胞样染色质和细胞骨架结构,提高SCNT囊胚率[78](图2D)。精子携带的小RNA(图2B)可降低兔SCNT胚胎8-细胞期H3K9me3水平,降低SCNT囊胚的凋亡指数,显著提高植入前克隆胚胎的发育能力[79]。注射牛精子小RNA到SCNT胚胎中改善了α-微管蛋白K40的乙酰化和原核形成率[80]。有研究发现,精子microRNA-449b[81]、microRNA-125b[82]均在改善表观遗传重编程方面发挥重要作用。但相关精子因子对出生率的改善还未见报道,因此,精子因子在提升克隆效率方面仍需深入探索。
综上所述,表观遗传调控是一个复杂且相互协调的网络,它不仅局限于各种表观遗传的独立调控,而且还存在精密的互相调节关系。这意味着单独消除某一项表观遗传障碍,提升克隆效率的作用有限,使用多种方法以及多个角度的结合来克服SCNT过程中表观遗传重编程障碍[83],是提高克隆胚胎发育能力新的方向。 而要使SCNT技术有更广阔的应用前景,则需要人们在猪、牛等大型动物上进行更多研究。
4 小 结
近年来,随着单细胞测序技术的应用,在发现和识别克隆胚胎发育相关的重编程因子方面取得了巨大进展,一些改善表观重编程的策略,如组蛋白去乙酰化酶抑制剂、DNA甲基转移酶抑制剂、组蛋白去甲基化酶以及抑制Xist表达等使克隆胚胎的发育能力获得了显著提升,但对克隆动物出生率的提升依然有限。一些对小鼠克隆效率提升十分有效的方法(如HDACi)在大型动物上却不尽人意,仍需要开发适合所有物种的理想核重编程策略。除了前述的各种表观遗传独立调控的机制外,它们之间存在许多相互调控的关系;不同基因组位点及不同转录因子的转换模式在表观遗传重编程中的调控方式仍不清晰;且环境因素可能影响表观遗传调控,因此运用多组学分析来阐明SCNT涉及的重编程因素和机制或许是提高人们对胚胎发育的理解、改善克隆胚胎发育能力的有效途径。
在对提高克隆效率的长期探索拓展了SCNT的应用。如节约生产种公畜的时间和费用,促进经济和农业动物的扩繁,为保护濒危物种提供了新方法;结合SCNT与生物反应器制作技术,产生生物反应器(乳腺生物反应器),生产特定蛋白治疗人类疾病。此外,利用SCNT可以由供体细胞产生生物个体的特点,特别是当与CRISPR/Cas9等基因组编辑技术相结合时,可以在大型动物中快速高效地制造人类疾病模型,用来筛选药物以及研究人类疾病的发病机制。因此,克隆研究的每一次进步都会使其应用领域更加广泛。
在未来的研究中,提高SCNT胚胎的发育效率依然是人们努力的方向,随着多种阻碍克隆胚胎发育的障碍被揭示,进一步增加了克隆研究的复杂性,意味着仅通过单一的处理消除所有障碍是不现实的,联合去除多重障碍可能是实现完全重编程的更有效方法。另外,与最新的测序技术以及最新的基因编辑技术结合,将会更加清晰迅速地解析表观遗传重编程机制,以期实现几乎完全的重编程,从而大幅度提高克隆效率。
