凹唇姜精油的提取及清除游离基活性研究
2022-06-05王娅李荣姜子涛谭津王颖汤书华
王娅,李荣,姜子涛,2*,谭津,王颖,汤书华
(1.天津商业大学 生物技术与食品科学学院,天津 300134;2.天津天狮学院 食品工程学院,天津 301700)
凹唇姜(Boesenbergiarotunda(L.) Mansf.),姜科凹唇姜属[1],其食用方法同我们所熟悉的鲜姜。凹唇姜又名泰国沙姜、甲猜,其根茎的外观和手指很相像,因此也被称作指姜,凹唇姜分布于泰国和印度尼西亚,我国云南、广西等地也有大量种植。凹唇姜作为天然调味香辛料中的一种,在泰国、印度和中国等地的菜肴中很常见[2],其药用价值也非常高,在传统药物中用于治疗胃病、风湿和皮炎等[3]。近年来,关于凹唇姜中的黄酮类[4-5]和多酚[6-7]已有部分报道。然而关于凹唇姜中的重要生物活性成分——凹唇姜精油(Boesenbergiarotunda(L.) Mansf. essential oil, BEO),仅见作者在前文中报道了其对鲜切草鱼肉氧化稳定性的影响[8]。目前关于调味香辛料的研究报道较多,尤其是对香辛料精油的研究更为广泛[9]。例如同为姜科的姜精油[10-12]、常用香辛料花椒精油[13]、草豆蔻精油[14]、肉桂精油和八角茴香精油[15]等。
为充分利用凹唇姜植物资源及为天然抗氧化剂的开发提供更多的可能,本研究首次利用超声-微波辅助提取法探索了BEO的最佳提取工艺,利用单因素实验及响应面法探索和优化其提取条件,以得到高得率的精油;以PG、BHT为阳性对照,通过化学法测定了BEO对DPPH、ABTS+、OH自由基的清除能力;进一步通过气相色谱-质谱联用(GC-MS)对BEO的化学成分进行了鉴定,并推测了BEO清除游离基活性的反应机理。
1 材料与方法
1.1 材料与仪器
鲜凹唇姜:购于广州市;1,1-二苯基-2-三硝基苯肼(DPPH·)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS+)、过硫酸钾:Sigma试剂公司;无水乙醇:天津市津东天正精细化学试剂厂;没食子酸丙酯(PG)、2,6-二叔丁基对甲酚(BHT):天津市光复精细化学研究所;实验用水均为利用上海Heal Force公司的超纯水机制得的纯净水。
CW2000超声-微波协同萃取/反应仪 上海新拓微波公司;Trace 1310、TSQ 8000 Evo气质联用仪 美国Thermo Fisher公司;Lambda 25紫外可见分光光度计 珀金埃尔默仪器有限公司;AUY120万分之一电子天平 日本岛津公司;FW100高速万能粉碎机 天津市泰斯特仪器有限公司;DK-S12型电热恒温水浴锅 上海森信实验仪器有限公司。
1.2 实验方法
1.2.1 BEO的超声-微波协同提取工艺
实验原理:超声-微波提取仪的发生器输入一定功率的微波能量,超声换能器输入的超声能量固定功率为50 W/40 kHz。与其他提取方法不同,该提取程序分为两个阶段:(1)微波破碎阶段。该阶段可在短时间内使得溶剂和物料细胞内水分吸收微波能后温度迅速升高,连续的高温会使物料内部压力超过植物细胞壁膨胀的能力,从而导致细胞破裂,使得精油从细胞内流出。(2)提取阶段。该阶段在功率达到最大限度后,微波功率以维持恒定温度(约100 ℃),促使精油随水蒸气持续蒸出。由于水油结合,其沸点降低,在不到100 ℃便沸腾,使得高沸点的精油成分也能快速随水蒸气蒸发出来。超声-微波辅助提取法相比于传统的水蒸气蒸馏法,大大地缩短了提取时间,增加了精油的得率。
1.2.2 样品的制备
将新鲜的凹唇姜根茎洗净,晾干后切片,置于70 ℃烘箱烘干。用FW100高速万能粉碎机粉碎后过40目筛,放入棕色试剂瓶中保存备用。
1.2.3 BEO微波破碎过程单因素实验
1.2.3.1 实验步骤
准确称取0.050 g凹唇姜粉末,放入装有300 mL蒸馏水的提取瓶中,转移至微波提取器中。设置破碎过程的温度、时间、功率进行实验,该过程使得精油流出,量少而易溶于水中,然后将溶液过滤,得到水油混合物,冷却至室温后测定精油溶液的吸光度(n=3)。
1.2.3.2 单因素实验
按照1.2.3.1的方法进行实验,固定破碎温度为96 ℃,破碎时间为3 min,比较不同微波破碎功率(400,500,600,700,800 W)对提取BEO破碎过程的影响;固定破碎功率为600 W,破碎温度为96 ℃,比较不同微波破碎时间(1,2,3,4,5 min)对提取BEO破碎过程的影响;固定破碎功率为600 W,破碎时间为3 min,比较不同微波破碎温度(90,92,94,96,98 ℃)对提取BEO破碎过程的影响。通过单因素实验来探究破碎阶段各因素对BEO吸光度的影响。
1.2.4 BEO响应面优化破碎过程工艺
根据1.2.3.2单因素实验结果及Box-Behnken中心实验设计原理,选取破碎功率、破碎时间和破碎温度为考察因素并对其条件进行优化设计,以BEO吸光度为响应值,利用Box-Behnken进行响应面优化实验,因素水平设计见表1。
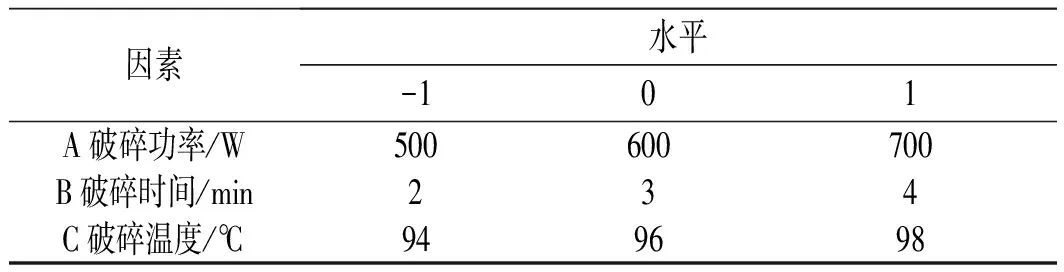
表1 响应面实验因素水平设计Table 1 The design of factors and levels of response surface test
1.2.5 BEO微波协同提取过程单因素实验
1.2.5.1 实验步骤
根据文献[16]的方法,准确称取10 g的凹唇姜粉末,将其置于500 mL的提取瓶中,按照不同料液比加入蒸馏水。并在以上所得到的最佳微波破碎的程序条件下,设置一定提取功率并固定提取温度为100 ℃进行实验,将所得精油用无水硫酸钠干燥后,再用0.22 μm有机微孔滤膜过滤,置于棕色瓶中,称量并按公式(1)计算BEO得率。

(1)
1.2.5.2 单因素实验
按照1.2.5.1的方法进行实验,固定料液比为1∶15(g/mL),比较不同功率(400,500,600,700,800 W)随着提取时间的延长对BEO得率的影响;固定提取功率为600 W,提取时间为25 min,比较不同料液比(1∶10、1∶15、1∶20、1∶25、1∶30,g/mL)对BEO得率的影响。每5 min收集一次BEO,计算BEO得率,直至BEO得率不再变化为止。
1.2.6 化学法测定BEO清除游离基活性
BEO分别与DPPH·、ABTS+·、·OH反应,以PG、BHT为阳性对照,参考郝文凤等[17]的实验方法,通过计算IC50值比较BEO清除自由基能力的强弱。
1.2.6.1 清除DPPH·检测
用乙醇配制浓度为1.0,5.0,10.0,15.0,20.0 g/L的BEO溶液及2.0 g/L的BHT、PG溶液分别稀释到5个合适梯度作为样品溶液。向一系列25 mL比色管中分别加入2.0 mL不同浓度的样品溶液和等体积1.0×10-4mol/L的DPPH·溶液,混匀后于暗处放置30 min,以95%乙醇溶液作参比溶液,测定517 nm处的吸光值A。采用同样的方法测定样品溶液2.0 mL与2.0 mL 95%乙醇溶液混合后在517 nm处的吸光值A0。再测定2.0 mL DPPH·溶液与2.0 mL 95%乙醇混合液在517 nm处的吸光值A1。实验各平行3次,按公式(2)计算其清除率。最后通过线性回归方程得出BEO、PG、BHT清除DPPH·的IC50值。

(2)
1.2.6.2 清除ABTS+·检测
配制7.4 mmol/L的ABTS+溶液与2.6 mmol/L的过硫酸钾溶液等体积混合,摇匀后于室温下避光保存16 h。用无水乙醇稀释至吸光度在0.68~0.72之间(734 nm处)即为ABTS+·工作液。
用乙醇配制浓度为1.0,2.0,3.0,4.0,5.0 g/L的BEO溶液及2.0 g/L的BHT、PG溶液分别稀释到5个合适梯度为样品溶液。准确移取6.0 mL ABTS+·工作液和 2.0 mL不同浓度的样品液至一系列25 mL比色管中,摇匀后避光反应2.5 h,于734 nm处测定各管的吸光度A。采用同样的方法测定样品溶液2.0 mL与5.88 mL 95%乙醇溶液及0.12 mL蒸馏水混合后在517 nm处的吸光值A0。再测定6.0 mL ABTS+·溶液与2 mL 95%乙醇混合后在517 nm处的吸光值A1。实验各平行3次,按公式(2)计算其清除率。最后通过线性回归方程得出BEO、PG、BHT清除ABTS+·的IC50值。
1.2.6.3 清除·OH检测
用乙醇配制浓度为0.4×10-6,0.8×10-6,1.2×10-6,1.6×10-6,2.0×10-6g/L的精油样品溶液和2.0 g/L的BHT、PG溶液并分别稀释到5个合适梯度作为样品溶液。按顺序准确量取0.3 mL 0.4 mol/L的结晶紫溶液、1.2 mL 30 mmol/L硫酸亚铁铵溶液、0.4~2.0 mL 1×10-6g/L样品溶液和0.6 mL 40 mmol/L双氧水至一系列25 mL离心管中,分别用柠檬酸缓冲液定容至10 mL,混匀后暗处放置30 min,分别在波长580 nm处测其吸光度As。以同样的方法,测定不加入样品溶液时的吸光度Ab。再测定不加入样品溶液和双氧水时的吸光度A0;实验各平行3次,按公式(3)计算其清除率。最后通过线性回归方程得出BEO、PG、BHT清除·OH的IC50值。

(3)
1.2.7 GC-MS分析
根据参考文献[14]的方法并作一定修改对GC-MS的色谱及质谱条件进行设置。色谱条件:采用程序升温控制柱箱温度,50~140 ℃(3 ℃/min),140~185 ℃(10 ℃/min),185~230 ℃(3 ℃/min),230~280 ℃(20 ℃/min),最后在280 ℃下恒温10 min。载气(He)流速1.0 mL/min,进样量0.4 μL,分流比60∶1,质谱条件:电子轰击离子源(EI),电子束能量70 eV,传输线温度250 ℃,离子源温度250 ℃,质量扫描范围50~450 m/z。以C8~C40烷烃标准溶液计算保留指数。分析结束后,利用系统自带的Mainlib Library和Replib Library数据库结合保留指数对精油成分定性分析。
1.3 数据处理
采用Origin 2019软件作图,采用Design-Expert响应面软件对BEO提取的相关因素进行响应面优化。
2 结果与分析
2.1 BEO微波破碎过程单因素实验
按照1.2.3的方法进行实验,得到破碎功率、破碎时间和破碎温度对BEO吸光度的影响,结果见图1。
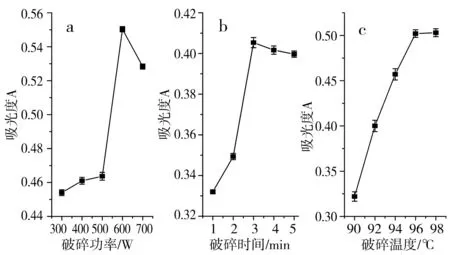
图1 单因素对BEO破碎过程的影响Fig.1 The effect of each single factor on the crushing process of BEO
由图1中a可知,BEO吸光度的变化趋势是先增加后降低,当功率增加到600 W时,其吸光度达到最大值,再增加微波功率吸光度反而减小。这可能是由于较高的微波功率可使细胞内部快速升温,以致其迅速破裂,精油几乎全部流出[18]。继续增加微波功率,精油的溶出趋于平衡,且过高的提取功率使挥发性化合物更容易损失,并导致生物活性化合物降解[19-20]。因此,BEO微波破碎过程的最佳破碎功率为600 W。
由图1中b可知,在1~3 min内,随着时间的增加,BEO溶液的吸光度快速增加,当破碎时间在3 min时,吸光度达到最大值,其原因可能是微波辐射导致植物细胞壁快速破裂,从而在更短的时间内提高提取效率[21],而随着时间延长,精油几乎全部流出,提取后期精油量不再增加。因此,BEO最适宜的微波破碎时间为3 min,而后期略有下降是由于精油易挥发的特点,也会存在一些损失[22],使得吸光度有减小的趋势。
由图1中c可知,随着破碎温度的增加,吸光度逐渐增加,在温度达到96 ℃时吸光度达到最大值,而再升高温度,吸光度值几乎不再增加。说明温度的升高有利于细胞内部的液体挥发,使得内部压强升高,从而使得精油大量流出。当精油完全流出后,吸光度值不再增加。
2.2 BEO响应面优化破碎过程设计及结果
2.2.1 响应面优化设计实验结果
根据1.2.4的方法并结合单因素实验结果设计响应面实验,以BEO吸光度为响应值,以破碎功率(A)、破碎时间(B)、破碎温度(C)为考察因素,依据Box-Behnken中心组合设计原理生成17组实验,精确实验结果并分析误差(n=3)。设计方案及实验结果见表2。
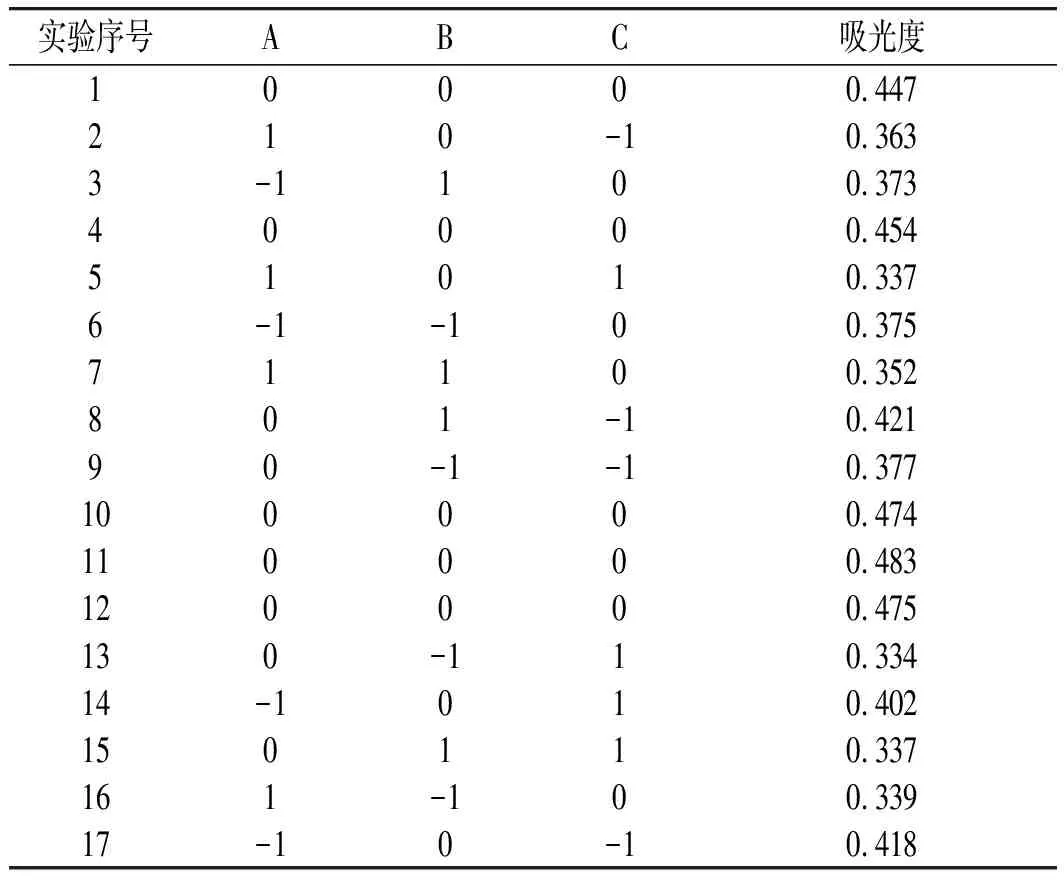
表2 响应面实验设计及结果Table 2 Response surface experimental design and results
2.2.2 回归模型的方差分析
回归模型方差分析结果及显著性检验结果见表3。根据Design-Expert软件分析,经微波破碎功率、破碎时间、破碎温度拟合得到的二次多项回归方程式为:Y=0.47-0.022A+7.25×10-3B-0.021C+3.750×10-3AB-2.5×10-3AC-0.010BC-0.047A2-0.060B2-0.040C2。

表3 响应面二次模型的方差分析Table 3 Analysis of variance of response surface quadratic model
由表3可知,回归模型相关系数R2=0.9449,由方差分析可知,回归方程模型极显著(P<0.01),而失拟项不显著,表明该方程与实际拟合中非正常误差所占比例小,拟合度较好,实验设计合理。由F值可知,各因素对响应值显著的排序为破碎功率(A)>破碎温度(C)>破碎时间(B)。
2.2.3 各因素之间的交互作用分析
通过Design-Expert软件模拟得到各因素交互作用的三维响应面图,见图2。

a.破碎时间与破碎功率

b.破碎温度与破碎功率

c.破碎温度与破碎时间
由图2可知,微波破碎功率(A)、破碎时间(B)、破碎温度(C)三者响应值的影响可以通过3D曲面图直观地看出。由图2中a可知,破碎功率所影响的吸光度值变化更加陡峭,说明破碎功率对BEO吸光度的影响更为显著,且根据方差分析结果中的显著性分析和响应曲面图可以看出,破碎功率与破碎时间的交互作用对BEO吸光度的影响极显著;由图2中b可知,破碎功率与破碎温度的交互作用对BEO吸光度的影响不显著;由图2中c可知,破碎温度所影响的吸光度值变化更加陡峭,说明破碎温度对BEO吸光度的影响更为显著,破碎温度与破碎时间的交互作用对BEO吸光度的影响极显著。
2.2.4 BEO破碎过程最佳条件的确定
由响应面优化实验模型得到BEO的最优破碎条件为:破碎功率600.32 W,破碎温度96.42 ℃,破碎时间180.50 s。预测在此最优条件下BEO溶液的吸光度为0.483。为验证模型的可靠性,并考虑实验可操作性,以修正后的破碎工艺参数:功率600 W,时间180 s,温度96 ℃,进行3次重复实验,测定结果BEO溶液的吸光度平均值为0.465,与响应面回归方程理论值结果接近,相对误差为-3.73%,由此结果可知,响应面优化的BEO超声-微波辅助水蒸气蒸馏法破碎条件可靠,该破碎工艺具有科学价值。
2.3 化学法测定BEO的抗氧化能力
按照1.2.6的实验方法进行实验,结果见图3~图5和表4。

图3 各样品对DPPH自由基的清除率Fig.3 The scavenging rates of each sample on DPPH radicals

图4 各样品对ABTS+自由基的清除率Fig.4 The scavenging rates of each sample on ABTS+ radicals

图5 各样品对OH自由基的清除率Fig.5 The scavenging rates of each sample on OH radicals
由图3~图5可知,随着BEO以及阳性对照组浓度的增大,其对DPPH、ABTS+、OH自由基的清除率增大,表明3组样品的自由基清除能力也在逐渐增强。
通过对图3~图5中方程进行线性拟合得到BEO、PG、BHT对清除DPPH、ABTS+、OH自由基的IC50值,结果见表4。

表4 化学法评价BEO抗氧化能力Table 4 The antioxidant capacity of BEO evaluated by chemical method
由表4可知,BEO和阳性对照PG、BHT对清除DPPH自由基的IC50分别为1.82,1.8×10-3,3.83×10-2mg/mL,表明BEO具有一定的清除DPPH自由基能力,但其IC50远大于PG、BHT,表明其清除能力较PG、BHT弱;BEO、PG、BHT对清除ABTS+自由基的IC50分别为12.89,2.09×10-3,6.9×10-3mg/mL,表明BEO具有一定的清除ABTS+自由基能力,但其IC50仍远大于PG、BHT,表明其清除能力较PG、BHT弱;BEO、PG、BHT对清除OH自由基的IC50分别为0.92×10-6,0.72×10-3,1.10×10-3mg/mL,表明BEO具有较强的清除OH自由基能力,其IC50远小于PG、BHT,表明其清除能力较PG、BHT强。由数据对比可知,BEO对自由基清除能力强弱比较为·OH>DPPH·>ABTS+·。
2.4 BEO化学成分GC-MS分析结果
按照1.2.7 的程序条件进行实验,全扫描得到的GC-MS总离子流图见图6,通过标准谱库比对结合保留指数分析检测BEO的化学成分,结果见表5。

图6 BEO的GC-MS总离子流图Fig.6 GC-MS total ion chromatogram of BEO

表5 BEO化学成分的GC-MS检测结果Table 5 The chemical compositions of BEO analyzed by GC-MS
由表5可知,从BEO中共分离检测出29种化学成分,占总精油含量的97.48%,主要为萜类化合物,主要成分有樟脑(31.47%)、香叶醇(16.29%)、1,8-桉叶素(8.11%)、香叶醛(6.83%)、反式桂皮酸甲酯(5.82%)、异龙脑(4.15%)、β-罗勒烯(3.49%)、(Z)-柠檬醛(2.78%)、油醇(2.56%)、α-罗勒烯(2.50%)等。根据化学成分的结构,可以初步分析清除3种自由基强弱的清除机理。Nie等[23]研究得出α-松油醇、香叶醇具有较强的清除DPPH自由基的能力,其机理是由于α-松油醇、香叶醇中含有羟基结构,且环状结构对羟基清除DPPH自由基活性具有促进作用(反应历程见图7中a);对于BEO清除ABTS+自由基的能力,可能是由于1,8-桉叶素和α-蒎烯氧化物等具有特殊的环醚结构的作用[24-25](反应历程见图7中b),而BEO对该自由基表现出最弱清除能力的原因可能是BEO中的大部分物质遇到ABTS+自由基时,不容易提供氢而发生反应[26];对于清除OH自由基,由于成分主要为萜类物质,且化学成分中萜烯类化合物较多,有α-蒎烯、莰烯、月桂烯、β-罗勒烯、α-罗勒烯、葎草烯、α-法呢烯等,其分子中都含有双键以及碳碳双键的共轭体系,因此易与OH自由基发生加成反应形成二级基团而清除大量OH自由基[27-28](反应历程见图7中c)。因此,从数量上以及结构上均可以说明BEO清除OH自由基的能力最强。

图7 BEO清除DPPH、ABTS+、OH自由基反应历程Fig.7 The reaction process of BEO scavenging DPPH, ABTS+ and OH radicals
3 结论
本实验通过单因素实验和响应面法利用超声-微波辅助提取法首次探索BEO的最佳提取工艺,建立了影响精油破碎过程的3个主要因素(微波破碎功率、破碎时间和破碎温度)的回归模型。同时,在此程序下,通过单因素实验得到在料液比为1∶15(g/mL)、提取功率为500 W、提取时间为25 min时,精油得率最高,达2.86%。BEO通过化学法对比天然人工合成抗氧化剂PG、BHT得到其对3种自由基(DPPH、ABTS+、OH自由基)的清除能力,结果表明,BEO清除DPPH、ABTS+自由基能力较PG、BHT弱,而清除OH自由基能力较PG、BHT强,在抗氧化活性方面具有很高的研究价值。且通过GC-MS分析鉴定出29种化合物,其主要成分为樟脑(31.47%)、香叶醇(16.29%)、1,8-桉叶素(8.11%)、香叶醛(6.83%)、反式桂皮酸甲酯(5.82%)、异龙脑(4.15%)、β-罗勒烯(3.49%)。从化学成分可以初步分析BEO对3种自由基表现出不同活性的机理。文章首次探索BEO的提取工艺,此方法简单方便、绿色且精油得率高,为今后BEO的相关研究提供了基础,同时对其清除游离基活性进行评价以及成分分析,有益于凹唇姜这一药食同源的天然植物资源的开发利用,并为天然抗氧化剂的开发提供了理论参考。
