基于可培养法与高通量测序对大头菜致腐菌筛选及细菌结构分析
2022-06-05刁体伟陈晓姣魏鑫赖晓琴冷银江马懿
刁体伟,陈晓姣,魏鑫,赖晓琴,冷银江,马懿
(四川轻化工大学 生物工程学院,四川 宜宾 644000)
腌制大头菜因独特的人文因素和地理环境成为了川蜀之地家喻户晓的酱腌菜,在口感上鲜、香、嫩、脆、甜、辣更是一绝[1]。随着时代的发展和人们生活质量的提高,对榨菜品质的要求也逐渐提升,发酵调味品的低盐化已经成为榨菜行业的潮流热点[2]。低盐腌制大头菜较高盐量而言,能更好保留榨菜原生营养,降低和延缓亚硝酸盐的峰值出现,从而提高产品质量安全;但在低盐条件下较易被微生物侵染,货架期缩短,很容易发生胀气腐败的现象[3]。工业榨菜灭菌方式多采用水浴加热(85 ℃)灭菌,而每逢三、四月份货架上低盐真空袋装大头菜多出现“胖袋”现象,胀气后的袋装大头菜脆度变软、颜色发黑并且有刺鼻难闻的气体,让产品失去商业价值。若要延长低盐大头菜的保质期,需对腌制大头菜胀气的原因与机理进行深入研究和解决。现有研究显示腌制榨菜胀袋主要是由微生物的繁殖代谢所导致[4]。
对于胀气、产膜腐败菌的筛选和鉴定多用传统培养基法,且多数致腐菌为枯草芽孢杆菌、巨大芽孢杆菌、坚强芽孢杆菌等[5]。而目前对低盐大头菜货架期及胀袋菌群结构的认识还比较匮乏,仅依靠传统培养基法并不能完全揭示胀袋原因及其微生物演替变化,从而导致生产者缺乏有效的灭菌方法。高通量测序能很好揭示微生物物种组成和丰度信息,是研究样品中微生物群落组成结构的重要手段[6]。研究者们通过高通量测序检测冷藏小龙虾[7]与涨壶醋[8]中优势腐败菌菌群结构,结果发现致腐原因多以细菌为主,真菌为辅。当前研究鲜有用高通量测序法对胀袋低盐腌制榨菜中细菌群落进行分析,因此本试验以货架期胀气和未胀气大头菜为样本,通过高通量测序从基因水平分析两组大头菜之间细菌组成的差异性和相似性,了解货架期胀袋大头菜菌群结构组成,寻找和确定引起胀袋问题的优势腐败菌;并用传统培养法筛选、验证腐败菌并进行热致死率探究。本研究致力于促进低盐腌制榨菜灭菌工艺改进,同时为以后鉴别腌制榨菜产品优劣提供技术和理论基础。
1 材料与方法
1.1 材料采集与保存
试验样本采用同一批次货架期胀气和未胀气低盐腌制大头菜,由无菌采样袋于4 ℃运回实验室,在超净工作台上将胀气大头菜组(3袋)和未胀气大头菜组(3袋)分别编号为R1(D1、D2、D3)和R2(D4、D5、D6);在无菌环境下每个大头菜用五点取样法取样待用。
1.2 材料与仪器
真空袋装腌制大头菜:宜宾戎陈坊食品有限公司。
HWS-12型电热恒温水浴锅 上海齐欣科学仪器有限公司;BM1000型生物显微镜 南京江南永新光学有限公司;DSX-18L型手提式高压蒸汽灭菌器 上海申安医疗器械厂;5020型PCR 基因扩增仪 赛默飞世尔科技(中国)有限公司;DYY-8C型电泳仪 北京六一生物科技有限公司;Gene JET胶回收试剂盒 Thermo Scientific公司;Phusion®High-Fidelity PCR Master Mix with GC Buffer New England Biolabs公司;Ion Plus Fragment Library Kit 48 rxns建库试剂盒 ThermoFisher公司。
1.3 方法
1.3.1 基因组总DNA的提取与PCR扩增
采用CTAB法[9]对样本的基因组总DNA 进行提取,将样本DNA稀释成1 ng/μL作为模板进行PCR扩增。细菌PCR扩增引物:515F(5′-GTGYCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACNVGGGTWTCTAA-3′);PCR反应在30 μL中进行,使用15 μL的Phusion®High-Fidelity PCR Master Mix (New England Biolabs)、0.2 μmol/L的正向和反向引物以及大约10 ng的模板DNA。热循环包括98 ℃的初始变性1 min,然后98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s,30个循环,72 ℃彻底延伸5 min,最后于4 ℃保存。
1.3.2 文库构建和上机测序
PCR产物经纯化[10]送往天津诺禾致源生物信息科技有限公司经过文库检测合格后,使用ThermoFisher的IonTMS5XL进行上机测序。
1.3.3 测序数据处理
使用Cutadapt[11]先对reads进行低质量部分剪切,根据Barcode从得到的reads中拆分出各样品数据,将reads序列与物种注释数据库进行比对检测嵌合体序列,去除其中的嵌合体序列得到最终的有效数据(clean reads)[12-13]。利用Uparse软件[14]对所有样品的全部clean reads进行聚类,默认以97%的一致性(identity)将序列聚类成为OTUs(operational taxonomic units),用Mothur法与SILVA132的SSU rRNA数据库对OTU进行物种注释分析。
1.3.4 致腐菌的筛选和鉴定[15]
在无菌操作台(无氧和有氧)上取D1、D2、D3大头菜10 g绞碎于90 mL无菌蒸馏水中,经摇匀后制成样品菌悬液。选择合适稀释梯度涂布于牛肉膏蛋白胨培养基。将不同形态学菌落挑选出进行划线纯化培养3次,分离纯化后的菌株进行产气(杜氏试管)产酸验证试验,再将筛选出的菌株进行革兰氏染色。以细菌通用引物27F(5′-AGAGTTTGATCCTGGCGCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩展。PCR产物用2%的琼脂糖凝胶电泳进行检测并将其送至成都擎科生物科技公司进行测序,将所得序列在NCBI上进行序列比对。
1.3.5 致腐菌耐高温探究
用水浴加热灭菌和高压蒸汽灭菌(121 ℃/103 kPa)对腐败菌进行耐高温灭活探究。将基于培养基法筛选得到的腐败菌培养24 h,每隔2 h测一次吸光度并绘制生长曲线,取生长旺盛时段(对数期)用水浴加热法(85 ℃/5 min;90 ℃/5 min;95 ℃/5 min;85 ℃/10 min;90 ℃/10 min;95 ℃/10 min;85 ℃/15 min;90 ℃/15 min;95 ℃/15 min)和高温瞬时法(121 ℃/45 s;121 ℃/60 s;121 ℃/75 s)进行灭活试验。每个条件设立3个平行并用平板计数法计活菌数,取平均值以探究腐败菌的耐受性,新鲜腌制大头菜也做相同高温处理。
2 结果与分析
2.1 高通量测序样本数据统计与OTU分析
对6个样品16S V4区测序后,平均每样品测得82176条reads,平均长度为410 bp,经过质控平均得到77866条有效数据,质控有效率达94.72%,结果见表1,测序所得的有效序列达到细菌多样性分析的要求。以97%的一致性将序列聚类成为OTUs(operational taxonomic units),根据胀气组(R1)和未胀气组(R2)OTU制作韦恩图(见图1),共得到678个OTUs;其中胀气组OTU有370个,未胀气组有629个,共同拥有321个,说明未胀气和胀气大头菜在货架期主要物种组成较为相似,R1组优势腐败菌会抑制其他微生物的生长,其特有的49个OTU极有可能是引起大头菜胀气的主要原因。对OTUs序列与Silva 132数据库进行物种注释,注释结果中共有671(98.97%)个OTU注释到门水平,有496(73.16%)个OTU注释到属水平。

表1 测序数据统计结果Table 1 Statistical results of sequencing data

图1 胀气组(R1)和未胀气组(R2)OTU韦恩图Fig.1 OTU Venn diagram of the bulging-bagged group (R1)and the well-packed group (R2)
2.2 物种多样性分析(Alpha)
Alpha Diversity 多样性指标可以反映样本内的微生物群落物种的丰富度、多样性和测序深度。α-多样性分析指数测定结果见表2,测定显示样本覆盖率都达到99.9%,序列检测全面充足。其中未胀袋D4、D5、D6的OTU数、Shannon指数、Chao1指数要高于胀袋D1、D2、D3,说明未胀袋大头菜中微生物群落多样性和丰富度要高。原因可能是腐败菌繁殖抑制其他微生物的生长,导致其他微生物不易存活,胀袋大头菜中腐败菌成为优势菌,导致环境酸度过高,营养缺失过多。

表2 Alpha多样性指数Table 2 Alpha diversity indexes

a

b
稀释曲线(rarefaction curve)通过统计代表物种数目(OTUs)来描述组内样本多样性,直接反映测序数据量的合理性,并间接反映样本中物种的丰富程度[16]。由图2中a可知,样本测序数超过40000时,稀释曲线趋于平缓,表明本次测序数据的合理性,已经基本覆盖样本中所有物种。在相同的测序深度下,比较R1组和R2组榨菜中OTU数,结果显示未胀气大头菜R2组中物种多样性更高。
等级聚类曲线(rank abundance curve) 在水平方向曲线的宽度可反映物种的丰富度,在垂直方向曲线的平滑程度可以反映样本中物种的均匀程度。由图2中b可知,胀气组R2横坐标跨度相对较大,表明其所含物种丰富度较大;垂直方向R2组曲线相对R1较为平缓,表明R2组中物种分布较为均匀,R1组中物种分布不均,原因可能是胀气R1组中存在的腐败菌群比例较大,位置较为集中。
2.3 细菌群落结构分析
2.3.1 基于门水平群落结构分析
在门水平上,选取丰度排名前十的物种,生成物种相对丰度柱形累加图(见图3),以便直观查看R1组和R2组在门分类水平上相对丰度较高的物种及其比例。
由图3可知,胀气组R1中门水平上含量大于1%的菌群群落有变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria);分别占77%、13.1%、5.6%、3.4%。未胀气组R2中含量大于1%的有变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),分别占42%、44%、4.4%、3.6%、1.1%。相比较而言,两组总体菌门物种大体相似,但是含量有很大差异。可见货架期大头菜从未胀气到胀气过程中,优势菌群发生了巨大改变,其中R1组优势菌变形菌门含量达77%,远高于未胀气R2组中的含量;蓝细菌门细菌比例减少。两组厚壁菌门变化不大,原因可能是此门细菌能产生芽孢,易在高盐高酸中生长,适应较为极端环境而不易被抑制[17]。R2组大头菜中芽单胞菌门(Gemmatimonadetes)和异常球菌属-栖热菌门(Deinococcus-Thermus)占比微量,在发生胀气后被抑制生长。
2.3.2 基于属水平群落结构分析
在属水平上物种相对丰度前三十的菌数见图4,胀气组R1中属水平上含量较大的菌群群落有unidentified_Rickettsiales(65.9%)、unidentified_Cyanobacteria(13.2%)、肉胞菌属(Carnimonas,8.9%)、谷氨酸杆菌(Glutamicibacter,2.0%)、芽孢杆菌属(Bacillus, 1.3%)、乳杆菌属(Lactobacillus,0.6%)、假单胞菌属(Pseudomonas, 0.5%)。未胀气组R2属水平上丰度较大的有unidentified_Cyanobacteria(44.5%)、unidentified_Rickettsiales(23.3%)、肉胞菌属(Carnimonas,3.6%)、乳杆菌属(Lactobacillus,2.9%)、unidentified_Rhizobiaceae(2.1%)、马赛菌属(Massilia,1.7%)、嗜盐单胞菌属(Halomonas,1.3%)、不动杆菌属(Acinetobacter,1.2%)和鞘氨醇单胞菌属(Sphingomonas,1.1%)。比较R1组与R2组的物种丰度,结果显示R2组物种丰富度较高,组间物种丰度变化明显。R1中unidentified_Rickettsiales丰度增加了21.4%,unidentified_Cyanobacteria丰度减少了10.1%,肉胞菌属增加了5.3%,另外芽孢杆菌属为新增菌属,组间物种差异含量与新增菌属芽孢杆菌极有可能就是引起腌制大头菜胀气的主要原因[18]。

图4 胀气组R1和未胀气组R2物种相对丰度图(属水平)Fig.4 Relative abundance of bulging-bagged group R1 and well-packed group R2 (genus level)
2.3.3 样本间差异性分析
基于OTU水平两组大头菜样本的主成分分析(PCA,principal component analysis)结果展示见图5,PC1和PC2分别在样品差异性贡献率上达到52.89%和20.77%,是差异的主要来源。R1胀气组在PCA图中的距离十分接近,说明3个样本细菌群落组成相似度较高;未胀气组R2的3个样本距离相距较远,原因可能是在加工腌制时加盐搅拌不均匀,灭菌不全面,导致每个样本上市时初始环境有所差异从而影响细菌生长情况不一。总体而言,未胀气组与胀气组群落组成差异显著。
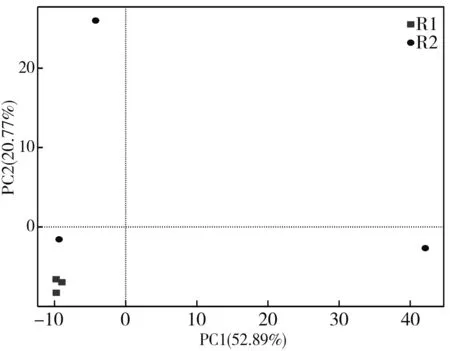
图5 胀气组与未胀气组PCA分析Fig.5 PCA analysis of bulging-bagged group and well-packed group
LEfSe(LDA effect size)结合统计意义和生物相关性可比较组间差异性显著的物种,LDA值分布柱状图见图6。胀气组和未胀气组中丰度差异显著的物种,柱状图的长度代表差异物种的影响大小。通过对R1~R2的LEfSe分析,我们发现LDA值>4的biomarker共有12个。差异性显著的物种有:在门水平上R2组中的蓝细菌门(Cyanobacteria)和R1中的变形菌门(Proteobacteria);在科水平上R2组中伯克氏菌科(Burkholderiaceae)和根瘤菌科(Rhizobiaceae);在属水平上R2组中unidentified_Cyanobacteria和unidentified_Rickettsiales。

图6 LDA值分布柱状图Fig.6 LDA value distribution histogram
2.4 物种丰度聚类热图
根据样本在属水平上物种注释和丰度信息选取排名前三十五的菌属绘制成热图,以便分析出物种在R1组与R2组中的聚集和含量情况。两组大头菜对比结果见图7,胀气组R1相对于未胀气组R2聚集较多的菌属有:芽孢杆菌属(Bacillus)、肉胞菌属(Carnimonas)、类节杆菌属(Paenarthrobacter)、谷氨酸杆菌(Glutamicibacter)和束毛球菌属(Trichococcus)。这些细菌可能是导致腌制大头菜变酸胀气的主要原因,更能适应后期变质后的生存环境。王向阳等[19]在腌制萝卜干中发现蜡样芽孢杆菌和枯草芽孢杆菌是引起变质的主要腐败菌。未胀气组R2中优势菌种类相对较多,有假单胞菌属(Psedomonas)、 嗜盐单胞菌属(Halomonas)、鞘氨醇单胞菌属(Sphingomonas)、魏斯氏菌属(Weissella)等。总体而言,R1组相对于R2组中细菌多样性较低,优势菌种较少,原因可能是胀袋中腐败菌抑制了其他菌种生长发育。
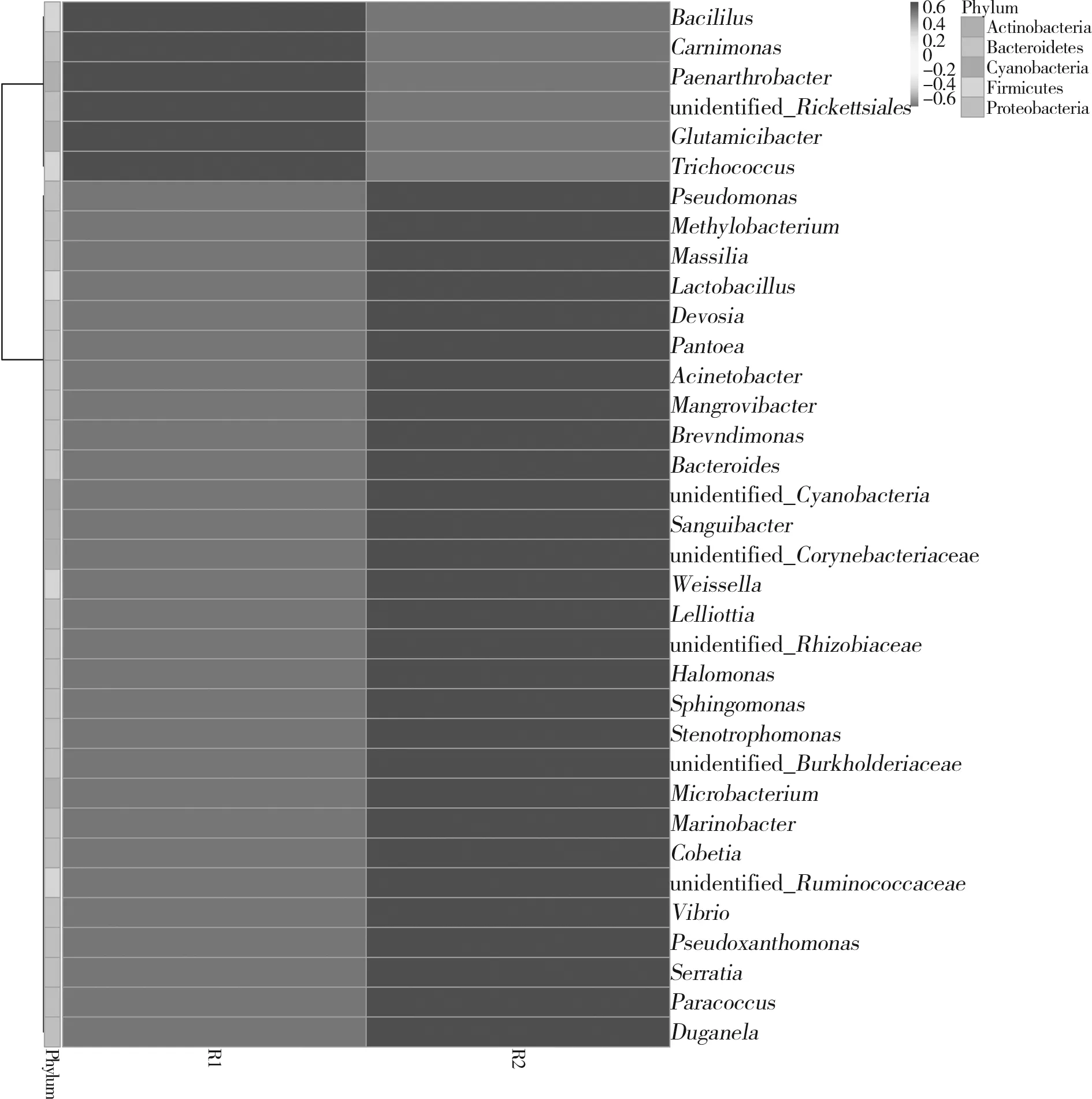
图7 属水平上物种丰度聚类热图Fig.7 Clustering heat map of species abundance at genus level
2.5 传统培养法结果
从胀袋大头菜中共筛选出2株产气腐败菌,对分离得到的菌株进行形态学观察、革兰氏染色(见图8)和16S rDNA基因鉴定。结合NCBI比对结果(见表3)及菌落特征表明腐败菌株为解淀粉芽孢杆菌(N3)和枯草芽孢杆菌(N5),这与高通量测序结果相符。

表3 菌株16S rDNA基因比对结果Table 3 Compatison results of 16S rDNA genes of the two strains
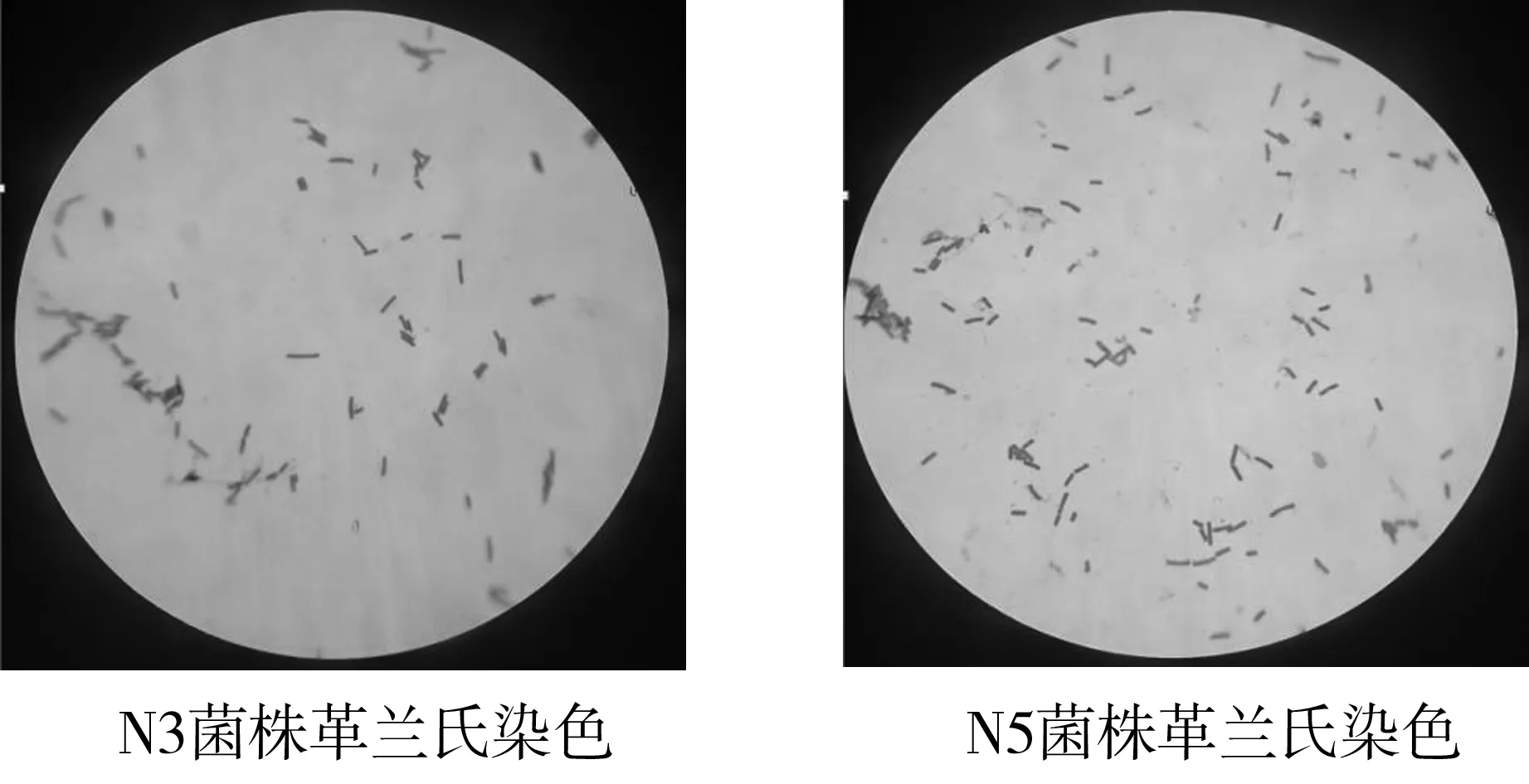
图8 N3和N5革兰氏染色Fig.8 N3 and N5 Gram staining
2.6 致腐菌耐高温结果
采用水浴灭菌(见图9)和高压蒸汽瞬时法(见表4)对N3和N5两种芽孢杆菌(103CFU/mL)进行灭活试验,结果显示水浴灭菌法随着温度的升高和处理时间的延长灭菌效果越好,然而在95 ℃条件下处理15 min仍无法完全灭活两种芽孢杆菌,解淀粉芽孢杆耐热性更强。此外,水浴高温长时处理榨菜后硬度和脆度明显降低,最佳口感丧失,因而工业生产仅依靠水浴加热灭菌并不能完全杀死芽孢杆菌,仍可能会导致大头菜在货架期产生胀袋现象。高温瞬时法60 s(121 ℃/103 kPa)基本能杀灭细菌且保持榨菜较好的口感,因而为解决胀气问题,延长榨菜保质期,高温瞬时法或许可被考虑应用于工业中。

表4 高压蒸汽灭菌时间对N3、N5腐败菌致死率的影响Table 4 Effects of high-pressure steam sterilization time on the lethal rate of spoilage bacteria N3 and N5
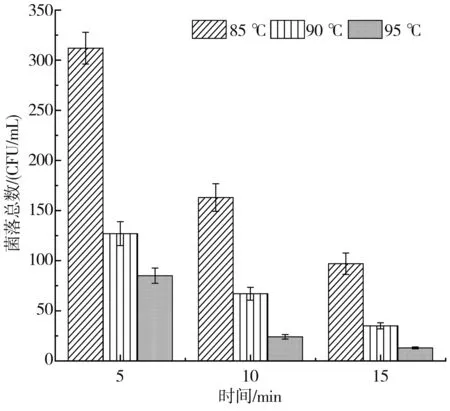
a.N3耐热性测定
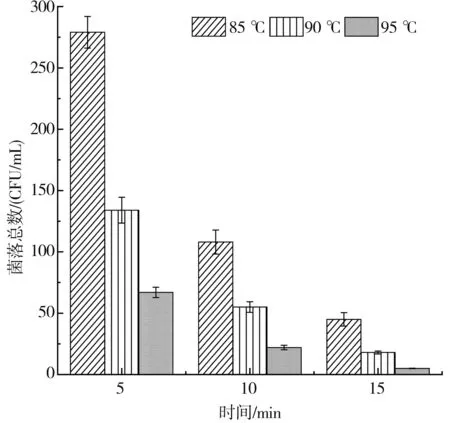
b.N5耐热性测定
3 结论与讨论
本次试验使用高通量测序技术对货架期未胀袋和胀袋大头菜细菌群落结构进行比较分析,探究大头菜胀袋原因及腐败细菌菌群结构;再用培养基法对腐败菌进行筛选、验证及热致死率研究。结果表明,样本细菌测序得到77866条有效序列,聚类分析产生678个OTU,其中大头菜未胀气组(R2)细菌种群多样性较高。R2在货架期主要优势菌群有unidentified_Cyanobacteria、unidentified_Rickettsiales、肉胞菌属、乳杆菌属、unidentified_Rhizobiaceae、马赛菌属、嗜盐单胞菌属、不动杆菌属等;胀气大头菜主要优势菌为unidentified_Rickettsiales、unidentified_Cyanobacteria、肉胞菌属、谷氨酸杆菌、芽孢杆菌属。在属水平上、两组相比较差异性显著的菌群有unidentified_Cyanobacteria和unidentified_Rickettsiales,差异性显著菌属以及新增芽孢杆菌菌属可能是引起大头菜在货架期胀气的主要原因。为验证主要致腐菌及胀气原因,以产气产酸为指标用培养基法在胀袋大头菜中筛选出了解淀粉芽孢杆菌与枯草芽孢杆菌,与R1组高通量测序结果的芽孢杆菌相符,因而芽孢杆菌是引起榨菜胀气的主要原因。两种芽孢杆菌耐受热性强,95 ℃条件下水浴加热15 min仍不能完全灭活,而60 s高温瞬时法(121 ℃/103 kPa)在保证大头菜脆度的同时灭菌效果较好。高通量测序结果中还有大量微生物菌群不能被培养基筛出,两种方法结果存在差异,其原因可能是实验室培养基法只能培养部分细菌,目前可培养微生物只占自然界微生物的1%,纯培养基法无法全面地揭示样本中所有菌群结构[20]。腌制工艺的低盐度能提升口感和营养,但不能忽略自身安全质量问题,低盐腌制确实会存在被微生物侵染、缩短货架期的问题,传统水浴灭菌不能保证低盐榨菜较长货架期。本次试验全面揭示了货架期胀袋和未胀袋低盐大头菜的菌群结构并进行了差异性分析,可为后期研究抑制优势腐败菌、延长低盐大头菜货架期提供参考。
