降解亚硝酸盐乳酸菌的筛选鉴定及发酵特性研究
2022-06-05胡蝶赵鑫张素平祁勇刚吴勇超高冰柳志杰
胡蝶,赵鑫,张素平,祁勇刚,3,吴勇超,高冰,3,柳志杰,3*
(1.湖北工业大学 生物工程与食品学院 湖北省食品发酵工程技术研究中心,武汉 430068;2.湖北聚汇农业开发有限公司,湖北 荆门 431821;3.湖北省发酵蔬菜企校联合创新中心,湖北 荆门 431821)
泡菜是中国传统发酵食品之一,各地做法不一;大多是由圆白菜等大宗蔬菜经食盐腌渍后发酵而成。冷加工方式保护了蔬菜中营养物质并使其具备贮藏性质,在一定程度上可以调节蔬菜因季节变化而带来的供需关系和解决蔬菜浪费问题[1-2]。泡菜的独特口感和丰富的营养价值赢得消费者的喜爱,但泡菜中的亚硝酸盐等有害物质阻碍了泡菜的进一步发展[3]。原料中硝酸盐的含量增加、发酵过程中的杂菌污染等因素都会造成泡菜中亚硝酸盐含量增高。过量摄入亚硝酸盐会导致高铁血红蛋白症,同时长期食用高亚硝酸盐含量的食品会增加患癌几率[4]。因此,对于泡菜,控制和减少其亚硝酸盐含量极其重要。
研究表明,乳酸菌能够有效降解亚硝酸盐,几乎所有的乳酸菌都能产亚硝酸盐还原酶(NiR),在厌氧条件下可将亚硝酸盐还原为NH4+或N2[5-8]。此外,乳酸菌是泡菜发酵过程中优势种群之一[9-10]。乳酸菌产生乳酸等有机酸不但可以调节酸度,丰富泡菜口感,还可以抑制杂菌与部分有害菌的生成[11-14]。研究表明,泡菜是国内外乳酸菌菌种较为重要的来源之一,且乳酸菌用途较为广泛[15]。乳酸菌或作为益生菌改善肠道微环境,或作为工业菌种进行传统食品工业化,或作为功能性成分添加以期开发食品新品种。
本实验采用传统方法从泡菜中分离出乳酸菌,研究其降解亚硝酸盐能力,探究其耐盐、产酸和抗氧化等特性。该研究从泡菜中分离并筛选出具有亚硝酸盐降解能力和抗氧化能力的优良乳酸菌,为低亚硝酸盐泡菜的生产提供了理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
泡菜(酸白菜):取自湖北聚汇农业开发有限公司泡菜车间,用无菌袋收集,于4 ℃冰箱中保存备用。
1.1.2 试剂
硼砂、乙酸锌、亚铁氰化钾、对氨基苯磺酸、盐酸萘乙二胺、亚硝酸钠、铁氰化钾、三氯乙酸、NaCl、HCl、DPPH、PBS:分析纯,国药集团化学试剂有限公司;2×Taq Master Mix试剂(试剂中含有染料):购于天根生化科技(北京)有限公司;细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、1492R(5′-ACGGTTACCTTGTTACGACTT-3′):均由苏州金唯智生物科技有限公司合成。
1.1.3 培养基
1.1.3.1 固体MRS培养基
蛋白胨10.0 g/L,牛肉膏8.0 g/L,酵母粉4.0 g/L,磷酸氢二钾2.0 g/L,柠檬酸氢二铵2.0 g/L,乙酸钠5.0 g/L,葡萄糖20.0 g/L,吐温80 1.0 g/L,硫酸镁0.2 g/L,硫酸锰0.04 g/L,琼脂粉15.0 g/L,115 ℃灭菌20 min。
1.1.3.2 液体MRS培养基
蛋白胨10.0 g/L,牛肉膏8.0 g/L,酵母粉4.0 g/L,磷酸氢二钾2.0 g/L,柠檬酸氢二铵2.0 g/L,乙酸钠5.0 g/L,葡萄糖20.0 g/L,吐温80 1.0 g/L,硫酸镁0.2 g/L,硫酸锰0.04 g/L,115 ℃灭菌20 min。
1.1.4 仪器
ZXSR-1270恒温培养箱 上海智城分析仪器制造有限公司;DELTA320 pH计、ME54E微量天平 梅特勒-托利多有限公司;HCB-1300V垂直层流超净工作台 海尔生物医疗股份有限公司;CR21N落地式高速冷冻离心机 日本Hitachi公司;UV-1601紫外可见分光光度计 北京瑞丽分析仪器有限公司。
1.2 方法
1.2.1 乳酸菌的分离纯化
取发酵液100 μL加无菌水稀释至1000 μL,并进行梯度稀释,分别取10-4,10-5,10-6,10-7这4个梯度的发酵液200 μL,涂布于MRS培养基平板上,放入37 ℃恒温培养箱中厌氧培养20 h后,用接种环挑取单菌落,平板划线,37 ℃培养。重复划线,传代3次,得到单菌落,转入MRS液体培养基,所得菌液按1∶1(菌液∶50%甘油)加入保藏管,编号,并于-80 ℃冰箱中保藏。
1.2.2 乳酸菌的鉴定
将1.2.1中甘油管中的菌株活化,并置于液体培养基中培养24 h。参照文献[8]的方法进行16S rDNA分子生物学鉴定。PCR扩增条件:94 ℃ 1 min,98 ℃ 10 s,56 ℃ 20 s,55 ℃ 30 s,30个循环;72 ℃ 5 min;4 ℃保存。
PCR扩增产物送至苏州金唯智生物科技有限公司测序。将测序结果提交至NCBI(https://blast.ncbi.nlm.nih.gov/)进行BLAST同源性比对,选取同源性较高的模式菌株16S rDNA序列,采用MEGA 10.0软件中的邻接法(neighbor joining,NJ)构建系统发育树。
1.2.3 降亚硝酸盐的菌株筛选
将活化好后的菌株按1%接种量接种至亚硝酸钠浓度为200 μg/mL的培养基中,37 ℃厌氧培养,分别在12,24,36,48,60,72 h取样检测亚硝酸钠的含量。参考国标GB 5009.33-2016和文献[16-17]采用盐酸萘乙二胺法测定亚硝酸盐,并作改动。样品预处理:取5 mL菌液于50 mL带塞比色管中,加入饱和硼砂溶液12.5 mL,蒸馏水20.0 mL,混合均匀,置于沸水浴中加热15 min。待冷却后加入乙酸锌5.0 mL摇匀,再加入亚铁氰化钾5.0 mL,加水至刻度线,摇匀。混合液倒入250 mL离心管中,并加水50 g,4000 r/min离心10 min;将溶液过滤,取中间澄清溶液供后续测定。样品测定:吸取2 mL处理液于50 mL比色管中,加入40 mL蒸馏水,混匀。加入2 mL对氨基苯磺酸,摇匀,避光静置5 min;加入1 mL盐酸萘乙二胺溶液混匀,并加水到刻度线,避光静置15 min,于波长538 nm处测定吸光度值,并对照标准曲线回归方程计算亚硝酸盐含量。
1.2.4 生长曲线的测定
将活化后菌株按1%的接种量接种于MRS液体培养基中,37 ℃培养24 h,并且每隔2 h测OD值。
1.2.5 耐盐性的测定
耐盐性[18]:将其按照1%接种量分别添加于含有0%、2%、4%、6%、8%、10%(W/V)NaCl的MRS液体培养基中,37 ℃ 恒温培养36 h,于波长600 nm处测定吸光度值。
1.2.6 产酸能力的测定[19]
将活化好后的菌种按1%接种量接种至MRS液体培养基中,37 ℃培养 24 h,测发酵后的pH,实验重复3次。
1.2.7 抗氧化分析
细胞悬浮液制备:菌种活化3代后,5000 r/min离心10 min,弃上清液,无菌水洗涤3次,重悬调整菌液浓度为1×108CFU/mL (OD595 nm=1.0)。
无细胞提取物制备:对细胞悬浮液进行离心破碎处理,电镜检查无完整细胞,离心收集上清液[20]。
1.2.7.1 DPPH清除能力的测定
根据参考文献[21]略作改进:向2 mL待测液中加入0.2 mmol/L DPPH-无水乙醇溶液2 mL,混匀,避光反应30 min,9000 r/min离心10 min,取上清液于波长517 nm处测吸光度值。其中对照组用纯水代替DPPH,空白组用无水乙醇代替DPPH。
1.2.7.2 还原能力的测定
参考刘洋等[22]的方法:向0.5 mL待测液中依次加入0.5 mL 的0.2 mol/L PBS溶液(pH 6.6)、1%铁氰化钾溶液,混匀,50 ℃水浴20 min;迅速冷却后加入0.5 mL的10%三氯乙酸,4000 r/min离心5 min;取上清液、蒸馏水、0.1%三氯乙酸各1 mL混匀,静置,反应10 min,于波长700 nm处测定其吸光度值。吸光度值越大,还原能力越强。
2 结果与分析
2.1 乳酸菌的分离与鉴定
按照乳酸菌的菌落特征进行单菌落的挑选,随后从样品中共分离得到5株疑似乳酸菌菌株,分别命名为L2、L6、L7、L11和L18。经过鉴定,分别为醋酸菌、根瘤菌和乳酸菌,见表1;其中3株乳酸菌分别属于两个不同的属,分别为乳酸杆菌属(Lactobacillus)和明串珠球菌(Leuconostoc)。

表1 乳酸菌16S rDNA序列鉴定结果Table 1 Identification results of 16S rDNA sequences of lactic acid bacteria
确定实验菌株为乳酸菌L7、L11和L18,从NCBI中查找其已知乳酸菌菌株的16S rDNA基因序列和其亲缘性近的菌株16S rDNA基因序列,在MEGA 10.0中构建进化树,结果见图1。

图1 乳酸菌的进化树Fig.1 Phylogenetic tree of lactic acid bacteria
2.2 降解亚硝酸盐能力
亚硝酸盐是食品中较为关注的指标,也是发酵蔬菜中最容易产生的有害物质。3株乳酸菌在72 h降解亚硝酸盐的能力见图2,L7的降解能力为(114.19±2.46) mg/L;L11的降解能力为(104.26±3.68) mg/L;L18的降解能力为(128.70±4.85) mg/L。0~48 h时,亚硝酸盐的含量会随着时间的增加而减少。研究表明[23],乳酸菌降解亚硝酸盐的途径可分为酸降解和产生亚硝酸盐还原酶;当环境pH<4.0时,降解途径才以酸降解为主;当环境pH>4.5时,降解途径才以酶降解为主。结合实验中24 h发酵后的pH值,分析可知实验过程中两种降解途径都存在。
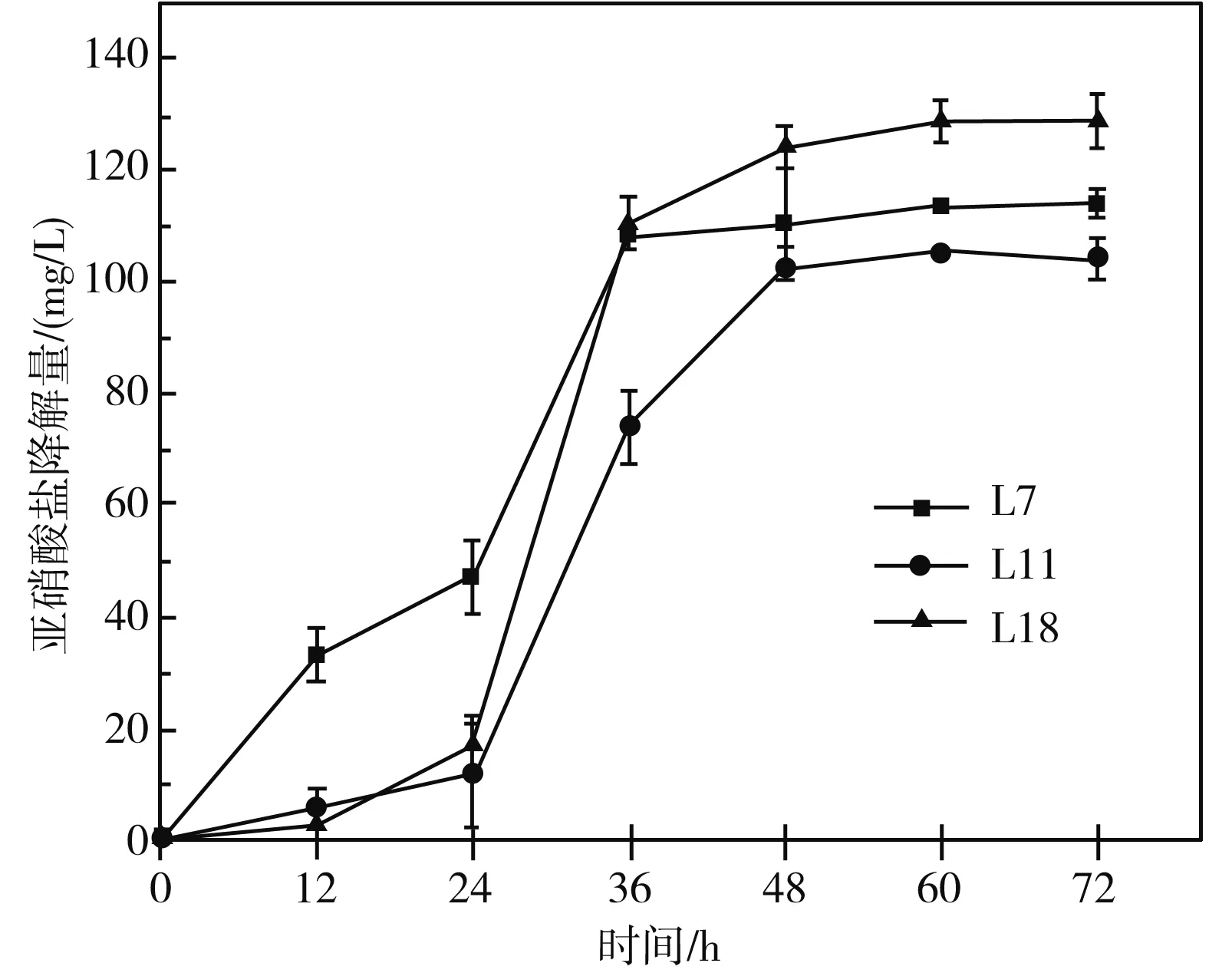
图2 3株乳酸菌降解亚硝酸盐能力Fig.2 Nitrite-degrading ability of three strains of lactic acid bacteria
2.3 生长曲线测定及产酸、耐盐特性结果与分析
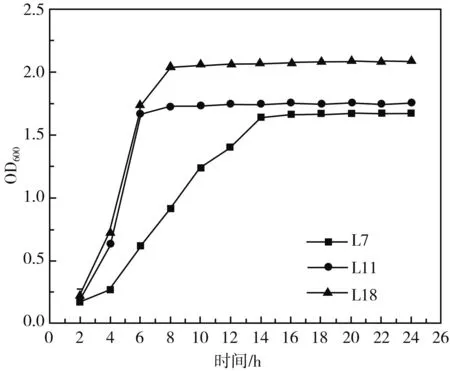
图3 3株乳酸菌的生长曲线图Fig.3 The growth curves of three strains of lactic acid bacteria
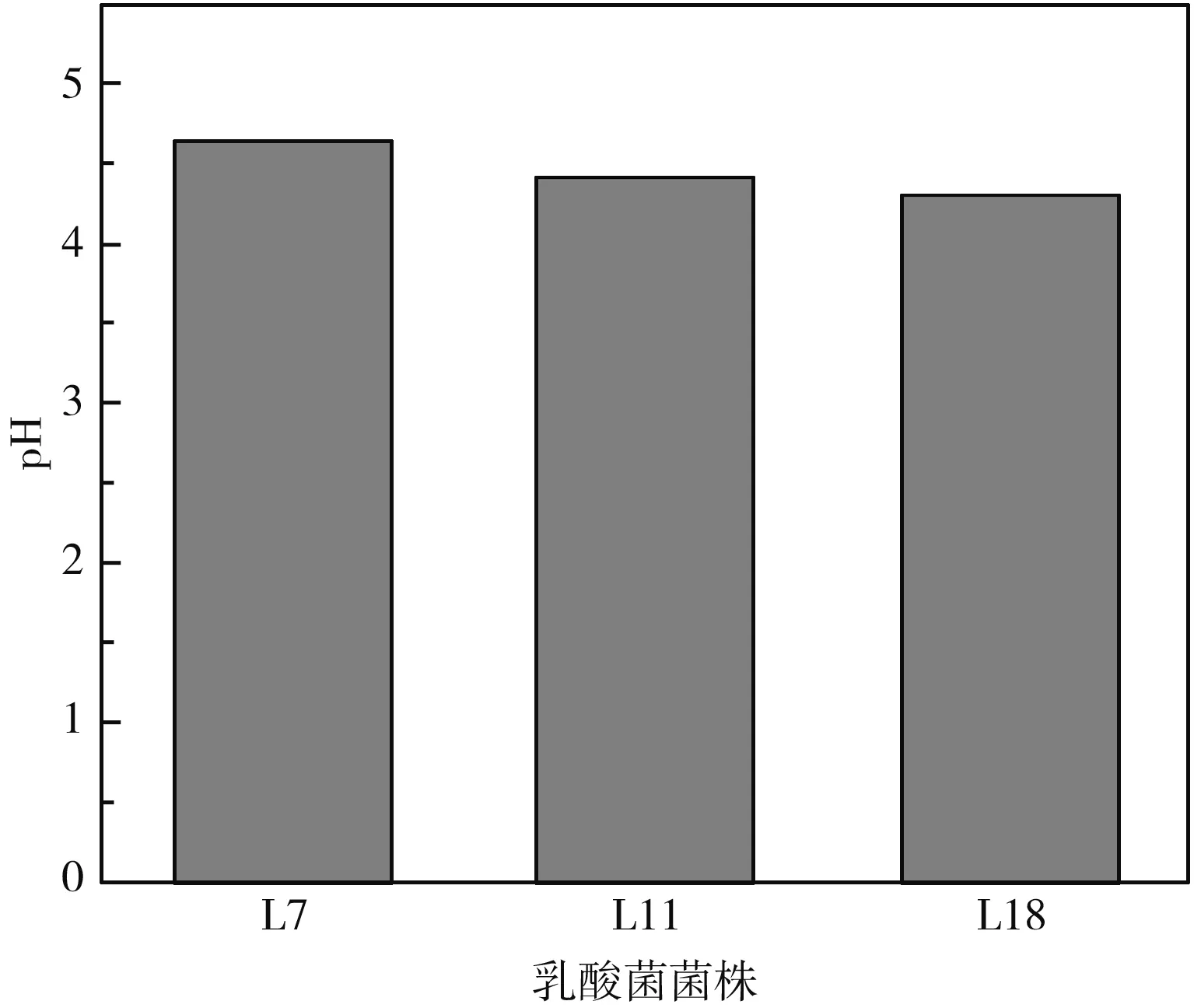
图4 3株乳酸菌发酵后的pH值Fig.4 The pH values of three strains of lactic acid bacteria after fermentation

图5 3株乳酸菌的盐耐受性Fig.5 The salt tolerance of three strains of lactic acid bacteria
3株乳酸菌的生长曲线见图3,L7、L11、L18在2 h时进入对数生长期,L11和L18均在12 h进入稳定期,而L7在接近18 h才进入稳定期;3株菌中,L18的生长活力最强。乳酸菌在泡菜发酵前期需要通过产酸来抑制不耐酸杂菌生长,后期需乳酸菌产酸调节口感,故乳酸菌的产酸能力是较为重要的发酵特性。培养24 h后,3株乳酸菌的pH结果见图4,L18的产酸能力最强,L7的产酸能力最弱,但通过对比分析三者并没有显著性的差异(P<0.05)。因泡菜多加盐水发酵制成,乳酸菌的耐盐性这一发酵特性也值得研究。3株乳酸菌的耐盐性结果见图5,NaCl浓度为0%~10%范围内时,3株乳酸菌的生长会因为NaCl增加受到抑制,NaCl浓度为0%~4%时,菌株L11和L18均能较好地生长;NaCl浓度为6%时,菌株L7比L11和L18生长情况要好,NaCl浓度>6%时,菌株几乎不生长。
2.4 抗氧化特性结果与分析
DPPH清除率和还原性都是细菌抗氧化性能的评价指标,DPPH清除率结果见图6,3株乳酸菌的还原性见图7。3株乳酸菌的细胞悬浮液的DPPH清除率都高于无细胞提取物的清除率。其中,L7的细胞悬浮液的DPPH清除率最高并且已达到(52.47±1.04)%,最低的为L11细胞悬浮液(25.15±0.67)%。而无细胞提取物中L18的DPPH清除率最高,L11次之,L7最低。同一种菌株的细胞悬浮液与无细胞提取物比较:细胞悬浮液的清除能力强于无细胞提取物,L11的两者差值最小,L7的差值最大,达到48.09%。3株乳酸菌的还原能力有一定差异,L18的还原能力最强,细胞悬浮液与无细胞提取物之间有较大差异。L7和L11的细胞悬浮液与无细胞提取物的还原性差异不大,且菌种之间的差异性也不大。

图6 3株乳酸的DPPH清除率Fig.6 The scavenging rates of three strains of lactic acid bacteria on DPPH

图7 3株乳酸菌的还原性Fig.7 The reducing capacity of three strains of lactic acid bacteria
3 结论
实验分离筛选并通过分子鉴定得到3株乳酸菌,L7为肠膜明串珠菌亚种Leuconostocmesenteroidessubsp.jonggajibkimchii,L11为清酒乳酸杆菌亚种Latilactobacillussakeisubsp.sakei,L18为弯曲乳杆菌Latilactobacilluscurvatus。据有关报道[24-25],弯曲乳杆菌Latilactobacilluscurvatus有良好的降解亚硝胺作用,并且已经成为国际公认的新食品原料;肠膜明串珠菌是发酵过程中的启动菌种[26],清酒乳酸杆菌也是发酵过程中十分重要的乳酸菌。实验分离得到的3株菌中,L18菌株在降解亚硝酸盐和还原性方面优于另外两株菌,推测其细胞中具有良好的产还原酶性能,可进一步分析产亚硝酸盐还原酶性能;L7菌株耐盐性能和DPPH清除能力较好。经降解亚硝酸盐能力及耐盐性等发酵特性综合分析,筛选得到的3株乳酸菌均可用于低亚硝酸盐泡菜的生产。
