复合酶法提取石莲花多糖及其护肤特性研究
2022-06-02沈晨露郭嘉文仇小丽倪雅萍姜维娜
沈晨露,孔 昊,郭嘉文,仇小丽,倪雅萍,姜维娜
(南京师范大学泰州学院化学与生物工程学院,江苏 225300)
1 引言
石莲花,景天科拟石莲花属,茎节间短,株型矮小,叶灰绿色,肥厚多汁,是一类多肉植物的统称,也是近年来较流行的小型多肉植物[1]。目前对多功能多肉植物的化学成分、药理和临床等方面的研究取得了一定的进展,但对其有效成分、药理机制方面还有待深入研究[2]。因此,加快多功能多肉植物资源及其药用、观赏,以及作为食用和食品加工原料于一体的综合研究和开发具有重要的意义。
研究表明,多糖类物质是石莲花最主要的活性成分之一,具有降血糖、降血脂、抗氧化、抗肿瘤、保肝、免疫调节、抗病毒、抗炎等疗效[3],并且其在化妆品工业上也有应用,如透明质酸、肝素甲壳素及其衍生物的应用等。目前,常用热水回流法[4]、超声波法[5]、微波法[6]等方法提取多糖成分,热水回流法提取温度高,提取率较低;超声波法和微波法有引起糖苷键断裂的可能,因此,本实验采用果胶酶和纤维素酶的复合酶法来提取石莲花多糖[7]。酶提法能在比较温和的条件下分解植物组织,加速多糖的释放,有着广阔的应用前景。同时,本实验对石莲花多糖的护肤特性进行了相关研究,以此为石莲花多糖的深度开发及其在化妆品等肤用产品中的应用提供一定参考。
2 材料与方法
2.1 材料、试剂与仪器
石莲花,市售;果胶酶、纤维素酶,国药集团化学试剂有限公司。
盐酸、苯酚、硫酸、过二硫酸钾、氢氧化钠、葡萄糖、无水磷酸氢二钠、二水合磷酸二氢钠,分析纯,国药集团化学试剂有限公司;磷酸氢二钾,分析纯,上海凌峰化学试剂。
FA2004型电子分析天平,上海方瑞仪器有限公司;XMTD-701型恒温水浴锅,上海硕光电子科技有限公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;DF-101S型恒温加热磁力搅拌器,上海百申仪器设备有限公司;LGJ-12S型真空冷冻干燥机,北京松源华兴科技发展有限公司;WFZ UV-2000型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;P8型皮肤水分测试仪,深圳市朵美琳科技有限公司;Bruker VERTEX 80 V傅里叶变换红外光谱仪
2.2 从石莲花叶中提取多糖
采用复合酶解法提取石莲花中的多糖。取新鲜的石莲花叶肉洗净去皮,研磨碾碎,以料液比1:20(g/ml)加入到蒸馏水中,用磷酸盐缓冲液调节溶液的pH[8],加入5.0 %的复合酶量(纤维素酶-果胶酶,比例为2:1,先加入纤维素酶后加入果胶酶),在设定的温度条件下于水浴锅中加热一定时间,酶解后将温度升高到100 ℃灭酶10 min终止酶解反应,离心,提取上清液进行旋转浓缩至10 ml,5倍体积的无水乙醇,混匀;在低温冰箱中静置12 h,再于3000 r/min的转速离心10 min左右,收集沉淀并冷冻干燥。
2.3 石莲花多糖的含量测定
采用苯酚-硫酸法[9],在490 nm处测吸光度。以葡萄糖浓度(c)为横坐标、吸光度(A)为纵坐标绘制标准曲线,拟合得葡萄糖标准曲线方程为:A=27.424c-0.005900,R2=0.9992。按下式计算石莲花多糖提取率[10]:
多糖质量浓度( %)=(C×V×D×M)/(m×W)
式中C为标准曲线上查得的浓度(mg/mL);V为定容体积(mL);D为稀释倍数;m为测定所用的粗多糖质量(mg);M为粗多糖质量(g);W为称取的石莲花叶片重量(g)。
2.4 单因素实验
按照“2.2”项下的方法,对提取工艺中酶解时间、温度、溶液pH进行考察:①在溶液pH为4.5,酶解时间为210 min的条件下,以酶解温度35 ℃、40 ℃、45 ℃、50 ℃、55 ℃分别进行提取[11];②在酶解温度为50 ℃,溶液pH为4.5,其他条件不变的情况下,用复合酶法提取180 min、210 min、240 min、270 min、300 min[12];③在酶解温度为50 ℃,酶解时间为270 min,其他条件不变的情况下,以溶液pH为3、4、5、6、7分别进行提取[13]。
2.5 红外光谱分析
石莲花样品用FT-IR分光光度计进行分析。样品用KBr粉末研磨并压制成1毫米颗粒,红外分析的吸光度模式为4000-500 cm-1,进行FT-IR分析[14]。
2.6 保湿性的测定
将石莲花多糖配制成50 mg/ml的溶液。随机选取十名志愿者,在受试者手臂内侧5 cm处标记作为测试区域,将多糖溶液均匀的涂抹在测试区域,每个测试区涂抹1 ml样品溶液。采用皮肤水分测试仪,分别测量未涂抹样品前、涂抹样品后10 min、30 min、50 min、60 min、120 min测试区域的皮肤水分含量,以评价石莲花多糖的保湿性能。
2.7 抗紫外活性测定
配制浓度为2.5 mg/ml的石莲花多糖溶液,用分光光度计测量其在吸收波长220 nm-600 nm之间的吸光度。
2.8 抗氧化性能测定
采用ABTS法[15],取0.8 mLABTS工作液进行实验,加入95 %的乙醇0.2 mL,振摇10 s使其充分混合,静置6 min后测试吸光度。记录734 nm处的吸光值A0。
再次取0.8 mLABTS工作液,加入多糖溶液0.2 mL,振摇10 s充分混合后,静置6 min后测试吸光度。测试734 nm处的吸光值A。根据公式计算自由基清除率
ABTS自由基清除率=(1-A/A0)×100 %
其中A0为对照组的吸光度,A为石莲花多糖的吸光度。
3 结果与讨论
3.1 单因素实验结果
3.1.1 温度对石莲花多糖提取率的影响(图1)
如图1所示,随着提取温度的增加,石莲花多糖得率逐渐增加,在温度超过50 ℃后多糖得率反而下降,在50 ℃提取得率达到最大值。这可能是随着温度的升高,酶的活性也随之增强,大大提高了复合酶对细胞壁的破坏能力,促进多糖从裂解的细胞中溶出;而温度过高时,酶蛋白变性,复合酶的活性逐渐丧失或多糖糖苷键断裂,使多糖的溶出受到影响,因而得率下降。故以50 ℃作为最优的酶解温度。

图1 温度对石莲花多糖提取率的影响
3.1.2 酶解时间对石莲花多糖提取率的影响(图2)
如图2所示,酶解时间在180 min-270 min之间,石莲花多糖得率不断上升;而在时间超过270 min后得率开始下降,最终得到在270 min时多糖得率最高。这可能是在适宜的酶解时间内,复合酶与石莲花叶肉充分反应,从而使石莲花叶肉细胞壁组织结构被充分破坏,有利于多糖的溶出;但当时间过长时,杂质可能也会被提取出来,以致多糖的提取被抑制,同时多糖结构发生变化,也使得多糖得率降低。故以270 min为最优的酶解时间。
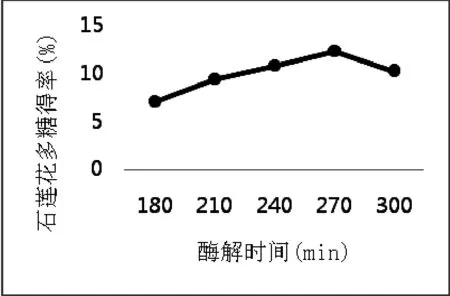
图2 酶解时间对石莲花多糖提取率的影响
3.1.3 溶液pH对石莲花多糖提取率的影响(图3)
如图3所示,当溶液pH值逐渐的升高,石莲花多糖得率呈不断下降趋势;在pH为3时,多糖得率达到最高。这可能是复合酶的生物效应受溶液pH的影响较大,同时过酸或过碱的环境会造成多糖中糖苷键的断裂,使得多糖结构遭到破坏,多糖得率降低。故以pH值为3为最优的溶液pH值。
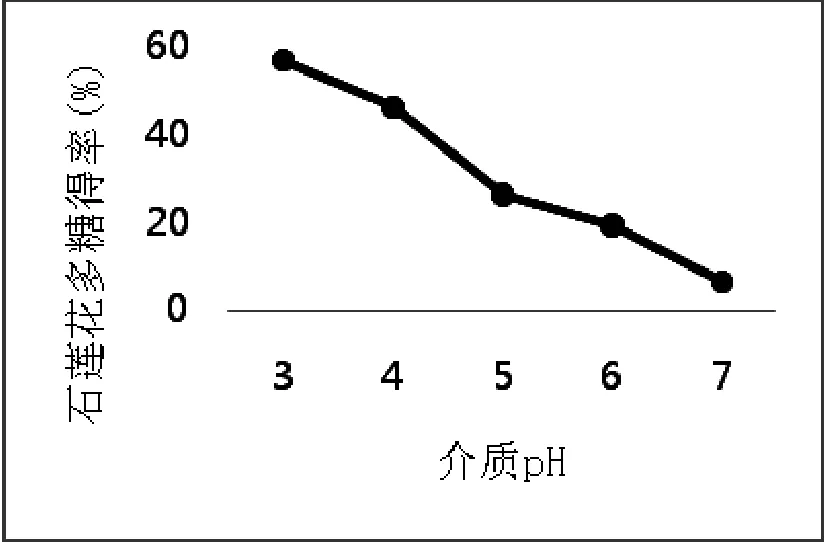
图3 溶液pH对石莲花多糖提取率的影响
3.2 含量测定结果
根据标准曲线和表1的数据,可得到最佳提取工艺提取的石莲花粗多糖的平均含量为6.09 %。

表1 多糖含量测定数据
3.3 石莲花多糖的FT-IR分析
图4显示了石莲花多糖的吸收峰特征,根据与茯苓多糖、魔芋甘露多糖等红外光谱图[16]的对比,其吸收峰和对应的化学基团分别是:3393 cm-1(-OH的伸缩振动),2930 cm-1和2426 cm-1(-C-H的伸缩振动),1609 cm-1(-OH的弯曲振动),1416 cm-1(=CH2的变形振动),1079 cm-1和1022 cm-1(C-O-H,C-O-C振动)、881 cm-1(β-糖苷键)。通过红外光谱的分析,可以推测得到的多糖属于β多糖。
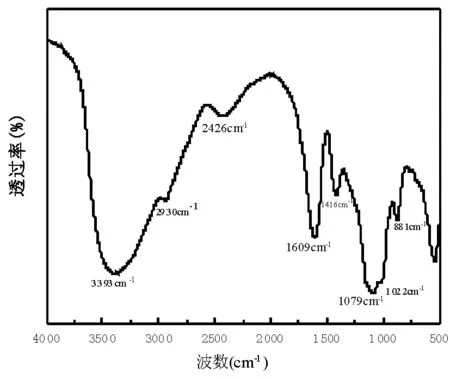
图4 石莲花多糖的FT-IR图谱
3.4 保湿性结果
根据图5可以看出,石莲花多糖溶液在涂上样品后的一个小时内可以保持不错的水分含量,但其水分含量呈下降趋势,在短时间内具有良好的保湿效果。后续会进一步在不同年龄,不同性别的实验对象中展开研究。
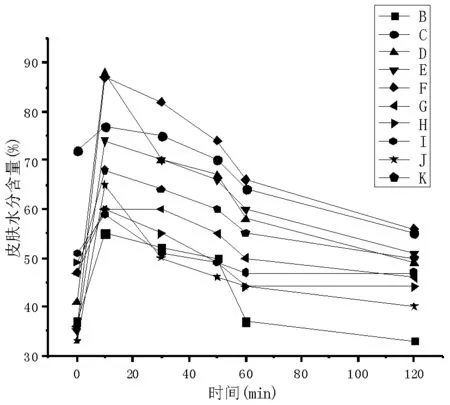
图5 石莲花多糖的保湿性效果
3.5 抗紫外活性结果
根据图6可知,石莲花多糖溶液在吸收波段有峰值,说明石莲花多糖有一定的抗UV活性。
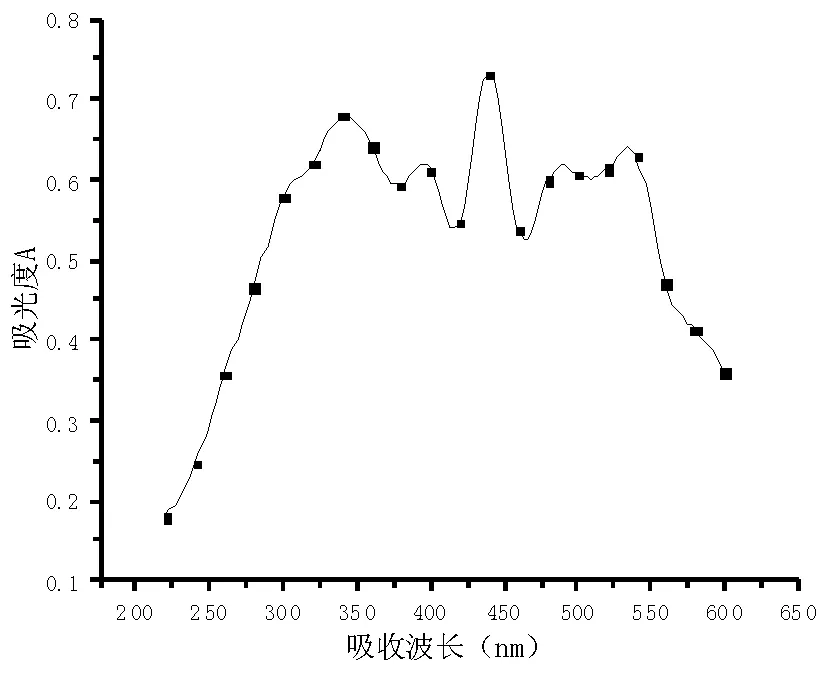
图6 石莲花多糖的抗紫外活性
3.6 抗氧化性结果
采用ABTS法,测得在波长为734 nm处,A0=0.2080,A=0.1000
ABTS自由基清除率=(1-A/A0)×100 %=(1-0.1000/0.2080)×100 %=51.92 %
由此可知,石莲花多糖具有一定的抗氧化活性,但其方法存在多糖析出,影响吸光值的问题,仍需继续研究。
4 结论
以石莲花多糖提取率为评价指标,采用单因素实验优化了石莲花多糖的复合酶法提取工艺。确定复合酶法提取石莲花多糖的最佳工艺条件为:复合酶用量为5.0 %、料液比1:20(g/ml)、酶解温度为50 ℃、提取时间为270 min、pH值为3,在此条件下,提取得石莲花粗多糖的含量大致在6.09 %左右。石莲花多糖具有一定的保湿性、抗紫外活性和抗氧化活性,对于其深度开发利用还必须进行更深入的作用机制研究。
